粤教版九下化学 8.3酸和碱的反应 课件(23张ppt)
文档属性
| 名称 | 粤教版九下化学 8.3酸和碱的反应 课件(23张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-03 15:05:40 | ||
图片预览






文档简介
(共22张PPT)
8.3 酸与碱的反应
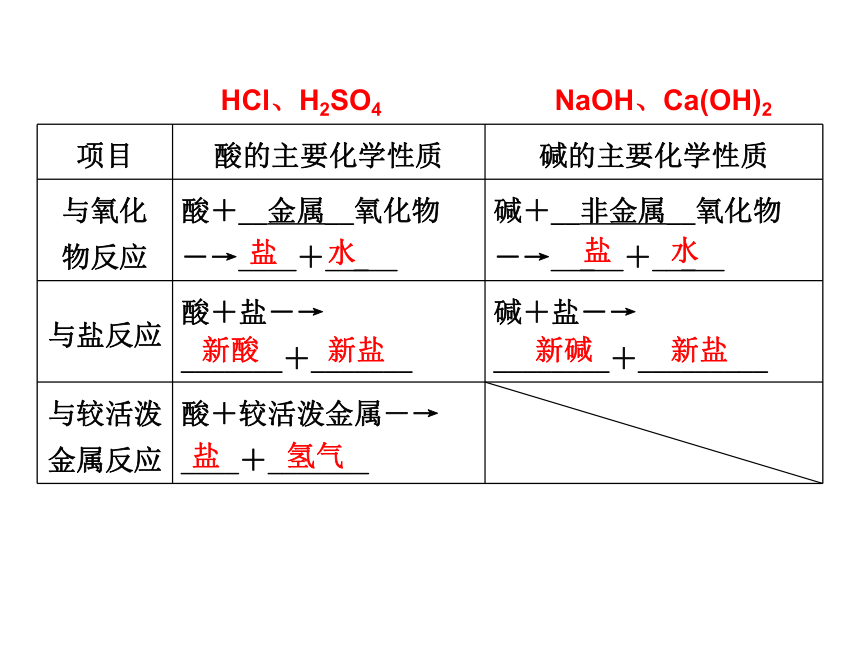
项目 酸的主要化学性质 碱的主要化学性质
与指
示剂
作用 紫色
石蕊 使紫色石蕊
溶液变_____ 使紫色石蕊
溶液变____
无色
酚酞 无色酚酞
溶液__________ 使无色酚酞
溶液_______
红
不变色
蓝
变红
酸、碱的化学性质
项目 酸的主要化学性质 碱的主要化学性质
与氧化
物反应 酸+__金属__氧化物
―→____+_____ 碱+__非金属__氧化物
―→_____+_____
与盐反应 酸+盐―→
_______+_______ 碱+盐―→
________+_________
与较活泼
金属反应 酸+较活泼金属―→
____+_______
盐
水
盐
水
新酸
新盐
新碱
新盐
盐
氢气
HCl、H2SO4
NaOH、Ca(OH)2
【思考】
酸和碱溶液分别由以下离子组成
1)酸— + 酸根离子
2)碱—金属离子 +
3)酸溶液都含有相同的阳离子是 。
4)碱溶液都含有相同的阴离子是 。
氢离子
氢氧根离子
H+
(Cl- 、SO42-等)
OH-
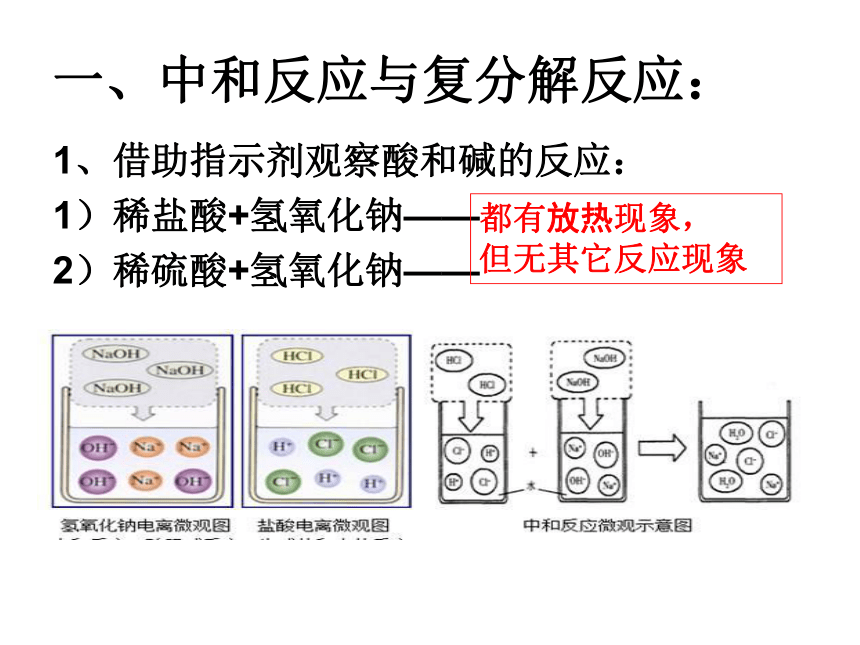
一、中和反应与复分解反应:
1、借助指示剂观察酸和碱的反应:
1)稀盐酸+氢氧化钠——
2)稀硫酸+氢氧化钠——
都有放热现象,
但无其它反应现象
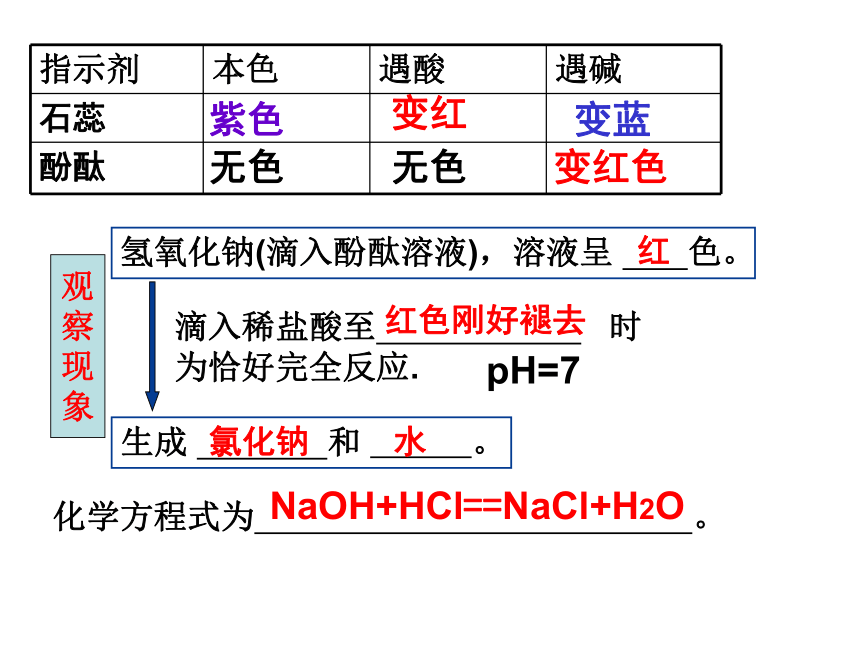
指示剂 本色 遇酸 遇碱
石蕊
酚酞
紫色
变红
变蓝
无色
无色
变红色
氢氧化钠(滴入酚酞溶液),溶液呈 色。
观
察
现
象
滴入稀盐酸至 时为恰好完全反应.
生成 和 。
红
红色刚好褪去
氯化钠 水
NaOH+HCl==NaCl+H2O
化学方程式为 。
pH=7
【同步拓展】
其它酸和碱的反应,写出化学方程式:
1、氢氧化钠+稀硫酸——
2、氢氧化钙+稀盐酸——
3、氢氧化钙+稀硫酸——
NaOH+H2SO4 = Na2SO4+ H2O
2
2
Ca(OH)2+2HCl = CaCl2+2H2O
Ca(OH)2+H2SO4 = CaSO4+2H2O
酸
碱
盐
水
+
+
中和反应
【讨论】1、以下属于中和反应的是( )
① Fe2O3+ 6HCl = 2FeCl3 + 3H2O
② Ca(OH)2+2HNO3= Ca(NO3)2+2H2O
③ Ca(OH)2+Na2CO3=CaCO3 +2NaOH
2、上述三个反应有何共同特点?属于哪个基本反应类型?
参加反应的两种化合物相互交换成分(离子),生成另外两种化合物。
这类反应叫做 。
(基本反应类型④)
②
复分解反应
3、若用AB和CD分别表示两种化合物,如何表示复分解反应的通式:
AB+CD=AD+CB
其中4种离子A+ 、B-、C+、D-
CB
AD
重新组合
【化学锦囊】
酸、碱、盐这几类化合物之间发生的基本反应类型是复分解反应,中和反应也属于复分解反应。书写化学方程式时注意离子的化合价和原子团。
【小结】
1、酸+碱——盐+水
这样的反应称为中和反应。
中和反应一般有放热现象。
2、由两种化合物相互交换成分(离子),生成另外两种化合物的反应,叫做复分解反应。(第4个基本反应类型)
通式为:AB+CD=AD+CB
酸+碱 酸+盐 碱+盐 盐+盐
这几种反应都属于复分解反应。
【巩固训练】
1、把一定量稀硫酸装于锥形瓶中,滴2滴石蕊溶液,再不断滴入氢氧化钠溶液至过量锥形瓶中溶液颜色的变化情况为【 】
A紫色-红色-蓝色 B蓝色-紫色-红色
C红色-紫色-蓝色 D红色-蓝色-紫色
2、常用于中和酸性土壤的碱是 【 】
A石灰石 B烧碱 C生石灰 D熟石灰
C
D
3、下列不属于复分解反应的是【 】
A CH4 + 2O2 == CO2 + 2H2O
B F2O3 + 6HCl == 2FeCl3 + 3H2O
C CaCO3 +2HCl ==CaCl2 +H2O + CO2
D 2NaOH + H2SO4 == Na2SO4 + 2H2O
点燃
A
例. 在研究酸和碱的化学性质时,某小组想证明稀盐酸和氢氧化钠溶液混合后,虽然无明显现象,但确实发生了反应,设计了以下实验。
(1)当滴入几滴酚酞溶液后,溶液由无色变为____色,滴加一定量稀盐酸后,______________,根据上述试验中颜色变化,可确定稀盐酸和氢氧化钠发生了反应,
方程式为___________________________
(2)画出烧杯中溶液pH值随加入稀盐酸的质量变化曲线。
红
红色褪去
HCl + NaOH NaCl + H2O
1. 探究盐酸和氢氧化钠的反应中溶液的pH的变化规律,得到下图曲线,关于该实验的事实说法正确的是( )
A 该实验是把氢氧化钠溶液滴入盐酸中;
B c点表示两者恰好完全反应;
C a点时溶液使酚酞变红;pH
D c点时溶液中溶质只有
氯化钠。
滴入溶液量
7 b
a
c
C
1.人体口腔内唾液的pH通常约为7,在进食过程的最初10分钟,酸性逐渐增强,之后酸性逐渐减弱,至40分钟趋于正常。与上述事实最接近的图象是( )
B
二、中和反应的应用:
二、中和反应的应用:
1、为了中和鱼塘底泥中过多的有机酸,养鱼农户一般向塘底撒 。
2、人们利用 的碱性,改良酸性土壤或水源,以减少酸雨的危害。
3、工厂废水如果含有硫酸或盐酸等物质,可用 或 将其中和以后再排放。写出其中一个化学方程式。
熟石灰
熟石灰
废烧碱 熟石灰
2NaOH+H2SO4=Na2SO4+2H2O
4、被蚊虫叮咬实际是它们向你的皮肤“注射”了蚁酸(甲酸),这时可涂抹 性的物质来中和以减轻疼痛,如 、 、稀氨水或清凉油等。
5、治疗胃酸(主要是盐酸)过多的“胃舒平”含有 ,其作用是 ,写出化学方程式:
弱碱
肥皂水 小苏打
氢氧化铝
中和过量的盐酸
Al(OH)3+3HCl=AlCl3+3H2O
【拓展】雨水的 ,就是酸雨。
酸雨形成的原因是 燃烧后产生的烟气中含有__________ 和 ,排到空气中被云吸收形成 ,化学方程式为:
pH<5.6
化石燃料
二氧化硫
氮氧化物
酸雾
SO2+H2O=H2SO3 SO3+H2O=H2SO4
亚硫酸
硫酸
Ca(OH)2+SO2=CaSO3 + H2O
常用石灰水吸收工厂废气中的二氧化硫:
亚硫酸钙
【小结】
1、酸+碱——盐+水
这样的反应称为中和反应。
中和反应一般有放热现象。
2、由两种化合物相互交换成分(离子),生成另外两种化合物的反应,叫做复分解反应。(第4个基本反应类型)
通式为:AB+CD=AD+CB
酸+碱 酸+盐 碱+盐 盐+盐
这几种反应都属于复分解反应。
复分解反应规律:用—连接能发生复分解反应的
酸
碱
盐
金属氧化物
盐
复分解之家
3、将下列各组物质的稀溶液混合,能共存且形成无色溶液的是【 】
A. Na2CO3 KCl Ca(OH)2
B. FeCl3 HCl MgSO4
C. H2SO4 NH4Cl KNO3
D. AgNO3 HCl HNO3
CaCO3
AgCl
C
橙黄色
8.3 酸与碱的反应
项目 酸的主要化学性质 碱的主要化学性质
与指
示剂
作用 紫色
石蕊 使紫色石蕊
溶液变_____ 使紫色石蕊
溶液变____
无色
酚酞 无色酚酞
溶液__________ 使无色酚酞
溶液_______
红
不变色
蓝
变红
酸、碱的化学性质
项目 酸的主要化学性质 碱的主要化学性质
与氧化
物反应 酸+__金属__氧化物
―→____+_____ 碱+__非金属__氧化物
―→_____+_____
与盐反应 酸+盐―→
_______+_______ 碱+盐―→
________+_________
与较活泼
金属反应 酸+较活泼金属―→
____+_______
盐
水
盐
水
新酸
新盐
新碱
新盐
盐
氢气
HCl、H2SO4
NaOH、Ca(OH)2
【思考】
酸和碱溶液分别由以下离子组成
1)酸— + 酸根离子
2)碱—金属离子 +
3)酸溶液都含有相同的阳离子是 。
4)碱溶液都含有相同的阴离子是 。
氢离子
氢氧根离子
H+
(Cl- 、SO42-等)
OH-
一、中和反应与复分解反应:
1、借助指示剂观察酸和碱的反应:
1)稀盐酸+氢氧化钠——
2)稀硫酸+氢氧化钠——
都有放热现象,
但无其它反应现象
指示剂 本色 遇酸 遇碱
石蕊
酚酞
紫色
变红
变蓝
无色
无色
变红色
氢氧化钠(滴入酚酞溶液),溶液呈 色。
观
察
现
象
滴入稀盐酸至 时为恰好完全反应.
生成 和 。
红
红色刚好褪去
氯化钠 水
NaOH+HCl==NaCl+H2O
化学方程式为 。
pH=7
【同步拓展】
其它酸和碱的反应,写出化学方程式:
1、氢氧化钠+稀硫酸——
2、氢氧化钙+稀盐酸——
3、氢氧化钙+稀硫酸——
NaOH+H2SO4 = Na2SO4+ H2O
2
2
Ca(OH)2+2HCl = CaCl2+2H2O
Ca(OH)2+H2SO4 = CaSO4+2H2O
酸
碱
盐
水
+
+
中和反应
【讨论】1、以下属于中和反应的是( )
① Fe2O3+ 6HCl = 2FeCl3 + 3H2O
② Ca(OH)2+2HNO3= Ca(NO3)2+2H2O
③ Ca(OH)2+Na2CO3=CaCO3 +2NaOH
2、上述三个反应有何共同特点?属于哪个基本反应类型?
参加反应的两种化合物相互交换成分(离子),生成另外两种化合物。
这类反应叫做 。
(基本反应类型④)
②
复分解反应
3、若用AB和CD分别表示两种化合物,如何表示复分解反应的通式:
AB+CD=AD+CB
其中4种离子A+ 、B-、C+、D-
CB
AD
重新组合
【化学锦囊】
酸、碱、盐这几类化合物之间发生的基本反应类型是复分解反应,中和反应也属于复分解反应。书写化学方程式时注意离子的化合价和原子团。
【小结】
1、酸+碱——盐+水
这样的反应称为中和反应。
中和反应一般有放热现象。
2、由两种化合物相互交换成分(离子),生成另外两种化合物的反应,叫做复分解反应。(第4个基本反应类型)
通式为:AB+CD=AD+CB
酸+碱 酸+盐 碱+盐 盐+盐
这几种反应都属于复分解反应。
【巩固训练】
1、把一定量稀硫酸装于锥形瓶中,滴2滴石蕊溶液,再不断滴入氢氧化钠溶液至过量锥形瓶中溶液颜色的变化情况为【 】
A紫色-红色-蓝色 B蓝色-紫色-红色
C红色-紫色-蓝色 D红色-蓝色-紫色
2、常用于中和酸性土壤的碱是 【 】
A石灰石 B烧碱 C生石灰 D熟石灰
C
D
3、下列不属于复分解反应的是【 】
A CH4 + 2O2 == CO2 + 2H2O
B F2O3 + 6HCl == 2FeCl3 + 3H2O
C CaCO3 +2HCl ==CaCl2 +H2O + CO2
D 2NaOH + H2SO4 == Na2SO4 + 2H2O
点燃
A
例. 在研究酸和碱的化学性质时,某小组想证明稀盐酸和氢氧化钠溶液混合后,虽然无明显现象,但确实发生了反应,设计了以下实验。
(1)当滴入几滴酚酞溶液后,溶液由无色变为____色,滴加一定量稀盐酸后,______________,根据上述试验中颜色变化,可确定稀盐酸和氢氧化钠发生了反应,
方程式为___________________________
(2)画出烧杯中溶液pH值随加入稀盐酸的质量变化曲线。
红
红色褪去
HCl + NaOH NaCl + H2O
1. 探究盐酸和氢氧化钠的反应中溶液的pH的变化规律,得到下图曲线,关于该实验的事实说法正确的是( )
A 该实验是把氢氧化钠溶液滴入盐酸中;
B c点表示两者恰好完全反应;
C a点时溶液使酚酞变红;pH
D c点时溶液中溶质只有
氯化钠。
滴入溶液量
7 b
a
c
C
1.人体口腔内唾液的pH通常约为7,在进食过程的最初10分钟,酸性逐渐增强,之后酸性逐渐减弱,至40分钟趋于正常。与上述事实最接近的图象是( )
B
二、中和反应的应用:
二、中和反应的应用:
1、为了中和鱼塘底泥中过多的有机酸,养鱼农户一般向塘底撒 。
2、人们利用 的碱性,改良酸性土壤或水源,以减少酸雨的危害。
3、工厂废水如果含有硫酸或盐酸等物质,可用 或 将其中和以后再排放。写出其中一个化学方程式。
熟石灰
熟石灰
废烧碱 熟石灰
2NaOH+H2SO4=Na2SO4+2H2O
4、被蚊虫叮咬实际是它们向你的皮肤“注射”了蚁酸(甲酸),这时可涂抹 性的物质来中和以减轻疼痛,如 、 、稀氨水或清凉油等。
5、治疗胃酸(主要是盐酸)过多的“胃舒平”含有 ,其作用是 ,写出化学方程式:
弱碱
肥皂水 小苏打
氢氧化铝
中和过量的盐酸
Al(OH)3+3HCl=AlCl3+3H2O
【拓展】雨水的 ,就是酸雨。
酸雨形成的原因是 燃烧后产生的烟气中含有__________ 和 ,排到空气中被云吸收形成 ,化学方程式为:
pH<5.6
化石燃料
二氧化硫
氮氧化物
酸雾
SO2+H2O=H2SO3 SO3+H2O=H2SO4
亚硫酸
硫酸
Ca(OH)2+SO2=CaSO3 + H2O
常用石灰水吸收工厂废气中的二氧化硫:
亚硫酸钙
【小结】
1、酸+碱——盐+水
这样的反应称为中和反应。
中和反应一般有放热现象。
2、由两种化合物相互交换成分(离子),生成另外两种化合物的反应,叫做复分解反应。(第4个基本反应类型)
通式为:AB+CD=AD+CB
酸+碱 酸+盐 碱+盐 盐+盐
这几种反应都属于复分解反应。
复分解反应规律:用—连接能发生复分解反应的
酸
碱
盐
金属氧化物
盐
复分解之家
3、将下列各组物质的稀溶液混合,能共存且形成无色溶液的是【 】
A. Na2CO3 KCl Ca(OH)2
B. FeCl3 HCl MgSO4
C. H2SO4 NH4Cl KNO3
D. AgNO3 HCl HNO3
CaCO3
AgCl
C
橙黄色
