2019年粤科版九年级上册化学解读 第二章 空气、物质的构成课件(共49张PPT)
文档属性
| 名称 | 2019年粤科版九年级上册化学解读 第二章 空气、物质的构成课件(共49张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 892.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-04 17:06:26 | ||
图片预览










文档简介
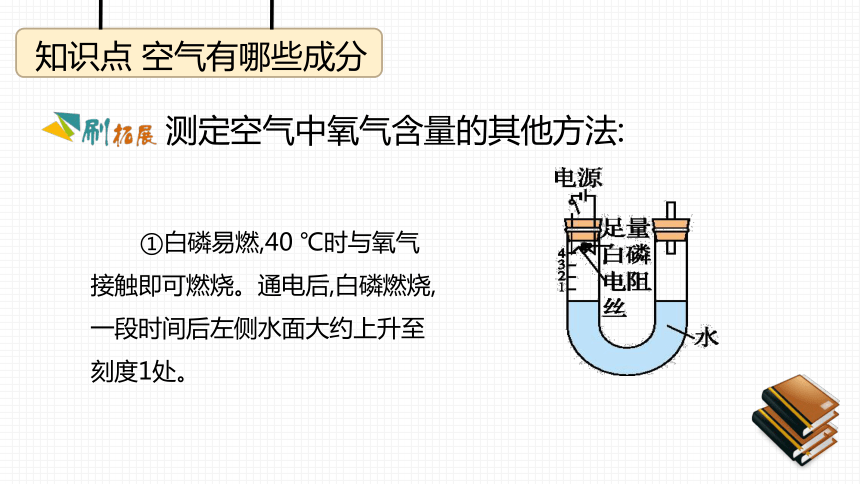
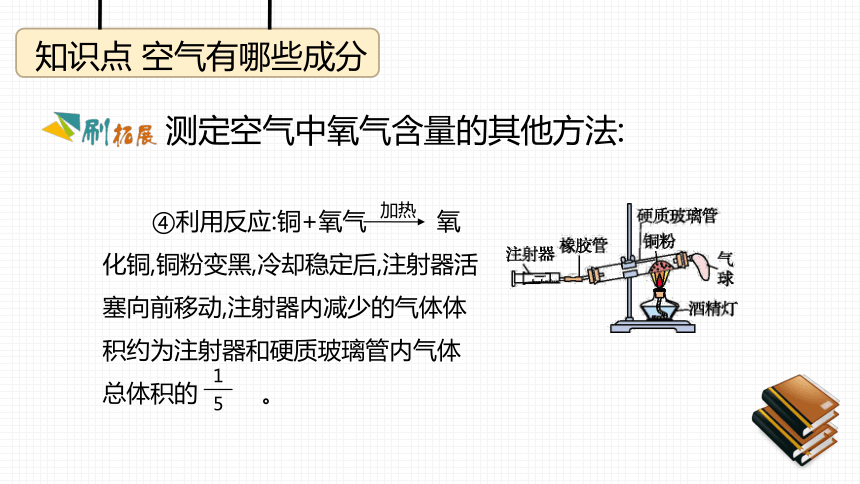
课件49张PPT。学科素养课件第二章 空气、物质的构成2.1 空气的成分知识点 空气有哪些成分测定空气中氧气含量的其他方法: ①白磷易燃,40 ℃时与氧气接触即可燃烧。通电后,白磷燃烧,一段时间后左侧水面大约上升至刻度1处。知识点 空气有哪些成分测定空气中氧气含量的其他方法: ②白磷燃烧,活塞先向右移动,冷却后,活塞左移大约至刻度4处。知识点 空气有哪些成分 ③红磷燃烧,冷却至室温打开弹簧夹,水进入集气瓶,进入的水的体积约占集气瓶内原有空气总体积的 。测定空气中氧气含量的其他方法:知识点 空气有哪些成分测定空气中氧气含量的其他方法: ④利用反应:铜+氧气 氧化铜,铜粉变黑,冷却稳定后,注射器活塞向前移动,注射器内减少的气体体积约为注射器和硬质玻璃管内气体总体积的 。知识点 空气有哪些成分原始大气和现代空气的成分是不一样的 (1)空气的成分以氮气、氧气为主,是长期以来自然界里各种变化所造成的。
(2)在原始的绿色植物出现以前,原始大气是以一氧化碳、二氧化碳、甲烷和氨为主的。在绿色植物出现以后,植物通过光合作用,产生氧气,使原始大气里的一氧化碳转化为二氧化碳,甲烷转化为水蒸气和二氧化碳,氨转化为水蒸气和氮气。知识点 空气有哪些成分原始大气和现代空气的成分是不一样的 (3)由于植物的光合作用持续进行,空气里的二氧化碳在植物发生光合作用的过程中被吸收了大部分,并使空气里的氧气越来越多,终于形成了以氮气和氧气为主的现代空气。由此可见,空气的成分始终以极慢的速率变化着。 稀有气体的化学性质很不活泼,可以防止食品被氧化,但稀有气体的含量太低,提取的成本很高,所以一般不用稀有气体作食品的保护气。现在大多用氮气。知识点 氮气和稀有气体有用吗稀有气体的性质不活泼,为什么生活中一般不用稀有气体作食品中的保鲜剂? 氦气可用来代替氮气作人造空气,供深海潜水员呼吸。因为在压强较大的深海里,用普通空气呼吸,氮气会随着海水中压强的增大,在血液里的溶解度跟着增大,因此会有较多的氮气溶解在血液里。氦气在血液里的溶解度比氮气小得多,用氦气跟氧气的混合气体代替普通空气,就不会发生上述现象。知识点 氮气和稀有气体有用吗知识点 探究我们的呼吸作用 二氧化碳能使澄清石灰水变浑浊,是因为生成了白色不溶于水的固体物质,这是检验二氧化碳的特征反应。有关二氧化碳的相关知识,将在第五章中学习。 这也是一种常见的排水法,方便快捷。尤其是收集一些对空气有污染的气体,非常适用。这套装置还有一个优点是通过排出水的体积的测量,可以得出收集气体的体积。知识点 探究我们的呼吸作用千奇百怪的排水法。 空气中的气体含量与呼出气体成分对比结果释疑:因为动物和人的呼吸作用,需要消耗氧气,释放二氧化碳。人体在吸入空气之后,氧气在体内发生化学反应,释放出二氧化碳和水蒸气。所以,空气中的氧气多于呼出气体中的氧气,空气中的二氧化碳和水蒸气少于呼出气体。知识点 探究我们的呼吸作用 PM2.5是指大气中粒径小于或等于2.5 μm的细颗粒物,PM2.5直径小,富含大量的有毒、有害物质且在大气中停留时间长,输送距离远,因而对人体健康和大气环境质量的影响很大。PM2.5主要来源于燃煤、焚烧秸秆、烧烤、机动车出行、餐饮油烟、建筑施工扬尘等。知识点 空气污染及防治第二章 空气、物质的构成2.2 构成物质的微粒(Ⅰ)——分子知识点 分子是什么 用两根玻璃棒分别在浓氨水和浓盐酸中蘸一下,然后将这两根玻璃棒靠近(不要接触),如图,可观察到空气中产生大量白烟。知识点 分子是什么分子不能保持物质的物理性质。 因为物质的物理性质如颜色、状态、熔点、沸点、密度、硬度等都是该物质大量分子聚集所表现的属性,是宏观现象,它不能由单个分子表现出来。例如单个分子就不能用固态、液态、气态来描述。而同种物质的每一个分子却都有相同的化学性质,所以分子不能保持物质的物理性质。知识点 分子有什么特性 如图所示,将一定体积的水和酒精混合,总体积变小,说明分子间存在间隔;溶液全部变红,说明分子是不断运动的。知识点 分子有什么特性 按图中装置使有色且密度比空气大的二氧化氮气体放在下瓶,当抽去玻璃片后,看到有色气体扩散到上瓶,下瓶颜色逐渐变浅,这一现象可以证明分子在不断运动。知识点 分子有什么特性 (1)酒精与水混合后,体积小于二者的体积之和,这是因为分子间有间隔。知识点 分子有什么特性 (2)糖水的体积小于糖块和水的体积之和。知识点 探究我们的呼吸作用 二氧化碳能使澄清石灰水变浑浊,是因为生成了白色不溶于水的固体物质,这是检验二氧化碳的特征反应。有关二氧化碳的相关知识,将在第五章中学习。第二章 空气、物质的构成2.3 构成物质的微粒(Ⅱ)——原子和离子知识点 原子是什么 原子是化学变化中的最小微粒,但不是最小的粒子,离开化学变化这一前提,原子还可以再分。 (1)从分子和原子的角度看物质的变化的实质。
(2)物理变化实质是分子本身不变,只是分子间的间隔发生改变。
(3)化学变化实质是分子分裂成原子,原子重新构成新分子或直接构成新物质的过程。知识点 原子是什么 卢瑟福用α粒子轰击金箔的实验,α粒子(带正电)在该实验中的运动轨迹如下:知识点 原子内部有何奥秘原子内部结构揭秘——散射实验。知识点 原子内部有何奥秘原子内部结构揭秘——散射实验。 对于上述三种实验现象,理解和解释如下:①极少部分α粒子被弹了回来,说明原子核质量大;②一小部分α粒子改变了原来的运动方向,说明原子核带正电荷;③大多数α粒子能穿透金箔而不改变原来的运动方向说明金原子中有一个相对很大的空间,原子不是实心球体,原子核体积小。 (1)1803年,道尔顿提出:构成物质的最小粒子是原子,原子是不可再分的实心球体。
(2)1897年,汤姆逊在原子内部发现了电子,人们终于抛弃了原子不可分割的陈旧观念。知识点 原子内部有何奥秘原子结构的探索历程: (3)1911年,卢瑟福通过精密的实验证明在原子中心有一个极小的核,电子绕核做高速旋转运动。知识点 原子内部有何奥秘原子结构的探索历程: 在原子中,电子层并不是真实存在的,只是科学家为了研究方便,进行的一种人为规定,是理想上的假设而已。知识点 用原子结构示意图表示原子结构 电子在原子核外排布时,要尽可能使电子的能量最低。比方说,我们站在地面上,不会觉得有什么危险;如果我们站在20层楼的楼顶,再往下看时我们心里感到害怕。这是因为物体在越高处具有的势能越大,物体总有从高处往低处的一种趋势,就像自由落体一样,我们从来没有见过物体会自动从地面上升到空中,物体要从地面到空中,必须要有外加力的作用。电子本身就是一种物质,也具有同样的性质。知识点 用原子结构示意图表示原子结构 相对稳定结构:当电子层只有一层时,排满2个电子就达到稳定结构(2电子结构);当电子层有两层或两层以上时,最外层排满8个电子就能达到稳定结构(8电子结构)。知识点 用原子结构示意图表示原子结构知识点 相对原子质量 碳原子有多种,它们的质子数都是6,但中子数不同,有6、7、8等,这里所说的一种碳原子是指含有6个质子和6个中子的碳原子,简称碳12,其质量的 约为1.661×10-27 kg,近似等于1个质子或1个中子的实际质量。知识点 相对原子质量 在各粒子之间的等量关系中,等式“核内质子数=核电荷数=原子序数(原子序数是指元素在元素周期表中的序号,数值上等于原子核的核电荷数)”是恒成立的,当它们与核外电子数相等时,只有在原子中成立(即该等号不适用于离子,因为原子在变成相应的离子时,核外电子是有得失的);当它们与“相对原子质量-核内中子数”相等时,是根据相对原子质量的近似计算公式,通过变形而得来的。知识点 相对原子质量 贝采利乌斯是第一位把原子量测得比较精确的化学家。他在1814~1826年里连续发表了三张原子量表,所列元素多达50种。知识点 离子是怎样形成的 原子的核外电子数=质子数;阳离子的核外电子数<质子数;阴离子的核外电子数>质子数。 ①有一些物质如Ca(OH)2,CaCO3等,它们中的一些原子集团如OH-、CO3-2,常作为一个整体参与反应,这样的原子集团,叫作原子团,又叫作根。
②命名:原子团不能独立稳定地存在,它是物质“分子”组成的一部分。知识点 离子是怎样形成的原子团: 初中化学中的原子团除铵根(NH4+)在化学式前面外,其他原子团在化学式的后一部分,一般命名“××根”,
如下列物质,化学式后的括号中为该化合物中含有的原子团:NH4Cl(铵根)、Na2CO3(碳酸根)、K2SO4(硫酸根)、NaOH(氢氧根)、KNO3(硝酸根)、KMnO4(高锰酸根)、K2MnO4、(锰酸根)、KClO3(氯酸根)、NH4NO3(铵根,硝酸根)。知识点 离子是怎样形成的原子团:知识点 构成物质的微粒及相互关系第二章 空气、物质的构成2.4 辨别物质的元素组成知识点 什么是元素 例如,氧化汞(HgO)、水(H2O)、氧气(O2)、二氧化碳(CO2)的组成和性质不同,但它们都含有氧元素。上述物质的分子中都含有氧原子,这些氧原子的原子核内都含有8个质子,即核电荷数为8。物质是由元素组成的。知识点 什么是元素 同一种元素可以存在于不同的物质中,如氧气、二氧化碳都含有氧元素;同一种元素可以形成多种物质,如氧气、臭氧(O3)都是由氧元素组成的物质。知识点 元素周期表 俄国化学家门捷列夫最早发现并提出了元素周期表。每一周期开头的都是金属元素(第一周期除外),靠近尾部的是非金属元素,结尾是稀有气体元素,这种规律性的变化正是“周期性”的具体体现,它反映了元素之间的内在联系。知识点 元素周期表 2017年5月9日,经过公众提议、两岸协商、专家研讨和学界征询等程序,中国科学院、国家语言文字工作委员会、全国科学技术名词审定委员会在京联合发布了113号、115号、117号和118号4个新合成元素的中文名称,依次为“ ”(nǐ)、“镆”(mò)、
“ ”(tián)、“ ”(ào)。知识点 元素周期表 这4个新元素的英文名称和元素符号,已在2016年11月30日由负责管理元素符号的国际化学组织“国际纯粹与应用化学联合会”
(IUPAC)正式发布,加上之前的114号和116号元素,元素周期表中的第7周期被全部填满。知识点 单质和化合物有何不同 (1)混合物与纯净物的区分:由分子构成的物质,若分子不同,则属于混合物(如图①);若分子相同,则为纯净物(如图②)。从微观角度判断物质的分类方法:知识点 单质和化合物有何不同 由原子构成的物质,若原子种类不同,则为混合物(如图③);若原子种类相同,则为纯净物(如图④)。从微观角度判断物质的分类方法:知识点 单质和化合物有何不同 (2)单质和化合物的区分:对于由同种分子构成的物质,若分子由同种原子构成,则为单质(如图①);若分子由不同种原子构成,则属于化合物(如图②)。从微观角度判断物质的分类方法:谢 谢
(2)在原始的绿色植物出现以前,原始大气是以一氧化碳、二氧化碳、甲烷和氨为主的。在绿色植物出现以后,植物通过光合作用,产生氧气,使原始大气里的一氧化碳转化为二氧化碳,甲烷转化为水蒸气和二氧化碳,氨转化为水蒸气和氮气。知识点 空气有哪些成分原始大气和现代空气的成分是不一样的 (3)由于植物的光合作用持续进行,空气里的二氧化碳在植物发生光合作用的过程中被吸收了大部分,并使空气里的氧气越来越多,终于形成了以氮气和氧气为主的现代空气。由此可见,空气的成分始终以极慢的速率变化着。 稀有气体的化学性质很不活泼,可以防止食品被氧化,但稀有气体的含量太低,提取的成本很高,所以一般不用稀有气体作食品的保护气。现在大多用氮气。知识点 氮气和稀有气体有用吗稀有气体的性质不活泼,为什么生活中一般不用稀有气体作食品中的保鲜剂? 氦气可用来代替氮气作人造空气,供深海潜水员呼吸。因为在压强较大的深海里,用普通空气呼吸,氮气会随着海水中压强的增大,在血液里的溶解度跟着增大,因此会有较多的氮气溶解在血液里。氦气在血液里的溶解度比氮气小得多,用氦气跟氧气的混合气体代替普通空气,就不会发生上述现象。知识点 氮气和稀有气体有用吗知识点 探究我们的呼吸作用 二氧化碳能使澄清石灰水变浑浊,是因为生成了白色不溶于水的固体物质,这是检验二氧化碳的特征反应。有关二氧化碳的相关知识,将在第五章中学习。 这也是一种常见的排水法,方便快捷。尤其是收集一些对空气有污染的气体,非常适用。这套装置还有一个优点是通过排出水的体积的测量,可以得出收集气体的体积。知识点 探究我们的呼吸作用千奇百怪的排水法。 空气中的气体含量与呼出气体成分对比结果释疑:因为动物和人的呼吸作用,需要消耗氧气,释放二氧化碳。人体在吸入空气之后,氧气在体内发生化学反应,释放出二氧化碳和水蒸气。所以,空气中的氧气多于呼出气体中的氧气,空气中的二氧化碳和水蒸气少于呼出气体。知识点 探究我们的呼吸作用 PM2.5是指大气中粒径小于或等于2.5 μm的细颗粒物,PM2.5直径小,富含大量的有毒、有害物质且在大气中停留时间长,输送距离远,因而对人体健康和大气环境质量的影响很大。PM2.5主要来源于燃煤、焚烧秸秆、烧烤、机动车出行、餐饮油烟、建筑施工扬尘等。知识点 空气污染及防治第二章 空气、物质的构成2.2 构成物质的微粒(Ⅰ)——分子知识点 分子是什么 用两根玻璃棒分别在浓氨水和浓盐酸中蘸一下,然后将这两根玻璃棒靠近(不要接触),如图,可观察到空气中产生大量白烟。知识点 分子是什么分子不能保持物质的物理性质。 因为物质的物理性质如颜色、状态、熔点、沸点、密度、硬度等都是该物质大量分子聚集所表现的属性,是宏观现象,它不能由单个分子表现出来。例如单个分子就不能用固态、液态、气态来描述。而同种物质的每一个分子却都有相同的化学性质,所以分子不能保持物质的物理性质。知识点 分子有什么特性 如图所示,将一定体积的水和酒精混合,总体积变小,说明分子间存在间隔;溶液全部变红,说明分子是不断运动的。知识点 分子有什么特性 按图中装置使有色且密度比空气大的二氧化氮气体放在下瓶,当抽去玻璃片后,看到有色气体扩散到上瓶,下瓶颜色逐渐变浅,这一现象可以证明分子在不断运动。知识点 分子有什么特性 (1)酒精与水混合后,体积小于二者的体积之和,这是因为分子间有间隔。知识点 分子有什么特性 (2)糖水的体积小于糖块和水的体积之和。知识点 探究我们的呼吸作用 二氧化碳能使澄清石灰水变浑浊,是因为生成了白色不溶于水的固体物质,这是检验二氧化碳的特征反应。有关二氧化碳的相关知识,将在第五章中学习。第二章 空气、物质的构成2.3 构成物质的微粒(Ⅱ)——原子和离子知识点 原子是什么 原子是化学变化中的最小微粒,但不是最小的粒子,离开化学变化这一前提,原子还可以再分。 (1)从分子和原子的角度看物质的变化的实质。
(2)物理变化实质是分子本身不变,只是分子间的间隔发生改变。
(3)化学变化实质是分子分裂成原子,原子重新构成新分子或直接构成新物质的过程。知识点 原子是什么 卢瑟福用α粒子轰击金箔的实验,α粒子(带正电)在该实验中的运动轨迹如下:知识点 原子内部有何奥秘原子内部结构揭秘——散射实验。知识点 原子内部有何奥秘原子内部结构揭秘——散射实验。 对于上述三种实验现象,理解和解释如下:①极少部分α粒子被弹了回来,说明原子核质量大;②一小部分α粒子改变了原来的运动方向,说明原子核带正电荷;③大多数α粒子能穿透金箔而不改变原来的运动方向说明金原子中有一个相对很大的空间,原子不是实心球体,原子核体积小。 (1)1803年,道尔顿提出:构成物质的最小粒子是原子,原子是不可再分的实心球体。
(2)1897年,汤姆逊在原子内部发现了电子,人们终于抛弃了原子不可分割的陈旧观念。知识点 原子内部有何奥秘原子结构的探索历程: (3)1911年,卢瑟福通过精密的实验证明在原子中心有一个极小的核,电子绕核做高速旋转运动。知识点 原子内部有何奥秘原子结构的探索历程: 在原子中,电子层并不是真实存在的,只是科学家为了研究方便,进行的一种人为规定,是理想上的假设而已。知识点 用原子结构示意图表示原子结构 电子在原子核外排布时,要尽可能使电子的能量最低。比方说,我们站在地面上,不会觉得有什么危险;如果我们站在20层楼的楼顶,再往下看时我们心里感到害怕。这是因为物体在越高处具有的势能越大,物体总有从高处往低处的一种趋势,就像自由落体一样,我们从来没有见过物体会自动从地面上升到空中,物体要从地面到空中,必须要有外加力的作用。电子本身就是一种物质,也具有同样的性质。知识点 用原子结构示意图表示原子结构 相对稳定结构:当电子层只有一层时,排满2个电子就达到稳定结构(2电子结构);当电子层有两层或两层以上时,最外层排满8个电子就能达到稳定结构(8电子结构)。知识点 用原子结构示意图表示原子结构知识点 相对原子质量 碳原子有多种,它们的质子数都是6,但中子数不同,有6、7、8等,这里所说的一种碳原子是指含有6个质子和6个中子的碳原子,简称碳12,其质量的 约为1.661×10-27 kg,近似等于1个质子或1个中子的实际质量。知识点 相对原子质量 在各粒子之间的等量关系中,等式“核内质子数=核电荷数=原子序数(原子序数是指元素在元素周期表中的序号,数值上等于原子核的核电荷数)”是恒成立的,当它们与核外电子数相等时,只有在原子中成立(即该等号不适用于离子,因为原子在变成相应的离子时,核外电子是有得失的);当它们与“相对原子质量-核内中子数”相等时,是根据相对原子质量的近似计算公式,通过变形而得来的。知识点 相对原子质量 贝采利乌斯是第一位把原子量测得比较精确的化学家。他在1814~1826年里连续发表了三张原子量表,所列元素多达50种。知识点 离子是怎样形成的 原子的核外电子数=质子数;阳离子的核外电子数<质子数;阴离子的核外电子数>质子数。 ①有一些物质如Ca(OH)2,CaCO3等,它们中的一些原子集团如OH-、CO3-2,常作为一个整体参与反应,这样的原子集团,叫作原子团,又叫作根。
②命名:原子团不能独立稳定地存在,它是物质“分子”组成的一部分。知识点 离子是怎样形成的原子团: 初中化学中的原子团除铵根(NH4+)在化学式前面外,其他原子团在化学式的后一部分,一般命名“××根”,
如下列物质,化学式后的括号中为该化合物中含有的原子团:NH4Cl(铵根)、Na2CO3(碳酸根)、K2SO4(硫酸根)、NaOH(氢氧根)、KNO3(硝酸根)、KMnO4(高锰酸根)、K2MnO4、(锰酸根)、KClO3(氯酸根)、NH4NO3(铵根,硝酸根)。知识点 离子是怎样形成的原子团:知识点 构成物质的微粒及相互关系第二章 空气、物质的构成2.4 辨别物质的元素组成知识点 什么是元素 例如,氧化汞(HgO)、水(H2O)、氧气(O2)、二氧化碳(CO2)的组成和性质不同,但它们都含有氧元素。上述物质的分子中都含有氧原子,这些氧原子的原子核内都含有8个质子,即核电荷数为8。物质是由元素组成的。知识点 什么是元素 同一种元素可以存在于不同的物质中,如氧气、二氧化碳都含有氧元素;同一种元素可以形成多种物质,如氧气、臭氧(O3)都是由氧元素组成的物质。知识点 元素周期表 俄国化学家门捷列夫最早发现并提出了元素周期表。每一周期开头的都是金属元素(第一周期除外),靠近尾部的是非金属元素,结尾是稀有气体元素,这种规律性的变化正是“周期性”的具体体现,它反映了元素之间的内在联系。知识点 元素周期表 2017年5月9日,经过公众提议、两岸协商、专家研讨和学界征询等程序,中国科学院、国家语言文字工作委员会、全国科学技术名词审定委员会在京联合发布了113号、115号、117号和118号4个新合成元素的中文名称,依次为“ ”(nǐ)、“镆”(mò)、
“ ”(tián)、“ ”(ào)。知识点 元素周期表 这4个新元素的英文名称和元素符号,已在2016年11月30日由负责管理元素符号的国际化学组织“国际纯粹与应用化学联合会”
(IUPAC)正式发布,加上之前的114号和116号元素,元素周期表中的第7周期被全部填满。知识点 单质和化合物有何不同 (1)混合物与纯净物的区分:由分子构成的物质,若分子不同,则属于混合物(如图①);若分子相同,则为纯净物(如图②)。从微观角度判断物质的分类方法:知识点 单质和化合物有何不同 由原子构成的物质,若原子种类不同,则为混合物(如图③);若原子种类相同,则为纯净物(如图④)。从微观角度判断物质的分类方法:知识点 单质和化合物有何不同 (2)单质和化合物的区分:对于由同种分子构成的物质,若分子由同种原子构成,则为单质(如图①);若分子由不同种原子构成,则属于化合物(如图②)。从微观角度判断物质的分类方法:谢 谢
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
