粤教版九下化学 8.4常见的盐 课件(41张ppt)
文档属性
| 名称 | 粤教版九下化学 8.4常见的盐 课件(41张ppt) |
|
|
| 格式 | zip | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-05 00:00:00 | ||
图片预览








文档简介
课件41张PPT。课题4常见的盐第八章酸、碱、 盐 学习目标:1.知道什么是盐,了解氯化钠、碳酸钠、碳酸氢钠和碳酸钙的组成及其在生活生产中的主要用途
2.掌握碳酸钠、碳酸氢钠和碳酸钙的一些化学性质
3.掌握碳酸根离子的检验方法 盐是什么?食盐=? [问题一] 生活中的盐常指的是哪种物质? 食盐(NaCl)。 [问题二] 食盐是盐,盐就是食盐。 你认为是否正确?请说出理由。 食盐是盐,是正确的。因为食盐是由Na+ 和Cl- 构成的化合物;盐就是食盐,这种说法是错误的。因为盐是由金属离子和酸根离子构成的一类化合物。 例如:Na2CO3、KCl等都是盐。 盐是什么?食盐=?盐是由金属阳离子(或铵根离子NH4+)和酸根离子构成的一类化合物一、氯化钠 1、 NaCl 俗名:食盐由 Na+ 和 Cl- 构成1、重要的调味品
2、人体正常生理不可缺少的物质,医疗上用于配制生理盐水
3、日常生活中用来腌制食品
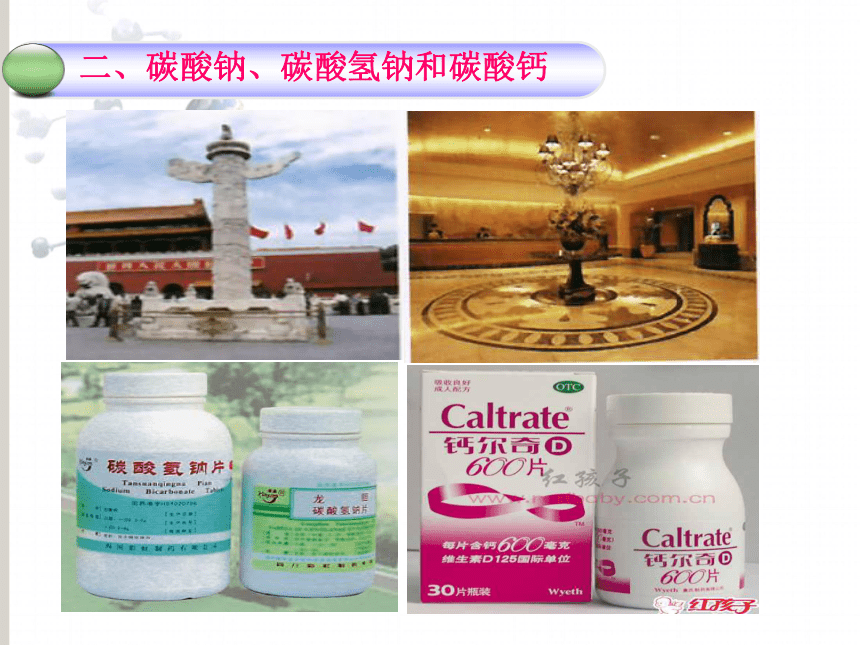
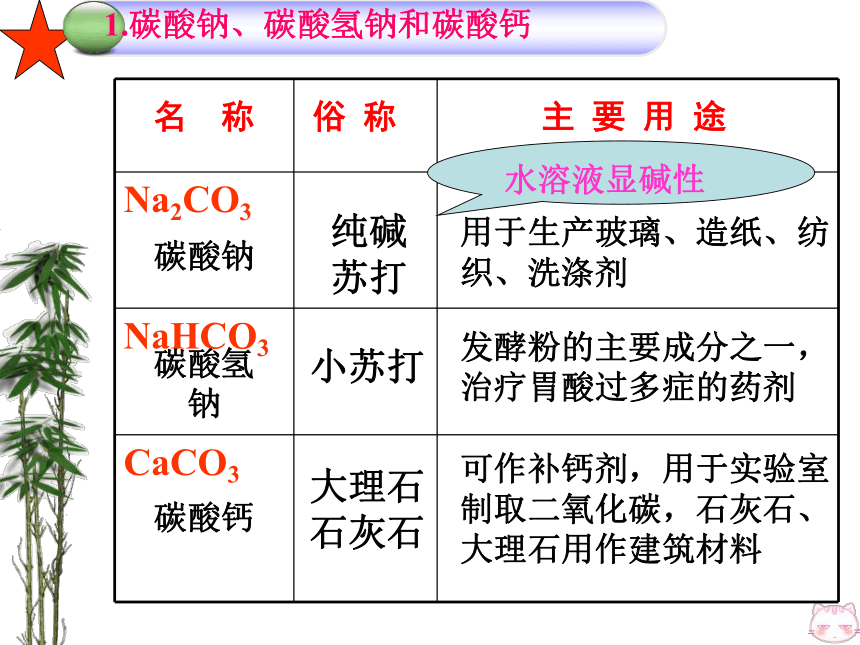
4、工业的原料:氯—碱工业 2、氯化钠的重要用途:二、碳酸钠、碳酸氢钠和碳酸钙纯碱
苏打小苏打大理石
石灰石用于生产玻璃、造纸、纺织、洗涤剂发酵粉的主要成分之一,
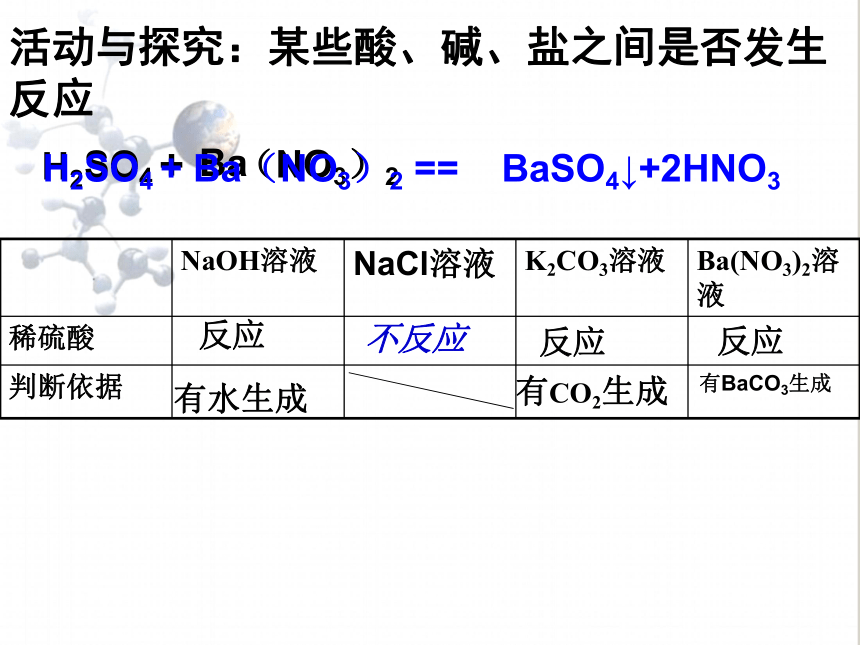
治疗胃酸过多症的药剂可作补钙剂,用于实验室制取二氧化碳,石灰石、大理石用作建筑材料1.碳酸钠、碳酸氢钠和碳酸钙 SO4+BaH2(NO3)2H2SO4 + Ba(NO3)2 == BaSO4↓+2HNO3活动与探究:某些酸、碱、盐之间是否发生反应不反应反应反应反应有水生成有CO2生成有BaCO3生成①金属+盐→新盐+新金属位于前面位于后面盐溶液无可溶性不要用K、Ca、Na置换盐溶液中的金属在金属活动性顺序表中,只有_________ 的金属才能把________的金属从它的___ 中置换出来,与氢的位置 __关;盐必须
是______盐。Zn + CuSO4 = ZnSO4 + Cu
四、盐的化学性质②盐+酸→新盐+新酸条件:生成物中有沉淀或气体或水③盐+碱→新盐+新碱条件:反应物两者均可溶;
生成物有沉淀或气体或水AgNO3 + HCl = AgCl↓+ HNO3
BaCl2 + H2SO4 = BaSO4 ↓ + 2HClNa2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaClAgNO3 + NaCl = AgCl↓ + NaNO3
BaCl2 + Na2SO4 = BaSO4 ↓ + 2NaCl④盐+盐→新盐+新盐条件:反应物两者均可溶;
生成物有沉淀探究:请归纳盐的化学性质(可溶)(可溶)(可溶)(可溶)(可溶)(至少有一种沉淀)(至少有一种沉淀)1.盐 + 金属 = 新盐 + 新金属 2.盐 + 酸 = 新盐 + 新酸 3.盐 + 碱 = 新盐 + 新碱4.盐 + 盐 = 新盐 + 新盐复分解反应发生的条件:当两种化合物在溶液中相互交换成分,生成物中有沉淀或有气体或有水生成,复分解反应才可以发生当反应中有难溶物质生成,溶液中就会出现沉淀(即通常所说“变浑浊”)。P109说出酸、碱、盐的溶解性规律(20℃)物质溶解性口诀:碱溶五位铵钾钠钙钡;
铵钾钠盐硝酸盐遇水变没;
盐酸不溶银;
硫酸不溶钡;
碳酸溶四位铵钾钠镁。另外:AgCl、BaSO4既不溶于水,也不溶于酸
判断下列反应能否发生,能反应的完成化学方程式 :
① Zn + FeSO4 ——
② Cu + AgCl ——
③ NaCl + CuSO4 ——
④ Na2CO3 + Ca(OH)2 ——
⑤ BaCl2 + Na2CO3 ——
⑥ CuCl2 + H2SO4 ——
⑦ CaCO3 + BaCl2 ——
⑧ BaSO4 + HCl ——
⑨ Na2CO3 + Cu(OH)2 ——五、几种常见离子的检验1.碳酸根离子的检验①滴加稀盐酸,现象:有气泡产生②通入澄清石灰水,现象:生成白色浑浊2.硫酸根离子的检验①滴加硝酸钡,现象:生成白色沉淀②滴加稀硝酸,现象:沉淀不溶解4.铵根离子的检验滴加氢氧化钠溶液,现象:有气泡产生或:用红色石蕊试纸检验,现象:试纸变蓝3.氯离子的检验①滴加硝酸银,现象:生成白色沉淀②滴加稀硝酸,现象:沉淀不溶解或用沾有无色酚酞的棉花检验拓展课题:物质的分类 说到纯碱,我们一定要记得一位我国化学史上的科学家——侯德榜,希望大家课后去查查关于他的资料,碳酸钠为何叫纯碱呢?侯德榜(1890~1974)侯德榜,中国化学家,“侯氏制碱法”的创始人。侯德榜一生在化工技术上有三大贡献。第一,揭开了苏尔维法的秘密。第二,创立了中国人自己的制碱工艺——侯氏制碱法。第三,他为发展小化肥工业所做的贡献。1921年,他在哥伦比亚大学获博士学位后,怀着工业救国的远大抱负,毅然放弃自己热爱的制革专业,回到祖国。(候氏制碱法)反应分三步进行
(1)NH3+H2O+CO2=NH4HCO3
(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓
(3)2NaHCO3==Na2CO3+H2O+CO2↑△石灰石和石灰岩地区的溶洞溶洞的形成
石灰岩的主要成分是碳酸钙。碳酸钙遇到溶有二氧化碳的水时,会慢慢变成可溶于水的碳酸氢钙Ca(HCO3)2
CaCO3+H2O+CO2=Ca(HCO3)2
当受热或压强突然变小时,水中碳酸氢钙会分解,重新变成碳酸钙沉积下来。
Ca(HCO3)2=CaCO3↓+CO2↑+H2O
在自然界里不断发生上述反应,石灰岩逐渐变成碳酸氢钙而溶解掉,形成溶洞;碳酸氢钙不断分解,生成的碳酸钙逐渐沉积,形成千姿百态的钟乳石、石笋和石柱。 CaCO3+H2O+CO2==Ca(HCO3)2
Ca(HCO3)==2CaCO3↓+H2O+CO2↑浮沉中的鸡蛋将一个新鲜的鸡蛋放在盛有水和足量稀盐酸的烧杯中,观察现象,并解释其中的原因? 因为CaCO3和稀HCl反应生成CO2气体,气泡附着在蛋壳上,使鸡蛋所受的浮力变大,当浮力大于鸡蛋的重力时,鸡蛋上浮;当鸡蛋浮到水面时,气泡破裂,鸡蛋所受浮力变小,浮力小于鸡蛋重力,所以鸡蛋下沉。?
练一练(1)NaCl+Ba(OH)2
(2)K2CO3+CaCl2
(3)Cu+HCl
(4)Na2SO4+BaCl2
(5)BaSO4+Na2CO3
(6)Ba(OH)2+CuCl2
(7)Zn+CuSO4
(8)HCl+BaCO3
(9)H2SO4+Cu(OH)2
(10)AgNO3+KCl ×K2CO3+CaCl2=CaCO3↓+2KCl×Na2SO4+BaCl2=BaSO4↓+2NaCl×Ba(OH)2+CuCl2=Cu(OH)2↓+BaCl2Zn+CuSO4=Cu+ZnSO42HCl+BaCO3=BaCl2+H2O+CO2↑H2SO4+Cu(OH)2=CuSO4+2H2OAgNO3+KCl=AgCl↓+KNO3(11)H2SO4+Ba(NO3)2
(12)KOH+MgCl2
(13)NaNO3+Ca(OH)2
(14)HCl+AgNO3
(15)Fe+CuCO3
(16)Na2CO3+BaCl2
(17)Ag+H2SO4
(18)Na2CO3+KOH
(19)H2SO4+Na2CO3
(20)K2SO4+CuCl2H2SO4+Ba(NO3)2=BaSO4↓+2HNO32KOH+MgCl2=Mg(OH)2↓+2KCl×HCl+AgNO3=AgCl↓+HNO3×Na2CO3+BaCl2=BaCO3↓+2NaCl××H2SO4+Na2CO3=Na2SO4+H2O+CO2↑×1、下列各组离子能共存的是( )
A、 Ba2+、K+、NO3-、CO32-、H+
B、K+、Cl-、Mg2+、NO3-、H+
C、Fe3+、SO42-、OH-、Na+、Cu2+
D、Ag+、Ba2+、Cl-、NO3-、K+
2、不用其它试剂,用最简捷的方法鉴别:①氢氧化钠②硫酸镁③硝酸钡④氯化铁⑤氯化钾五种溶液,则被鉴别出来的物质的正确的顺序是( )
A、①②③④⑤ B、④①②③⑤
C、④③①②⑤ D、②③①④⑤BB学完本课题你应该知道:了解氯化钠、碳酸钠、碳酸氢钠和碳酸钙。
能识别复分解反应类型,了解复分解反应发生的条件。
掌握盐的化学性质以及CO32-或 HCO3- 离子的检验方法。
可以通过过滤、蒸发等方法分离混合物,如粗盐提纯。【课堂练习】【练习1】判断下列物质是否溶于水:Na2CO3 AgCl BaCO3 MgSO4 BaSO4 Cu(OH)2 (NH4)2SO4 Ba(OH)2 Mg(OH)2
AgNO3 Na3PO4 Fe(OH)3 白色↓白色↓白色↓蓝色↓白色↓红褐色↓×√√√×√【练习3】有Ba(OH)2溶液、BaCl2溶液、Na2CO3溶液、H2SO4溶液四种物质,两物质间能发生的化学反应共有( )
A. 3个 B. 4个 C. 5个 D. 6个C【课堂练习】【练习3】有Ba(OH)2溶液、BaCl2溶液、Na2CO3溶液、H2SO4溶液四种物质,两物质间能发生的化学反应共有( )
A. 3个 B. 4个 C. 5个 D. 6个C【课堂练习】1、盐是指含有____离子和____离子的化合物
2.食盐的主要成分是____,若误服工业用盐如________(化学式______)就会中毒
3. 碳酸钠的化学式________俗称是___________。碳酸氢钠的化学式是________俗称是_______金属 酸根NaCl亚硝酸钠NaNO2Na2CO3NaHCO3纯碱、苏打小苏打写化学式4、生理盐水的溶质是_____氯化钠我会做仪器:
烧杯、漏斗、蒸发皿、玻璃棒、 酒精灯、铁架台(带铁圈)(托盘天平、量筒、胶头滴管)4、粗盐的提纯粗盐提纯的步骤:称量(左物右码)
溶解
过滤 :过滤的要点(一贴、二低、三靠)
蒸发:(是否需要把水全部蒸干再熄灭酒精灯?)
称量
计算产率【思考1】什么是蒸发?蒸发操作应该注意什么?蒸发一般是用加热的方法,使溶剂不断挥发的过程。蒸发操作应注意以下几个方面:1.蒸发皿应放在铁圈上,停止加热时,不要立即把蒸发皿直接放在实验台上,以免烫坏实验台。2.加热过程中,用玻璃棒不断搅动,防止由于局部温度过高,造成液滴飞溅。3.当蒸发皿中出现较多量固体时,停止加热,利用余热使滤液蒸干。
玻璃棒:
搅拌,加速溶解玻璃棒:
引流,防止液体飞溅玻璃棒:
搅拌,防止局部过热液滴飞溅【思考2】粗盐提纯中:溶解、过滤、蒸发操作都用到了玻璃棒,玻璃棒分别起了什么作用?2. 实验过程中可能出现的误差(产率低的原因):
(1)溶解时加入的粗盐过多,未完全溶解,使精盐产率降低。 (2)溶解搅拌时液滴溅出,产率降低。 (3)过滤时,液体洒出或未洗涤玻璃棒、烧杯而使NaCl损失,从而产率降低。 (4)蒸发时没有及时搅拌或停止加热太晚造成液滴飞溅,从而使产率降低。 1.过滤后滤液仍浑浊的原因:
(1)过滤时滤纸破损。
(2)倾倒液体时,液面超过滤纸边缘。
(3)承接液体的烧杯不干净。[讨论] 图为某学生进行粗盐提纯实验中过滤操作的示意图,试回答: (1)写出标号的仪器名称:①????????????????,②??????????????。
???(2)漏斗中液体的液面应该(填“高”或“低”)???????? 于滤纸的边缘。
??? (3)蒸发滤液时,用玻璃棒不断搅拌滤液的目的是?????????????;等到蒸发皿中出现???????????????????时,停止加热,利用蒸发皿的余热使滤液蒸干,移去蒸发皿时应使用的仪器是??????????????????。CO32-、HCO3-的检验CaCO3 + 2HCl == CaCl2 + H2O + CO2↑Na2CO3 + 2HCl==2NaCl + H2O + CO2↑NaHCO3 + HCl == NaCl + H2O + CO2↑某物质产生气体变浑浊CO2CaCO3碳酸盐方法:取少量未知物,加入少量稀盐酸,看能否生成使澄清石灰水变浑浊的气体。组成里含有碳酸根离子和碳酸氢根离子的盐都能与盐酸反应,生成二氧化碳气体。1.下列属于盐类的一组物质是(? )
A.硫酸镁、碳酸氢钠、高锰酸钾???
B.食盐、硫酸铜、碳酸
C.纯碱、氧化钠、熟石灰?????????
D.氧化锌、生石灰、食醋
2.下面是一些常见盐的俗称或主要成分,其中错误的是(? ?)
A.碳酸氢钠 苏打? B.大理石 碳酸钙?
C.食盐 氯化钠? D.碳酸钠 纯碱
3.盐是一类物质,有的能食用,有的不能食用。误作食盐食用会引起中毒死亡的是(? )
A.NaHCO3?????? B.Na2CO3???
C.KCl??? D.NaNO2我会做:AAD
2.掌握碳酸钠、碳酸氢钠和碳酸钙的一些化学性质
3.掌握碳酸根离子的检验方法 盐是什么?食盐=? [问题一] 生活中的盐常指的是哪种物质? 食盐(NaCl)。 [问题二] 食盐是盐,盐就是食盐。 你认为是否正确?请说出理由。 食盐是盐,是正确的。因为食盐是由Na+ 和Cl- 构成的化合物;盐就是食盐,这种说法是错误的。因为盐是由金属离子和酸根离子构成的一类化合物。 例如:Na2CO3、KCl等都是盐。 盐是什么?食盐=?盐是由金属阳离子(或铵根离子NH4+)和酸根离子构成的一类化合物一、氯化钠 1、 NaCl 俗名:食盐由 Na+ 和 Cl- 构成1、重要的调味品
2、人体正常生理不可缺少的物质,医疗上用于配制生理盐水
3、日常生活中用来腌制食品
4、工业的原料:氯—碱工业 2、氯化钠的重要用途:二、碳酸钠、碳酸氢钠和碳酸钙纯碱
苏打小苏打大理石
石灰石用于生产玻璃、造纸、纺织、洗涤剂发酵粉的主要成分之一,
治疗胃酸过多症的药剂可作补钙剂,用于实验室制取二氧化碳,石灰石、大理石用作建筑材料1.碳酸钠、碳酸氢钠和碳酸钙 SO4+BaH2(NO3)2H2SO4 + Ba(NO3)2 == BaSO4↓+2HNO3活动与探究:某些酸、碱、盐之间是否发生反应不反应反应反应反应有水生成有CO2生成有BaCO3生成①金属+盐→新盐+新金属位于前面位于后面盐溶液无可溶性不要用K、Ca、Na置换盐溶液中的金属在金属活动性顺序表中,只有_________ 的金属才能把________的金属从它的___ 中置换出来,与氢的位置 __关;盐必须
是______盐。Zn + CuSO4 = ZnSO4 + Cu
四、盐的化学性质②盐+酸→新盐+新酸条件:生成物中有沉淀或气体或水③盐+碱→新盐+新碱条件:反应物两者均可溶;
生成物有沉淀或气体或水AgNO3 + HCl = AgCl↓+ HNO3
BaCl2 + H2SO4 = BaSO4 ↓ + 2HClNa2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaClAgNO3 + NaCl = AgCl↓ + NaNO3
BaCl2 + Na2SO4 = BaSO4 ↓ + 2NaCl④盐+盐→新盐+新盐条件:反应物两者均可溶;
生成物有沉淀探究:请归纳盐的化学性质(可溶)(可溶)(可溶)(可溶)(可溶)(至少有一种沉淀)(至少有一种沉淀)1.盐 + 金属 = 新盐 + 新金属 2.盐 + 酸 = 新盐 + 新酸 3.盐 + 碱 = 新盐 + 新碱4.盐 + 盐 = 新盐 + 新盐复分解反应发生的条件:当两种化合物在溶液中相互交换成分,生成物中有沉淀或有气体或有水生成,复分解反应才可以发生当反应中有难溶物质生成,溶液中就会出现沉淀(即通常所说“变浑浊”)。P109说出酸、碱、盐的溶解性规律(20℃)物质溶解性口诀:碱溶五位铵钾钠钙钡;
铵钾钠盐硝酸盐遇水变没;
盐酸不溶银;
硫酸不溶钡;
碳酸溶四位铵钾钠镁。另外:AgCl、BaSO4既不溶于水,也不溶于酸
判断下列反应能否发生,能反应的完成化学方程式 :
① Zn + FeSO4 ——
② Cu + AgCl ——
③ NaCl + CuSO4 ——
④ Na2CO3 + Ca(OH)2 ——
⑤ BaCl2 + Na2CO3 ——
⑥ CuCl2 + H2SO4 ——
⑦ CaCO3 + BaCl2 ——
⑧ BaSO4 + HCl ——
⑨ Na2CO3 + Cu(OH)2 ——五、几种常见离子的检验1.碳酸根离子的检验①滴加稀盐酸,现象:有气泡产生②通入澄清石灰水,现象:生成白色浑浊2.硫酸根离子的检验①滴加硝酸钡,现象:生成白色沉淀②滴加稀硝酸,现象:沉淀不溶解4.铵根离子的检验滴加氢氧化钠溶液,现象:有气泡产生或:用红色石蕊试纸检验,现象:试纸变蓝3.氯离子的检验①滴加硝酸银,现象:生成白色沉淀②滴加稀硝酸,现象:沉淀不溶解或用沾有无色酚酞的棉花检验拓展课题:物质的分类 说到纯碱,我们一定要记得一位我国化学史上的科学家——侯德榜,希望大家课后去查查关于他的资料,碳酸钠为何叫纯碱呢?侯德榜(1890~1974)侯德榜,中国化学家,“侯氏制碱法”的创始人。侯德榜一生在化工技术上有三大贡献。第一,揭开了苏尔维法的秘密。第二,创立了中国人自己的制碱工艺——侯氏制碱法。第三,他为发展小化肥工业所做的贡献。1921年,他在哥伦比亚大学获博士学位后,怀着工业救国的远大抱负,毅然放弃自己热爱的制革专业,回到祖国。(候氏制碱法)反应分三步进行
(1)NH3+H2O+CO2=NH4HCO3
(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓
(3)2NaHCO3==Na2CO3+H2O+CO2↑△石灰石和石灰岩地区的溶洞溶洞的形成
石灰岩的主要成分是碳酸钙。碳酸钙遇到溶有二氧化碳的水时,会慢慢变成可溶于水的碳酸氢钙Ca(HCO3)2
CaCO3+H2O+CO2=Ca(HCO3)2
当受热或压强突然变小时,水中碳酸氢钙会分解,重新变成碳酸钙沉积下来。
Ca(HCO3)2=CaCO3↓+CO2↑+H2O
在自然界里不断发生上述反应,石灰岩逐渐变成碳酸氢钙而溶解掉,形成溶洞;碳酸氢钙不断分解,生成的碳酸钙逐渐沉积,形成千姿百态的钟乳石、石笋和石柱。 CaCO3+H2O+CO2==Ca(HCO3)2
Ca(HCO3)==2CaCO3↓+H2O+CO2↑浮沉中的鸡蛋将一个新鲜的鸡蛋放在盛有水和足量稀盐酸的烧杯中,观察现象,并解释其中的原因? 因为CaCO3和稀HCl反应生成CO2气体,气泡附着在蛋壳上,使鸡蛋所受的浮力变大,当浮力大于鸡蛋的重力时,鸡蛋上浮;当鸡蛋浮到水面时,气泡破裂,鸡蛋所受浮力变小,浮力小于鸡蛋重力,所以鸡蛋下沉。?
练一练(1)NaCl+Ba(OH)2
(2)K2CO3+CaCl2
(3)Cu+HCl
(4)Na2SO4+BaCl2
(5)BaSO4+Na2CO3
(6)Ba(OH)2+CuCl2
(7)Zn+CuSO4
(8)HCl+BaCO3
(9)H2SO4+Cu(OH)2
(10)AgNO3+KCl ×K2CO3+CaCl2=CaCO3↓+2KCl×Na2SO4+BaCl2=BaSO4↓+2NaCl×Ba(OH)2+CuCl2=Cu(OH)2↓+BaCl2Zn+CuSO4=Cu+ZnSO42HCl+BaCO3=BaCl2+H2O+CO2↑H2SO4+Cu(OH)2=CuSO4+2H2OAgNO3+KCl=AgCl↓+KNO3(11)H2SO4+Ba(NO3)2
(12)KOH+MgCl2
(13)NaNO3+Ca(OH)2
(14)HCl+AgNO3
(15)Fe+CuCO3
(16)Na2CO3+BaCl2
(17)Ag+H2SO4
(18)Na2CO3+KOH
(19)H2SO4+Na2CO3
(20)K2SO4+CuCl2H2SO4+Ba(NO3)2=BaSO4↓+2HNO32KOH+MgCl2=Mg(OH)2↓+2KCl×HCl+AgNO3=AgCl↓+HNO3×Na2CO3+BaCl2=BaCO3↓+2NaCl××H2SO4+Na2CO3=Na2SO4+H2O+CO2↑×1、下列各组离子能共存的是( )
A、 Ba2+、K+、NO3-、CO32-、H+
B、K+、Cl-、Mg2+、NO3-、H+
C、Fe3+、SO42-、OH-、Na+、Cu2+
D、Ag+、Ba2+、Cl-、NO3-、K+
2、不用其它试剂,用最简捷的方法鉴别:①氢氧化钠②硫酸镁③硝酸钡④氯化铁⑤氯化钾五种溶液,则被鉴别出来的物质的正确的顺序是( )
A、①②③④⑤ B、④①②③⑤
C、④③①②⑤ D、②③①④⑤BB学完本课题你应该知道:了解氯化钠、碳酸钠、碳酸氢钠和碳酸钙。
能识别复分解反应类型,了解复分解反应发生的条件。
掌握盐的化学性质以及CO32-或 HCO3- 离子的检验方法。
可以通过过滤、蒸发等方法分离混合物,如粗盐提纯。【课堂练习】【练习1】判断下列物质是否溶于水:Na2CO3 AgCl BaCO3 MgSO4 BaSO4 Cu(OH)2 (NH4)2SO4 Ba(OH)2 Mg(OH)2
AgNO3 Na3PO4 Fe(OH)3 白色↓白色↓白色↓蓝色↓白色↓红褐色↓×√√√×√【练习3】有Ba(OH)2溶液、BaCl2溶液、Na2CO3溶液、H2SO4溶液四种物质,两物质间能发生的化学反应共有( )
A. 3个 B. 4个 C. 5个 D. 6个C【课堂练习】【练习3】有Ba(OH)2溶液、BaCl2溶液、Na2CO3溶液、H2SO4溶液四种物质,两物质间能发生的化学反应共有( )
A. 3个 B. 4个 C. 5个 D. 6个C【课堂练习】1、盐是指含有____离子和____离子的化合物
2.食盐的主要成分是____,若误服工业用盐如________(化学式______)就会中毒
3. 碳酸钠的化学式________俗称是___________。碳酸氢钠的化学式是________俗称是_______金属 酸根NaCl亚硝酸钠NaNO2Na2CO3NaHCO3纯碱、苏打小苏打写化学式4、生理盐水的溶质是_____氯化钠我会做仪器:
烧杯、漏斗、蒸发皿、玻璃棒、 酒精灯、铁架台(带铁圈)(托盘天平、量筒、胶头滴管)4、粗盐的提纯粗盐提纯的步骤:称量(左物右码)
溶解
过滤 :过滤的要点(一贴、二低、三靠)
蒸发:(是否需要把水全部蒸干再熄灭酒精灯?)
称量
计算产率【思考1】什么是蒸发?蒸发操作应该注意什么?蒸发一般是用加热的方法,使溶剂不断挥发的过程。蒸发操作应注意以下几个方面:1.蒸发皿应放在铁圈上,停止加热时,不要立即把蒸发皿直接放在实验台上,以免烫坏实验台。2.加热过程中,用玻璃棒不断搅动,防止由于局部温度过高,造成液滴飞溅。3.当蒸发皿中出现较多量固体时,停止加热,利用余热使滤液蒸干。
玻璃棒:
搅拌,加速溶解玻璃棒:
引流,防止液体飞溅玻璃棒:
搅拌,防止局部过热液滴飞溅【思考2】粗盐提纯中:溶解、过滤、蒸发操作都用到了玻璃棒,玻璃棒分别起了什么作用?2. 实验过程中可能出现的误差(产率低的原因):
(1)溶解时加入的粗盐过多,未完全溶解,使精盐产率降低。 (2)溶解搅拌时液滴溅出,产率降低。 (3)过滤时,液体洒出或未洗涤玻璃棒、烧杯而使NaCl损失,从而产率降低。 (4)蒸发时没有及时搅拌或停止加热太晚造成液滴飞溅,从而使产率降低。 1.过滤后滤液仍浑浊的原因:
(1)过滤时滤纸破损。
(2)倾倒液体时,液面超过滤纸边缘。
(3)承接液体的烧杯不干净。[讨论] 图为某学生进行粗盐提纯实验中过滤操作的示意图,试回答: (1)写出标号的仪器名称:①????????????????,②??????????????。
???(2)漏斗中液体的液面应该(填“高”或“低”)???????? 于滤纸的边缘。
??? (3)蒸发滤液时,用玻璃棒不断搅拌滤液的目的是?????????????;等到蒸发皿中出现???????????????????时,停止加热,利用蒸发皿的余热使滤液蒸干,移去蒸发皿时应使用的仪器是??????????????????。CO32-、HCO3-的检验CaCO3 + 2HCl == CaCl2 + H2O + CO2↑Na2CO3 + 2HCl==2NaCl + H2O + CO2↑NaHCO3 + HCl == NaCl + H2O + CO2↑某物质产生气体变浑浊CO2CaCO3碳酸盐方法:取少量未知物,加入少量稀盐酸,看能否生成使澄清石灰水变浑浊的气体。组成里含有碳酸根离子和碳酸氢根离子的盐都能与盐酸反应,生成二氧化碳气体。1.下列属于盐类的一组物质是(? )
A.硫酸镁、碳酸氢钠、高锰酸钾???
B.食盐、硫酸铜、碳酸
C.纯碱、氧化钠、熟石灰?????????
D.氧化锌、生石灰、食醋
2.下面是一些常见盐的俗称或主要成分,其中错误的是(? ?)
A.碳酸氢钠 苏打? B.大理石 碳酸钙?
C.食盐 氯化钠? D.碳酸钠 纯碱
3.盐是一类物质,有的能食用,有的不能食用。误作食盐食用会引起中毒死亡的是(? )
A.NaHCO3?????? B.Na2CO3???
C.KCl??? D.NaNO2我会做:AAD
