科学中考专题复习——物质的相互转化(课件 34张ppt)
文档属性
| 名称 | 科学中考专题复习——物质的相互转化(课件 34张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-06-05 06:45:05 | ||
图片预览







文档简介
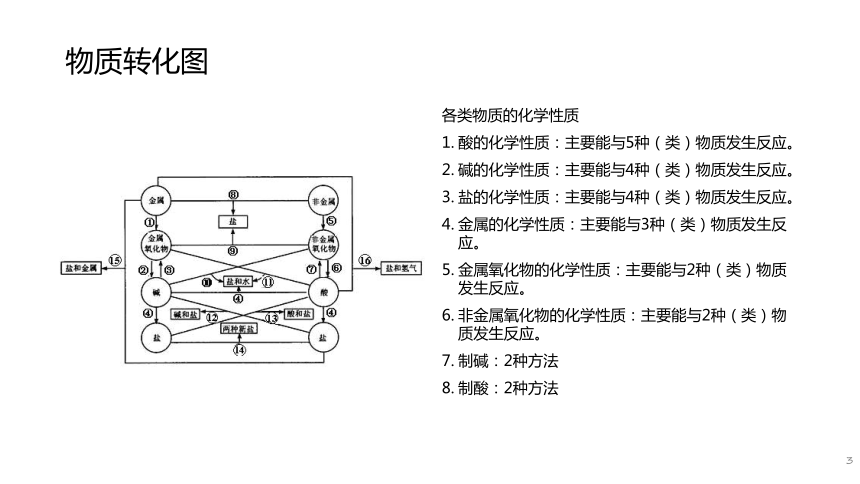
课件34张PPT。10621.物质转化2.拓展提高物质转化图各类物质的化学性质
酸的化学性质:主要能与5种(类)物质发生反应。
碱的化学性质:主要能与4种(类)物质发生反应。
盐的化学性质:主要能与4种(类)物质发生反应。
金属的化学性质:主要能与3种(类)物质发生反应。
金属氧化物的化学性质:主要能与2种(类)物质发生反应。
非金属氧化物的化学性质:主要能与2种(类)物质发生反应。
制碱:2种方法
制酸:2种方法
3基础训练【例1】下列转化能一步完成的是( )
A.Cu→Ag B.HNO3→HCl
C.Ba(OH)2→NaOH D.CuO→Cu(OH)2
【练1】稀硫酸和下列物质能发生中和反应,又能生成白色沉淀的是( )
A.Mg(OH)2 B.BaCl2 C.K2CO3 D.Ba(OH)2
【例2】下列各组物质在溶液中能够共存的是( )
A.氯化钡和硝酸银 B.硫酸和硝酸钡
C.盐酸和氯化钡 D.铁和稀盐酸
【练2】分别将下列各组物质同时加到水中,不能大量共存的是( )
A.NaCl、AgNO3、Na2SO4 B.H2SO4、NaCl、Na2CO3
C.Na2SO4、KNO3、NaOH D.BaCl2、NaCl、KOH解析【例1】下列转化能一步完成的是( )
A.Cu→Ag B.HNO3→HCl
C.Ba(OH)2→NaOH D.CuO→Cu(OH)2
【练1】稀硫酸和下列物质能发生中和反应,又能生成白色沉淀的是( )
A.Mg(OH)2 B.BaCl2 C.K2CO3 D.Ba(OH)2
【例2】下列各组物质在溶液中能够共存的是( )
A.氯化钡和硝酸银 B.硫酸和硝酸钡
C.盐酸和氯化钡 D.铁和稀盐酸
【练2】分别将下列各组物质同时加到水中,不能大量共存的是( )
A.NaCl、AgNO3、Na2SO4 B.H2SO4、NaCl、Na2CO3
C.Na2SO4、KNO3、NaOH D.BaCl2、NaCl、KOH
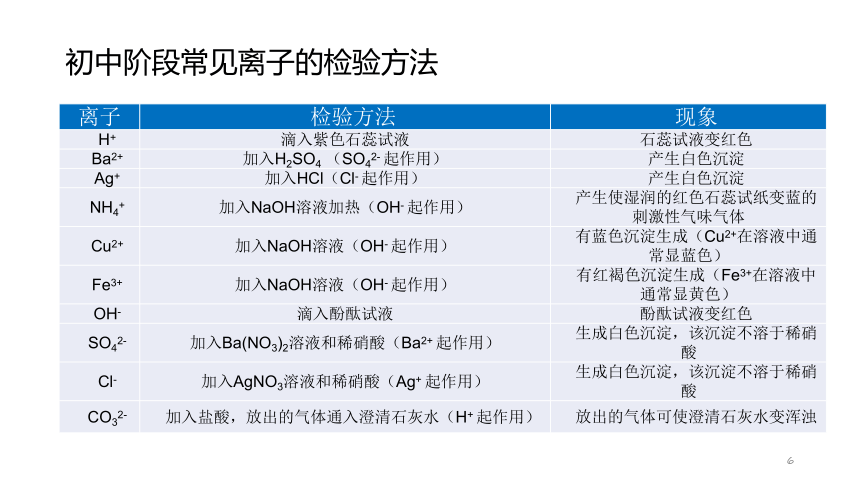
6初中阶段常见离子的检验方法基础训练【例3】欲除去硝酸钠溶液中少量的碳酸钠,又不混入其他物质,可加入适量的试剂是( )
A.氢氧化钙溶液 B.稀硫酸
C.硝酸钙溶液 D.氯化钙溶液
【练3】下列各组物质的溶液,在常温下两两混合都能发生反应的一组是( )
A.AgNO3、HCl、Cu(NO3)2 B.Ca(OH)2、Na2CO3、HCl
C.BaCl2、AgNO3、Na2SO4 D.NaOH、MgCl2、H2SO4
除杂题三原则;三要领;五方法。
三原则:
①不引入新杂质;
②不减少被提纯物质的质量;
③杂质便于分离。
三要领:
①根据物理性质或化学性质的差异;
②确定除杂质方法;
③选择适宜试剂。
五方法:
①沉淀法:加入一种试剂将被除去的杂质变为沉淀,再用过滤法除去。
②化气法:加热或加入一种试剂将杂质变为气体逸出。
③置换法:利用置换反应的原理将杂质除去。
④转纯法:将被除去的杂质变为提纯的物质。
⑤吸收法:常用于气体的提纯。基础训练【例4】向AgNO3、Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应后过滤,向滤液中滴加稀盐酸有白色沉淀产生。下列说法中,正确的是( )
A.所得滤液中可能含有Cu2+ B.所得滤渣中可能含有铜和锌
C.所得滤液中一定含有Ag+、Zn2+、Cu2 + D.所得滤渣中一定含有银和铜
【练4】实验室有失去标签的盐酸、碳酸钠、硫酸、氢氧化钾和硝酸钾五瓶溶液。为把它们区分开来,所加试剂及先后顺序合理的一组是( )
A.氯化钡溶液、稀硝酸、石蕊试液 B.稀硝酸、石蕊试液、硝酸银溶液
C.石蕊试液、稀硝酸、硝酸银溶液 D.稀硝酸、酚酞试液、硝酸银溶液
解析【例3】欲除去硝酸钠溶液中少量的碳酸钠,又不混入其他物质,可加入适量的试剂是( )
A.氢氧化钙溶液 B.稀硫酸 C.硝酸钙溶液 D.氯化钙溶液
【练3】下列各组物质的溶液,在常温下两两混合都能发生反应的一组是( )
A.AgNO3、HCl、Cu(NO3)2 B.Ca(OH)2、Na2CO3、HCl
C.BaCl2、AgNO3、Na2SO4 D.NaOH、MgCl2、H2SO4
【例4】向AgNO3、Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应后过滤,向滤液中滴加稀盐酸有白色沉淀产生。下列说法中,正确的是( )
A.所得滤液中可能含有Cu2+ B.所得滤渣中可能含有铜和锌
C.所得滤液中一定含有Ag+、Zn2+、Cu2 + D.所得滤渣中一定含有银和铜
【练4】实验室有失去标签的盐酸、碳酸钠、硫酸、氢氧化钾和硝酸钾五瓶溶液。为把它们区分开来,所加试剂及先后顺序合理的一组是( )
A.氯化钡溶液、稀硝酸、石蕊试液 B.稀硝酸、石蕊试液、硝酸银溶液
C.石蕊试液、稀硝酸、硝酸银溶液 D.稀硝酸、酚酞试液、硝酸银溶液
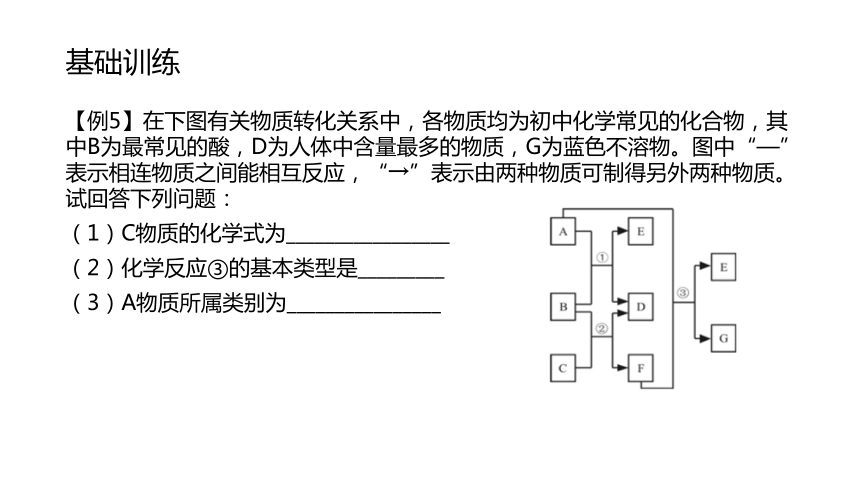
基础训练【例5】在下图有关物质转化关系中,各物质均为初中化学常见的化合物,其中B为最常见的酸,D为人体中含量最多的物质,G为蓝色不溶物。图中“—”表示相连物质之间能相互反应,“→”表示由两种物质可制得另外两种物质。试回答下列问题:
(1)C物质的化学式为_________________
(2)化学反应③的基本类型是_________
(3)A物质所属类别为________________
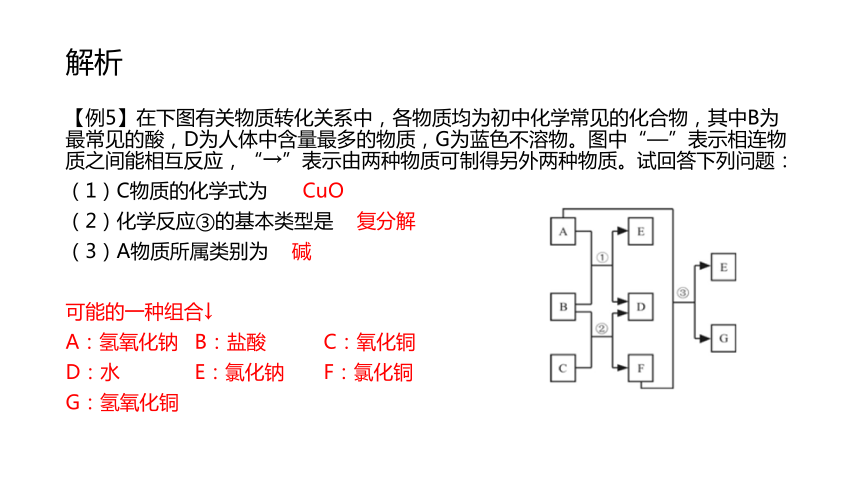
解析【例5】在下图有关物质转化关系中,各物质均为初中化学常见的化合物,其中B为最常见的酸,D为人体中含量最多的物质,G为蓝色不溶物。图中“—”表示相连物质之间能相互反应,“→”表示由两种物质可制得另外两种物质。试回答下列问题:
(1)C物质的化学式为 CuO
(2)化学反应③的基本类型是 复分解
(3)A物质所属类别为 碱
可能的一种组合↓
A:氢氧化钠 B:盐酸 C:氧化铜
D:水 E:氯化钠 F:氯化铜
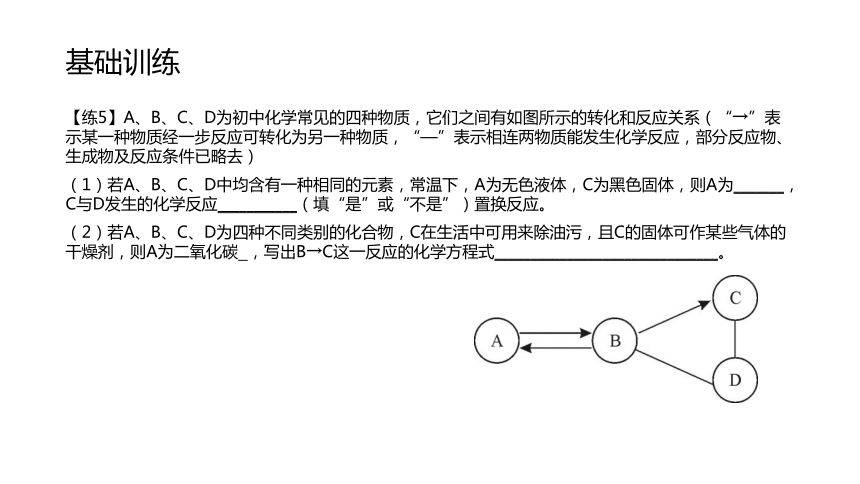
G:氢氧化铜 基础训练【练5】A、B、C、D为初中化学常见的四种物质,它们之间有如图所示的转化和反应关系(“→”表示某一种物质经一步反应可转化为另一种物质,“—”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去)
(1)若A、B、C、D中均含有一种相同的元素,常温下,A为无色液体,C为黑色固体,则A为_______,C与D发生的化学反应___________(填“是”或“不是”)置换反应。
(2)若A、B、C、D为四种不同类别的化合物,C在生活中可用来除油污,且C的固体可作某些气体的干燥剂,则A为二氧化碳 ,写出B→C这一反应的化学方程式_______________________________。解析【练5】A、B、C、D为初中化学常见的四种物质,它们之间有如图所示的转化和反应关系(“→”表示某一种物质经一步反应可转化为另一种物质,“—”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去)
(1)若A、B、C、D中均含有一种相同的元素,常温下,A为无色液体,C为黑色固体,则A为 水 ,C与D发生的化学反应 不是 (填“是”或“不是”)置换反应。
(2)若A、B、C、D为四种不同类别的化合物,C在生活中可用来除油污,且C的固体可作某些气体的干燥剂,则A为二氧化碳 ,写出B→C这一反应的化学方程式
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH 。141.物质转化2.拓展提高15拓展提高?16解析?17拓展提高?18解析?19拓展提高【例2】 A~I表示初中化学常见的物质.其中C是大理石的主要成分.各物质间相互转化关系如图所示(反应条件已略去)
请回答下列问题:
(1)C的化学式______________. ?
(2)A的一种用途是__________________.
(3)上述转化中没有涉及的基本反应类型是_____________ .
(4)反应③的化学方程式为(只写一个) ?__________________________________.
20解析【例2】 A~I表示初中化学常见的物质.其中C是大理石的主要成分.各物质间相互转化关系如图所示(反应条件已略去)
请回答下列问题:
(1)C的化学式为 CaCO3? ? ? . ?
(2)A的一种用途是 ? 改良酸性土壤 ? ? ? .
(3)上述转化中没有涉及的基本反应类型是 置换反应? ? ? ? .
(4)反应③的化学方程式为(只写一个) ? NaOH+HCl=NaCl+H2O ? ? ? ? .
21拓展提高【练2】高纯氧化锌广泛应用于电子工业,某研究小组设计如图流程制备高纯氧化锌.
(1)反应①的化学方程式为 ______________________________.
(2)反应②的基本反应类型是 _____________.
(3)反应②后进行的分离操作名称是 __________,若得到的NH4Cl溶液有浑浊,原因可能是_________(写出一种即可).
(4)反应③属于分解反应,除得到氧化锌外还生成2种常见气体,其化学式为 ___________.
22解析【练2】高纯氧化锌广泛应用于电子工业,某研究小组设计如图流程制备高纯氧化锌.
(1)反应①的化学方程式为 Zn+2HCl═ZnCl2+H2↑ .
(2)反应②的基本反应类型是 复分解反应 .
(3)反应②后进行的分离操作名称是 过滤 ,若得到的NH4Cl溶液有浑浊,原因可能是 滤纸破损 .
(4)反应③属于分解反应,除得到氧化锌外还生成2种常见气体,其化学式为 CO2 、 CO .
23拓展提高【例3】将6g不纯锌(含杂质M)和6g不纯铁(含杂质N),分别加入到足量的稀硫酸中,反应到不再有氢气放出时,得到氢气的质量都是0.2g。则M、N可能是( )
A.M为Mg,N为Cu B.M为Fe,N为Al
C.M为Al,N为Na D.N为Cu,N为Zn
24拓展提高【练3】有一在空气中暴露过的KOH样品,经分析测知其含水7.62%,含K2CO32.38%,KOH90%,若将此样品加入10g20%的盐酸中,再用10.2%的KOH溶液中和过量的酸,则蒸发中和后的溶液所得固体的质量约为( )A.3.4g B.4.1g C.4.5g D.无法计算
解析【例3】将6g不纯锌(含杂质M)和6g不纯铁(含杂质N),分别加入到足量的稀硫酸中,反应到不再有氢气放出时,得到氢气的质量都是0.2g。则M、N可能是( )
A.M为Mg,N为Cu B.M为Fe,N为Al
C.M为Al,N为Na D.N为Cu,N为Zn
【练3】有一在空气中暴露过的KOH样品,经分析测知其含水7.62%,含K2CO32.38%,KOH90%,若将此样品加入10g20%的盐酸中,再用10.2%的KOH溶液中和过量的酸,则蒸发中和后的溶液所得固体的质量约为( )
A.3.4g B.4.1g C.4.5g D.无法计算
25拓展提高【例4】资料显示:碳还原氧化铁的过程如下。
下图所示的实验中,
反应前氧化铁和碳粉的质量分别为32克和1.2克,反应后得到气体A和28.8克黑色固体B。
(1)求白色沉淀的质量;
(2)推断黑色固体B的化学式。(要求写出推断过程)
26解析【例4】资料显示:碳还原氧化铁的过程如下。
下图所示的实验中,
反应前氧化铁和碳粉的质量分别为32克和1.2克,反应后得到气体A和28.8克黑色固体B。
(1)求白色沉淀的质量;
(2)推断黑色固体B的化学式。(要求写出推断过程)
2728拓展提高【练4】有一块表面已经生锈的铁片(假设铁锈完全是Fe2O3),质量为12.8克,跟146克稀盐酸恰好完全反应,生成0.4克氢气。求:
(1)铁片中单质铁的质量分数。
(2)稀盐酸中溶质的质量分数。
29解析【练4】有一块表面已经生锈的铁片(假设铁锈完全是Fe2O3),质量为12.8克,跟146克稀盐酸恰好完全反应,生成0.4克氢气。求:(1)铁片中单质铁的质量分数。(2)稀盐酸中溶质的质量分数。
30拓展提高【例5】绿矾(FeSO4?7H2O)是硫酸法生产太白粉的主要副产物,可用于制备Fe2O3,复印用Fe3O4粉、还原铁粉等,开发利用绿矾工艺是一项十分有意义的工作,某研究性小组展开了系列研究.
【制备Fe2O3】
[资料一]
(1)无水硫酸铜遇水变成蓝色的硫酸铜晶体.
(2)绿矾(FeSO4?7H2O)高温分解产生一种金属氧化物和几种气态非金属氧化物.
(3)SO2是无色有窒息性臭味的有毒气体,能使品红溶液褪色.
甲同学用如下装置制备Fe2O3并验证绿矾受热分解的其他产物;
实验过程中发现:A中有 色固体生成,B中无水硫酸铜变蓝,
C中U形管内有无色晶体(SO3)析出,D中品红溶液褪色,装置E的作用是_______________________.
31拓展提高【制备Fe3O4】
乙同学模拟生产复印用Fe3O4粉的实验流程如下:
【资料二】Fe(OH)2是一种白色难溶于水的固体,在空气中易被氧化.
FeSO4溶液中加入NaOH溶液,反应的化学方程式依次为①_______________________________________,②__________________________,由沉淀a获得Fe3O4的化学方程式为________________________________。
若制取Fe(OH)2,采取的实验操作是:向盛有5mL新制FeSO4溶液的试管中加入10滴植物油,然后用胶头滴管加煮沸的NaOH溶液(驱赶O2),胶头滴管的正确使用方法是 (填字母).
32拓展提高【制备还原铁粉】
制备还原铁粉的工业流程如下:
(1)操作1的名称是 ,NH4HCO3和FeSO4溶液反应的化学方程式为_____________________________.
(2)粗还原铁粉经加工处理后变成纯还原铁粉,纯还原铁粉和水蒸气在高温条件下也可制得四氧化三铁,同时生成一种气体.其装置如图所示:
SAP材料吸水性强,湿润的SAP材料能为该反应持续提供水蒸气.实验开始一段时间后,观察到在肥皂液中有大量的气泡产生,此气泡用火柴即能点燃,同时有肥皂泡飘到空中.生成的气体是_______,干燥的SAP材料作用是_____________________________________________.
33解析实验过程中发现:A中有 红棕 色固体生成,B中无水硫酸铜变蓝,C中U形管内有无色晶体(SO3)析出,D中品红溶液褪色,装置E的作用是 吸收SO2防止污染环境
FeSO4溶液中加入NaOH溶液,反应的化学方程式依次为① FeSO4+2NaOH═Fe(OH)2↓+Na2SO4 , ②4Fe(OH)2+O2+2H2O═4Fe(OH)3.
由沉淀a获得Fe3O4的化学方程式为:6Fe(OH)2+O2═2Fe3O4+6H2O
胶头滴管的正确使用方法是 A (填字母)
(1)操作1的名称是 过滤 ,NH4HCO3和FeSO4溶液反应的化学方程式为 FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O
生成的气体是 氢气 ,干燥的SAP材料作用是 吸收冷凝水及多余的水蒸气,进而有利于进行氢气的验证
本节作业34
酸的化学性质:主要能与5种(类)物质发生反应。
碱的化学性质:主要能与4种(类)物质发生反应。
盐的化学性质:主要能与4种(类)物质发生反应。
金属的化学性质:主要能与3种(类)物质发生反应。
金属氧化物的化学性质:主要能与2种(类)物质发生反应。
非金属氧化物的化学性质:主要能与2种(类)物质发生反应。
制碱:2种方法
制酸:2种方法
3基础训练【例1】下列转化能一步完成的是( )
A.Cu→Ag B.HNO3→HCl
C.Ba(OH)2→NaOH D.CuO→Cu(OH)2
【练1】稀硫酸和下列物质能发生中和反应,又能生成白色沉淀的是( )
A.Mg(OH)2 B.BaCl2 C.K2CO3 D.Ba(OH)2
【例2】下列各组物质在溶液中能够共存的是( )
A.氯化钡和硝酸银 B.硫酸和硝酸钡
C.盐酸和氯化钡 D.铁和稀盐酸
【练2】分别将下列各组物质同时加到水中,不能大量共存的是( )
A.NaCl、AgNO3、Na2SO4 B.H2SO4、NaCl、Na2CO3
C.Na2SO4、KNO3、NaOH D.BaCl2、NaCl、KOH解析【例1】下列转化能一步完成的是( )
A.Cu→Ag B.HNO3→HCl
C.Ba(OH)2→NaOH D.CuO→Cu(OH)2
【练1】稀硫酸和下列物质能发生中和反应,又能生成白色沉淀的是( )
A.Mg(OH)2 B.BaCl2 C.K2CO3 D.Ba(OH)2
【例2】下列各组物质在溶液中能够共存的是( )
A.氯化钡和硝酸银 B.硫酸和硝酸钡
C.盐酸和氯化钡 D.铁和稀盐酸
【练2】分别将下列各组物质同时加到水中,不能大量共存的是( )
A.NaCl、AgNO3、Na2SO4 B.H2SO4、NaCl、Na2CO3
C.Na2SO4、KNO3、NaOH D.BaCl2、NaCl、KOH
6初中阶段常见离子的检验方法基础训练【例3】欲除去硝酸钠溶液中少量的碳酸钠,又不混入其他物质,可加入适量的试剂是( )
A.氢氧化钙溶液 B.稀硫酸
C.硝酸钙溶液 D.氯化钙溶液
【练3】下列各组物质的溶液,在常温下两两混合都能发生反应的一组是( )
A.AgNO3、HCl、Cu(NO3)2 B.Ca(OH)2、Na2CO3、HCl
C.BaCl2、AgNO3、Na2SO4 D.NaOH、MgCl2、H2SO4
除杂题三原则;三要领;五方法。
三原则:
①不引入新杂质;
②不减少被提纯物质的质量;
③杂质便于分离。
三要领:
①根据物理性质或化学性质的差异;
②确定除杂质方法;
③选择适宜试剂。
五方法:
①沉淀法:加入一种试剂将被除去的杂质变为沉淀,再用过滤法除去。
②化气法:加热或加入一种试剂将杂质变为气体逸出。
③置换法:利用置换反应的原理将杂质除去。
④转纯法:将被除去的杂质变为提纯的物质。
⑤吸收法:常用于气体的提纯。基础训练【例4】向AgNO3、Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应后过滤,向滤液中滴加稀盐酸有白色沉淀产生。下列说法中,正确的是( )
A.所得滤液中可能含有Cu2+ B.所得滤渣中可能含有铜和锌
C.所得滤液中一定含有Ag+、Zn2+、Cu2 + D.所得滤渣中一定含有银和铜
【练4】实验室有失去标签的盐酸、碳酸钠、硫酸、氢氧化钾和硝酸钾五瓶溶液。为把它们区分开来,所加试剂及先后顺序合理的一组是( )
A.氯化钡溶液、稀硝酸、石蕊试液 B.稀硝酸、石蕊试液、硝酸银溶液
C.石蕊试液、稀硝酸、硝酸银溶液 D.稀硝酸、酚酞试液、硝酸银溶液
解析【例3】欲除去硝酸钠溶液中少量的碳酸钠,又不混入其他物质,可加入适量的试剂是( )
A.氢氧化钙溶液 B.稀硫酸 C.硝酸钙溶液 D.氯化钙溶液
【练3】下列各组物质的溶液,在常温下两两混合都能发生反应的一组是( )
A.AgNO3、HCl、Cu(NO3)2 B.Ca(OH)2、Na2CO3、HCl
C.BaCl2、AgNO3、Na2SO4 D.NaOH、MgCl2、H2SO4
【例4】向AgNO3、Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应后过滤,向滤液中滴加稀盐酸有白色沉淀产生。下列说法中,正确的是( )
A.所得滤液中可能含有Cu2+ B.所得滤渣中可能含有铜和锌
C.所得滤液中一定含有Ag+、Zn2+、Cu2 + D.所得滤渣中一定含有银和铜
【练4】实验室有失去标签的盐酸、碳酸钠、硫酸、氢氧化钾和硝酸钾五瓶溶液。为把它们区分开来,所加试剂及先后顺序合理的一组是( )
A.氯化钡溶液、稀硝酸、石蕊试液 B.稀硝酸、石蕊试液、硝酸银溶液
C.石蕊试液、稀硝酸、硝酸银溶液 D.稀硝酸、酚酞试液、硝酸银溶液
基础训练【例5】在下图有关物质转化关系中,各物质均为初中化学常见的化合物,其中B为最常见的酸,D为人体中含量最多的物质,G为蓝色不溶物。图中“—”表示相连物质之间能相互反应,“→”表示由两种物质可制得另外两种物质。试回答下列问题:
(1)C物质的化学式为_________________
(2)化学反应③的基本类型是_________
(3)A物质所属类别为________________
解析【例5】在下图有关物质转化关系中,各物质均为初中化学常见的化合物,其中B为最常见的酸,D为人体中含量最多的物质,G为蓝色不溶物。图中“—”表示相连物质之间能相互反应,“→”表示由两种物质可制得另外两种物质。试回答下列问题:
(1)C物质的化学式为 CuO
(2)化学反应③的基本类型是 复分解
(3)A物质所属类别为 碱
可能的一种组合↓
A:氢氧化钠 B:盐酸 C:氧化铜
D:水 E:氯化钠 F:氯化铜
G:氢氧化铜 基础训练【练5】A、B、C、D为初中化学常见的四种物质,它们之间有如图所示的转化和反应关系(“→”表示某一种物质经一步反应可转化为另一种物质,“—”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去)
(1)若A、B、C、D中均含有一种相同的元素,常温下,A为无色液体,C为黑色固体,则A为_______,C与D发生的化学反应___________(填“是”或“不是”)置换反应。
(2)若A、B、C、D为四种不同类别的化合物,C在生活中可用来除油污,且C的固体可作某些气体的干燥剂,则A为二氧化碳 ,写出B→C这一反应的化学方程式_______________________________。解析【练5】A、B、C、D为初中化学常见的四种物质,它们之间有如图所示的转化和反应关系(“→”表示某一种物质经一步反应可转化为另一种物质,“—”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去)
(1)若A、B、C、D中均含有一种相同的元素,常温下,A为无色液体,C为黑色固体,则A为 水 ,C与D发生的化学反应 不是 (填“是”或“不是”)置换反应。
(2)若A、B、C、D为四种不同类别的化合物,C在生活中可用来除油污,且C的固体可作某些气体的干燥剂,则A为二氧化碳 ,写出B→C这一反应的化学方程式
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH 。141.物质转化2.拓展提高15拓展提高?16解析?17拓展提高?18解析?19拓展提高【例2】 A~I表示初中化学常见的物质.其中C是大理石的主要成分.各物质间相互转化关系如图所示(反应条件已略去)
请回答下列问题:
(1)C的化学式______________. ?
(2)A的一种用途是__________________.
(3)上述转化中没有涉及的基本反应类型是_____________ .
(4)反应③的化学方程式为(只写一个) ?__________________________________.
20解析【例2】 A~I表示初中化学常见的物质.其中C是大理石的主要成分.各物质间相互转化关系如图所示(反应条件已略去)
请回答下列问题:
(1)C的化学式为 CaCO3? ? ? . ?
(2)A的一种用途是 ? 改良酸性土壤 ? ? ? .
(3)上述转化中没有涉及的基本反应类型是 置换反应? ? ? ? .
(4)反应③的化学方程式为(只写一个) ? NaOH+HCl=NaCl+H2O ? ? ? ? .
21拓展提高【练2】高纯氧化锌广泛应用于电子工业,某研究小组设计如图流程制备高纯氧化锌.
(1)反应①的化学方程式为 ______________________________.
(2)反应②的基本反应类型是 _____________.
(3)反应②后进行的分离操作名称是 __________,若得到的NH4Cl溶液有浑浊,原因可能是_________(写出一种即可).
(4)反应③属于分解反应,除得到氧化锌外还生成2种常见气体,其化学式为 ___________.
22解析【练2】高纯氧化锌广泛应用于电子工业,某研究小组设计如图流程制备高纯氧化锌.
(1)反应①的化学方程式为 Zn+2HCl═ZnCl2+H2↑ .
(2)反应②的基本反应类型是 复分解反应 .
(3)反应②后进行的分离操作名称是 过滤 ,若得到的NH4Cl溶液有浑浊,原因可能是 滤纸破损 .
(4)反应③属于分解反应,除得到氧化锌外还生成2种常见气体,其化学式为 CO2 、 CO .
23拓展提高【例3】将6g不纯锌(含杂质M)和6g不纯铁(含杂质N),分别加入到足量的稀硫酸中,反应到不再有氢气放出时,得到氢气的质量都是0.2g。则M、N可能是( )
A.M为Mg,N为Cu B.M为Fe,N为Al
C.M为Al,N为Na D.N为Cu,N为Zn
24拓展提高【练3】有一在空气中暴露过的KOH样品,经分析测知其含水7.62%,含K2CO32.38%,KOH90%,若将此样品加入10g20%的盐酸中,再用10.2%的KOH溶液中和过量的酸,则蒸发中和后的溶液所得固体的质量约为( )A.3.4g B.4.1g C.4.5g D.无法计算
解析【例3】将6g不纯锌(含杂质M)和6g不纯铁(含杂质N),分别加入到足量的稀硫酸中,反应到不再有氢气放出时,得到氢气的质量都是0.2g。则M、N可能是( )
A.M为Mg,N为Cu B.M为Fe,N为Al
C.M为Al,N为Na D.N为Cu,N为Zn
【练3】有一在空气中暴露过的KOH样品,经分析测知其含水7.62%,含K2CO32.38%,KOH90%,若将此样品加入10g20%的盐酸中,再用10.2%的KOH溶液中和过量的酸,则蒸发中和后的溶液所得固体的质量约为( )
A.3.4g B.4.1g C.4.5g D.无法计算
25拓展提高【例4】资料显示:碳还原氧化铁的过程如下。
下图所示的实验中,
反应前氧化铁和碳粉的质量分别为32克和1.2克,反应后得到气体A和28.8克黑色固体B。
(1)求白色沉淀的质量;
(2)推断黑色固体B的化学式。(要求写出推断过程)
26解析【例4】资料显示:碳还原氧化铁的过程如下。
下图所示的实验中,
反应前氧化铁和碳粉的质量分别为32克和1.2克,反应后得到气体A和28.8克黑色固体B。
(1)求白色沉淀的质量;
(2)推断黑色固体B的化学式。(要求写出推断过程)
2728拓展提高【练4】有一块表面已经生锈的铁片(假设铁锈完全是Fe2O3),质量为12.8克,跟146克稀盐酸恰好完全反应,生成0.4克氢气。求:
(1)铁片中单质铁的质量分数。
(2)稀盐酸中溶质的质量分数。
29解析【练4】有一块表面已经生锈的铁片(假设铁锈完全是Fe2O3),质量为12.8克,跟146克稀盐酸恰好完全反应,生成0.4克氢气。求:(1)铁片中单质铁的质量分数。(2)稀盐酸中溶质的质量分数。
30拓展提高【例5】绿矾(FeSO4?7H2O)是硫酸法生产太白粉的主要副产物,可用于制备Fe2O3,复印用Fe3O4粉、还原铁粉等,开发利用绿矾工艺是一项十分有意义的工作,某研究性小组展开了系列研究.
【制备Fe2O3】
[资料一]
(1)无水硫酸铜遇水变成蓝色的硫酸铜晶体.
(2)绿矾(FeSO4?7H2O)高温分解产生一种金属氧化物和几种气态非金属氧化物.
(3)SO2是无色有窒息性臭味的有毒气体,能使品红溶液褪色.
甲同学用如下装置制备Fe2O3并验证绿矾受热分解的其他产物;
实验过程中发现:A中有 色固体生成,B中无水硫酸铜变蓝,
C中U形管内有无色晶体(SO3)析出,D中品红溶液褪色,装置E的作用是_______________________.
31拓展提高【制备Fe3O4】
乙同学模拟生产复印用Fe3O4粉的实验流程如下:
【资料二】Fe(OH)2是一种白色难溶于水的固体,在空气中易被氧化.
FeSO4溶液中加入NaOH溶液,反应的化学方程式依次为①_______________________________________,②__________________________,由沉淀a获得Fe3O4的化学方程式为________________________________。
若制取Fe(OH)2,采取的实验操作是:向盛有5mL新制FeSO4溶液的试管中加入10滴植物油,然后用胶头滴管加煮沸的NaOH溶液(驱赶O2),胶头滴管的正确使用方法是 (填字母).
32拓展提高【制备还原铁粉】
制备还原铁粉的工业流程如下:
(1)操作1的名称是 ,NH4HCO3和FeSO4溶液反应的化学方程式为_____________________________.
(2)粗还原铁粉经加工处理后变成纯还原铁粉,纯还原铁粉和水蒸气在高温条件下也可制得四氧化三铁,同时生成一种气体.其装置如图所示:
SAP材料吸水性强,湿润的SAP材料能为该反应持续提供水蒸气.实验开始一段时间后,观察到在肥皂液中有大量的气泡产生,此气泡用火柴即能点燃,同时有肥皂泡飘到空中.生成的气体是_______,干燥的SAP材料作用是_____________________________________________.
33解析实验过程中发现:A中有 红棕 色固体生成,B中无水硫酸铜变蓝,C中U形管内有无色晶体(SO3)析出,D中品红溶液褪色,装置E的作用是 吸收SO2防止污染环境
FeSO4溶液中加入NaOH溶液,反应的化学方程式依次为① FeSO4+2NaOH═Fe(OH)2↓+Na2SO4 , ②4Fe(OH)2+O2+2H2O═4Fe(OH)3.
由沉淀a获得Fe3O4的化学方程式为:6Fe(OH)2+O2═2Fe3O4+6H2O
胶头滴管的正确使用方法是 A (填字母)
(1)操作1的名称是 过滤 ,NH4HCO3和FeSO4溶液反应的化学方程式为 FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O
生成的气体是 氢气 ,干燥的SAP材料作用是 吸收冷凝水及多余的水蒸气,进而有利于进行氢气的验证
本节作业34
