18.4 波尔的原子模型课件(33张ppt)
文档属性
| 名称 | 18.4 波尔的原子模型课件(33张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 物理 | ||
| 更新时间 | 2019-06-13 00:00:00 | ||
图片预览





文档简介
课件33张PPT。第四节 玻尔的原子模型第十八章原子结构好漂亮的霓虹灯!情 景 导 入 霓虹灯发出的光,线条结构丰富,色彩鲜艳、绚丽多姿,形状、色彩变幻莫测,令人赏心悦目。一幅幅流动的画面,似天上彩虹,像人间银河,更酷似一个梦幻世界,使人难以忘怀。霓虹灯是一种增添节日欢快气氛和进行广告宣传的最佳光源,霓虹灯的亮、美、动特点,在各类新型光源中独领风骚。同学们,你们知道霓虹灯的发光原理吗?一、玻尔提出原子模型的背景
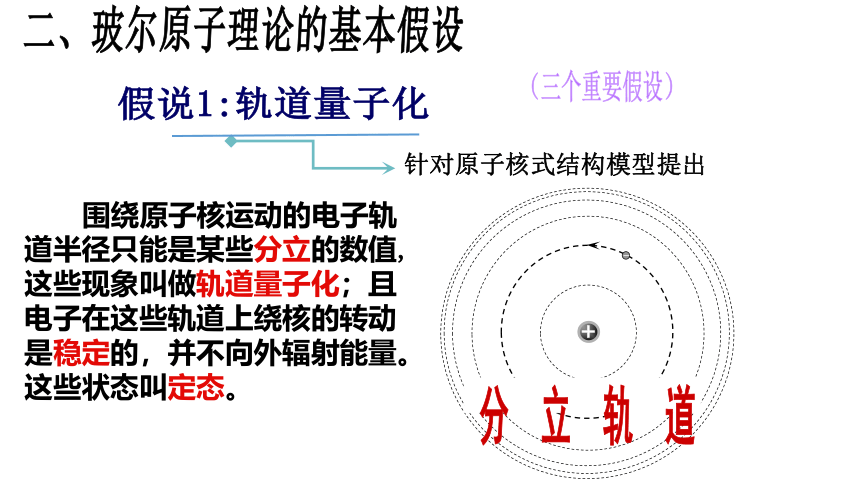
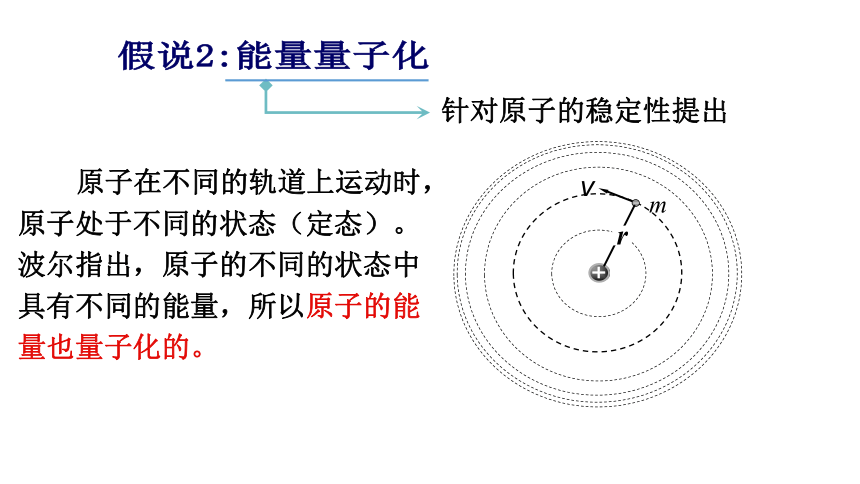
卢瑟福的原子核式结构学说很好地解释了a粒子的散射实验,初步建立了原子结构的正确图景,但跟经典的电磁理论发生了矛盾。 1、电子以很大的速度绕核运动,就象行星绕着太阳运动那样。按照经典理论,绕核运动的电子应该辐射出电磁波,因此它的能量要逐渐减少。随着能量的减少,电子绕核运行的轨道半径也要减小,于是电子将沿着螺旋线的轨道落入原子核,就像绕地球运动的人造卫星受到上层大气阻力不断损失能量后要落到地面上一样。 这样看来,原子应当是不稳定的,然而实际上并不是这样。 2、同时,按照经典电磁理论,电子绕核运行时辐射电磁波的频率应该等于电子绕核运行的频率,随着运行轨道半径的不断变化,电子绕核运行的频率要不断变化,因此原子辐射电磁波的频率也要不断变化。这样,大量原子发光的光谱就应该是包含一切频率的连续谱。 以上矛盾表明,从宏观现象总结出来的经典电磁理论不适用于原子这样小的物体产生的微观现象。为了解决这个矛盾,1913年玻尔在卢瑟福学说的基础上,把普朗克的量子理论运用到原子系统上,提出了玻尔理论。二、玻尔原子理论的基本假设(三个重要假设)假说1:轨道量子化针对原子核式结构模型提出 围绕原子核运动的电子轨道半径只能是某些分立的数值,这些现象叫做轨道量子化;且电子在这些轨道上绕核的转动是稳定的,并不向外辐射能量。这些状态叫定态。 原子在不同的轨道上运动时,原子处于不同的状态(定态)。波尔指出,原子的不同的状态中具有不同的能量,所以原子的能量也量子化的。假说2:能量量子化针对原子的稳定性提出能级
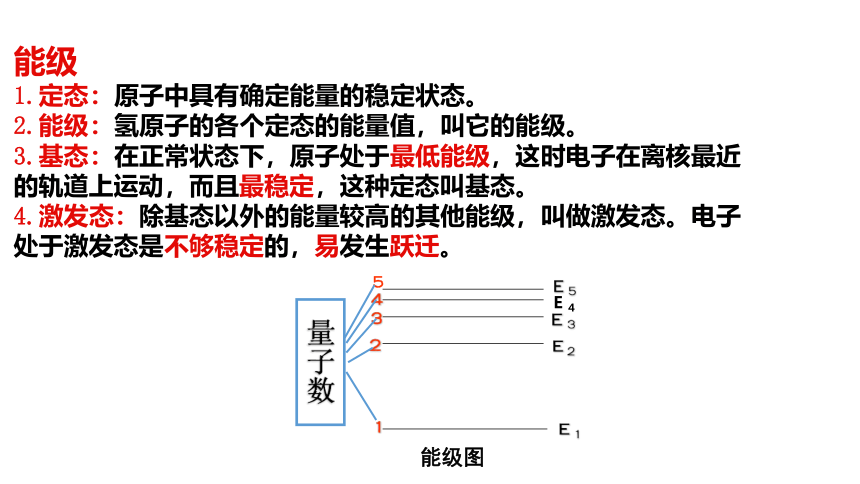
1.定态:原子中具有确定能量的稳定状态。
2.能级:氢原子的各个定态的能量值,叫它的能级。
3.基态:在正常状态下,原子处于最低能级,这时电子在离核最近的轨道上运动,而且最稳定,这种定态叫基态。
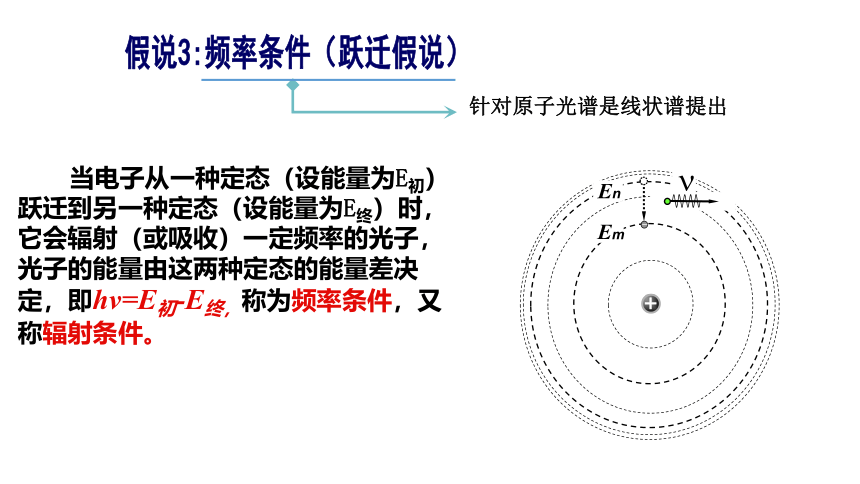
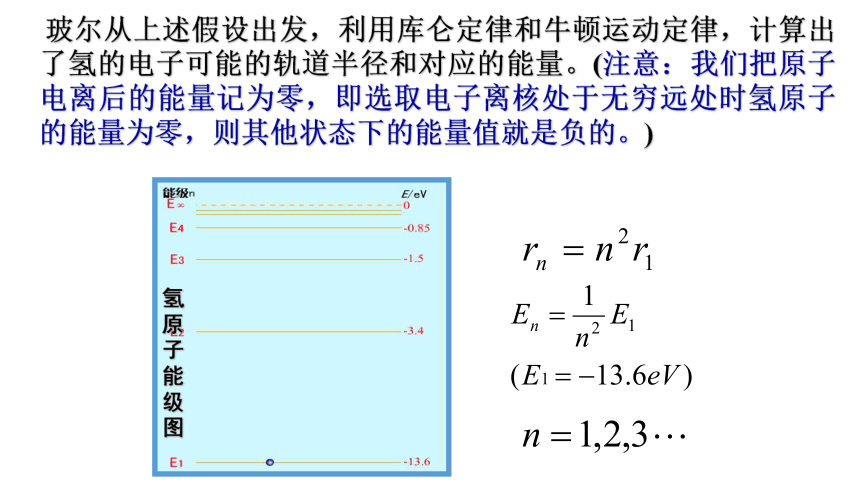
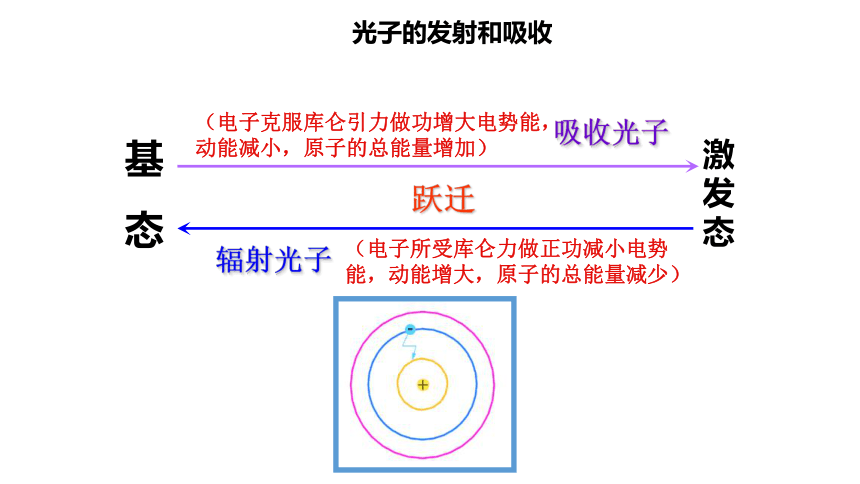
4.激发态:除基态以外的能量较高的其他能级,叫做激发态。电子处于激发态是不够稳定的,易发生跃迁。假说3:频率条件(跃迁假说)针对原子光谱是线状谱提出 当电子从一种定态(设能量为E初)跃迁到另一种定态(设能量为E终)时,它会辐射(或吸收)一定频率的光子,光子的能量由这两种定态的能量差决定,即hv=E初-E终,称为频率条件,又称辐射条件。 玻尔从上述假设出发,利用库仑定律和牛顿运动定律,计算出了氢的电子可能的轨道半径和对应的能量。(注意:我们把原子电离后的能量记为零,即选取电子离核处于无穷远处时氢原子的能量为零,则其他状态下的能量值就是负的。)氢原子能级图基
态激发态跃迁光子的发射和吸收氢原子的能级图-----------------12345-13.6-3.4-1.51-0.85-0.540 eVnE/eV∞基态激发态三、玻尔理论对氢光谱的解释能级的跃迁
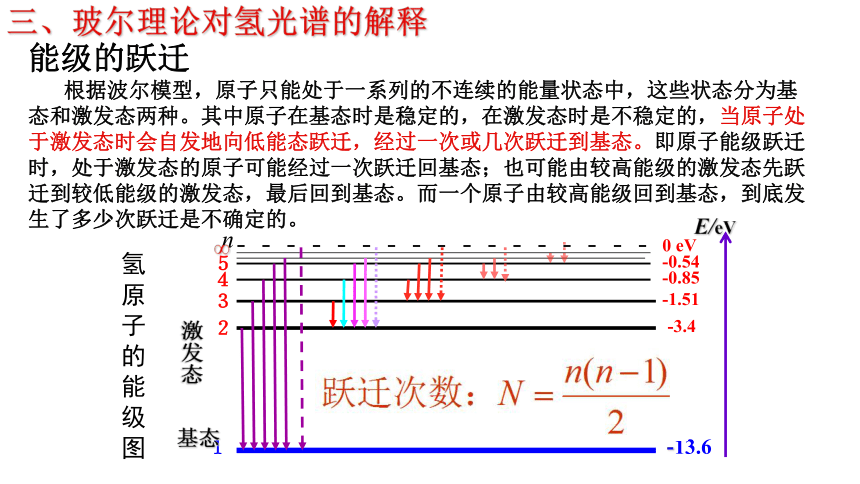
根据波尔模型,原子只能处于一系列的不连续的能量状态中,这些状态分为基态和激发态两种。其中原子在基态时是稳定的,在激发态时是不稳定的,当原子处于激发态时会自发地向低能态跃迁,经过一次或几次跃迁到基态。即原子能级跃迁时,处于激发态的原子可能经过一次跃迁回基态;也可能由较高能级的激发态先跃迁到较低能级的激发态,最后回到基态。而一个原子由较高能级回到基态,到底发生了多少次跃迁是不确定的。氢原子能级跃迁与光谱图巴耳末系问题1:巴尔末公式有正整数n出现,这里我们也用正整数n来标志氢原子的能级。它们之间是否有某种关系?巴尔末公式:n=6n=5n=4n=1n=3n=2根据:E=hc/λ
又Eδ =1.89eV= 3.03 ×10-19J
所以, λδ=hc/ Eδ
= 6.63×10-34 ×3.0 ×10-8 / 3.03 ×10-19J
= 6.57 ×10-7(m)(巴尔末系)三.玻尔理论对氢光谱的解释HδHγHβHα巴尔末系氢放出光谱三.玻尔理论对氢光谱的解释HδHγHβHαn=6n=5n=4n=1n=3n=2巴尔末系氢吸收光谱问题1:巴尔末公式有正整数n出现,这里我们也用正整数n来标志氢原子的能级。它们之间是否有某种关系?
问题2:气体导电发光机理是什么?
问题3:试解释原子光谱为什么是线状光谱?
问题4:不同元素的原子为什么具有不同的特征谱线?阅读教材P59,小组讨论回答以下几个问题三.玻尔理论对氢光谱的解释17 玻尔理论成功的解释并预言了氢原子辐射的电磁波的问题,但是也有它的局限性.在解决核外电子的运动时成功引入了量子化的观念同时又应用了“粒子、轨道”等经典概念和有关牛顿力学规律??除了氢原子光谱外,在解决其他问题上遇到了很大的困难.四、玻尔模型的局限性氦原子光谱量子化条件的引进没有适当的理论解释。汤姆孙发现电子汤姆孙的西瓜模型 α粒子散射实验卢瑟福的核式结构模型原子不可割汤姆孙的西瓜模型原子稳定性事实
氢光谱实验卢瑟福的核式结构模型?玻尔模型复杂(氦)原子光谱量子力学理论 玻尔模型观察与实验所获得的事实建
立
科
学
模
型
提
出
科
学
假
说拓展与提高怎样修改玻尔模型?思想:必须彻底放弃经典概念?关键:用电子云概念取代经典的轨道概念电子在某处单位体积内出现的概率——电子云原子结构的认识史19学以致用卢瑟福的核式结构学说与经典电磁理论的矛盾(一)原子是稳定的电子绕核运动将不断向外辐射电磁波,电子损失了能量,其轨道半径不断缩小,最终落在原子核上,而使原子变得不稳定.经典理论认为事实卢瑟福的核式结构学说与经典电磁理论的矛盾(二)由于电子轨道的变化是连续的,辐射电磁波的频率等于绕核运动的频率,连续变化,原子光谱应该是连续光谱经典理论认为事实原子光谱是不连续的线状谱通过本节的学习能解释霓虹灯的发光吗?若大量氢原子处于主量子数 的激发态,会辐射几种频率的光;在哪两个能级之间跃迁?最短波长光的频率是多少?n5其中波长最短的光是[例1]24练习:对玻尔理论的下列说法中,正确的是( )
A、继承了卢瑟福的原子模型,但对原子能量和电子轨道引入了量子化假设
B、对经典电磁理论中关于“做加速运动的电荷要辐射电磁波”的观点表示赞同
C、用能量转化与守恒建立了原子发光频率与原子能量变化之间的定量关系
D、玻尔的两个公式是在他的理论基础上利用经典电磁理论和牛顿力学计算出来的ACD学以致用2、下面关于玻尔理论的解释中,不正确的说法是( )
A、原子只能处于一系列不连续的状态中,每个状态都对应一定的能量
B、原子中,虽然核外电子不断做加速运动,但只要能量状态不改变,就不会向外辐射能量
C、原子从一种定态跃迁到另一种定态时,一定要辐射一定频率的光子
D、原子的每一个能量状态都对应一个电子轨道,并且这些轨道是不连续的C3、根据玻尔理论,氢原子中,量子数N越大,则下列说法中正确的是( )
A、电子轨道半径越大 B、核外电子的速率越大
C、氢原子能级的能量越大 D、核外电子的电势能越大4、根据玻尔的原子理论,原子中电子绕核运动的半径( )
A、可以取任意值 B、可以在某一范围内取任意值
C、可以取一系列不连续的任意值
D、是一系列不连续的特定值DACD5、按照玻尔理论,一个氢原子中的电子从一半径为ra的圆轨道自发地直接跃迁到一半径为rb的圆轨道上,已知ra>rb,则在此过程中( )
A、原子要发出一系列频率的光子
B、原子要吸收一系列频率的光子
C、原子要发出某一频率的光子
D、原子要吸收某一频率的光子C6.氢原子的能级图如右图所示,欲使一处于基态的氢原子释放出一个电子而变成氢离子,氢原子需要吸收的能量至少是:
A.13.60ev B.10.20ev
C.0.54ev D.27.0evA附加知识探究二名师精讲1.原子的能量及变化规律
(1)原子中的能量:En=Ekn+Epn。
(3)当电子的轨道半径增大时,库仑引力做负功,原子的电势能增大,反之电势能减小。电子在可能的轨道上绕核运动时,r增大,则Ek减小,Ep增大,E增大;反之,r减小,则Ek增大,Ep减小,E减小,与卫星绕地球运行相似。探究二2.典例剖析探究二典例剖析探究二名师精讲3.能级图的理解
(1)能级图中n称为量子数,E1代表氢原子的基态能量,即量子数n=1时对应的能量,其值为-13.6 eV。En代表电子在第n个轨道上运动时的能量。
(2)作能级图时,能级横线间的距离和相应的能级差相对应,能级差越大,间隔越宽,所以量子数越大,能级越密,竖直线的箭头表示原子跃迁方向,长度表示辐射光子能量的大小,n=1是原子的基态,n→∞是原子电离时对应的状态。
4.能级跃迁
处于激发态的原子是不稳定的,它会自发地向较低能级跃迁,经过一次或几次跃迁到达基态。所以一群氢原子处于量子数为n的激发态时,可能辐射出的光谱线条数为探究二名师精讲5.光子的发射
原子由高能级向低能级跃迁时以光子的形式放出能量,发射光子的频率由下式决定。
hν=Em-En(Em、En是始末两个能级且m>n)
能级差越大,放出光子的频率就越高。
6.使原子能级跃迁的两种粒子——光子与实物粒子
(1)原子若是吸收光子的能量而被激发,其光子的能量必须等于两能级的能量差,否则不被吸收,不存在激发到n能级时能量有余,而激发到n+1时能量不足,则可激发到n能级的问题。
(2)原子还可吸收外来实物粒子(例如,自由电子)的能量而被激发,由于实物粒子的动能可部分地被原子吸收,所以只要入射粒子的能量大于两能级的能量差值(E=En-Ek),就可使原子发生能级跃迁。
卢瑟福的原子核式结构学说很好地解释了a粒子的散射实验,初步建立了原子结构的正确图景,但跟经典的电磁理论发生了矛盾。 1、电子以很大的速度绕核运动,就象行星绕着太阳运动那样。按照经典理论,绕核运动的电子应该辐射出电磁波,因此它的能量要逐渐减少。随着能量的减少,电子绕核运行的轨道半径也要减小,于是电子将沿着螺旋线的轨道落入原子核,就像绕地球运动的人造卫星受到上层大气阻力不断损失能量后要落到地面上一样。 这样看来,原子应当是不稳定的,然而实际上并不是这样。 2、同时,按照经典电磁理论,电子绕核运行时辐射电磁波的频率应该等于电子绕核运行的频率,随着运行轨道半径的不断变化,电子绕核运行的频率要不断变化,因此原子辐射电磁波的频率也要不断变化。这样,大量原子发光的光谱就应该是包含一切频率的连续谱。 以上矛盾表明,从宏观现象总结出来的经典电磁理论不适用于原子这样小的物体产生的微观现象。为了解决这个矛盾,1913年玻尔在卢瑟福学说的基础上,把普朗克的量子理论运用到原子系统上,提出了玻尔理论。二、玻尔原子理论的基本假设(三个重要假设)假说1:轨道量子化针对原子核式结构模型提出 围绕原子核运动的电子轨道半径只能是某些分立的数值,这些现象叫做轨道量子化;且电子在这些轨道上绕核的转动是稳定的,并不向外辐射能量。这些状态叫定态。 原子在不同的轨道上运动时,原子处于不同的状态(定态)。波尔指出,原子的不同的状态中具有不同的能量,所以原子的能量也量子化的。假说2:能量量子化针对原子的稳定性提出能级
1.定态:原子中具有确定能量的稳定状态。
2.能级:氢原子的各个定态的能量值,叫它的能级。
3.基态:在正常状态下,原子处于最低能级,这时电子在离核最近的轨道上运动,而且最稳定,这种定态叫基态。
4.激发态:除基态以外的能量较高的其他能级,叫做激发态。电子处于激发态是不够稳定的,易发生跃迁。假说3:频率条件(跃迁假说)针对原子光谱是线状谱提出 当电子从一种定态(设能量为E初)跃迁到另一种定态(设能量为E终)时,它会辐射(或吸收)一定频率的光子,光子的能量由这两种定态的能量差决定,即hv=E初-E终,称为频率条件,又称辐射条件。 玻尔从上述假设出发,利用库仑定律和牛顿运动定律,计算出了氢的电子可能的轨道半径和对应的能量。(注意:我们把原子电离后的能量记为零,即选取电子离核处于无穷远处时氢原子的能量为零,则其他状态下的能量值就是负的。)氢原子能级图基
态激发态跃迁光子的发射和吸收氢原子的能级图-----------------12345-13.6-3.4-1.51-0.85-0.540 eVnE/eV∞基态激发态三、玻尔理论对氢光谱的解释能级的跃迁
根据波尔模型,原子只能处于一系列的不连续的能量状态中,这些状态分为基态和激发态两种。其中原子在基态时是稳定的,在激发态时是不稳定的,当原子处于激发态时会自发地向低能态跃迁,经过一次或几次跃迁到基态。即原子能级跃迁时,处于激发态的原子可能经过一次跃迁回基态;也可能由较高能级的激发态先跃迁到较低能级的激发态,最后回到基态。而一个原子由较高能级回到基态,到底发生了多少次跃迁是不确定的。氢原子能级跃迁与光谱图巴耳末系问题1:巴尔末公式有正整数n出现,这里我们也用正整数n来标志氢原子的能级。它们之间是否有某种关系?巴尔末公式:n=6n=5n=4n=1n=3n=2根据:E=hc/λ
又Eδ =1.89eV= 3.03 ×10-19J
所以, λδ=hc/ Eδ
= 6.63×10-34 ×3.0 ×10-8 / 3.03 ×10-19J
= 6.57 ×10-7(m)(巴尔末系)三.玻尔理论对氢光谱的解释HδHγHβHα巴尔末系氢放出光谱三.玻尔理论对氢光谱的解释HδHγHβHαn=6n=5n=4n=1n=3n=2巴尔末系氢吸收光谱问题1:巴尔末公式有正整数n出现,这里我们也用正整数n来标志氢原子的能级。它们之间是否有某种关系?
问题2:气体导电发光机理是什么?
问题3:试解释原子光谱为什么是线状光谱?
问题4:不同元素的原子为什么具有不同的特征谱线?阅读教材P59,小组讨论回答以下几个问题三.玻尔理论对氢光谱的解释17 玻尔理论成功的解释并预言了氢原子辐射的电磁波的问题,但是也有它的局限性.在解决核外电子的运动时成功引入了量子化的观念同时又应用了“粒子、轨道”等经典概念和有关牛顿力学规律??除了氢原子光谱外,在解决其他问题上遇到了很大的困难.四、玻尔模型的局限性氦原子光谱量子化条件的引进没有适当的理论解释。汤姆孙发现电子汤姆孙的西瓜模型 α粒子散射实验卢瑟福的核式结构模型原子不可割汤姆孙的西瓜模型原子稳定性事实
氢光谱实验卢瑟福的核式结构模型?玻尔模型复杂(氦)原子光谱量子力学理论 玻尔模型观察与实验所获得的事实建
立
科
学
模
型
提
出
科
学
假
说拓展与提高怎样修改玻尔模型?思想:必须彻底放弃经典概念?关键:用电子云概念取代经典的轨道概念电子在某处单位体积内出现的概率——电子云原子结构的认识史19学以致用卢瑟福的核式结构学说与经典电磁理论的矛盾(一)原子是稳定的电子绕核运动将不断向外辐射电磁波,电子损失了能量,其轨道半径不断缩小,最终落在原子核上,而使原子变得不稳定.经典理论认为事实卢瑟福的核式结构学说与经典电磁理论的矛盾(二)由于电子轨道的变化是连续的,辐射电磁波的频率等于绕核运动的频率,连续变化,原子光谱应该是连续光谱经典理论认为事实原子光谱是不连续的线状谱通过本节的学习能解释霓虹灯的发光吗?若大量氢原子处于主量子数 的激发态,会辐射几种频率的光;在哪两个能级之间跃迁?最短波长光的频率是多少?n5其中波长最短的光是[例1]24练习:对玻尔理论的下列说法中,正确的是( )
A、继承了卢瑟福的原子模型,但对原子能量和电子轨道引入了量子化假设
B、对经典电磁理论中关于“做加速运动的电荷要辐射电磁波”的观点表示赞同
C、用能量转化与守恒建立了原子发光频率与原子能量变化之间的定量关系
D、玻尔的两个公式是在他的理论基础上利用经典电磁理论和牛顿力学计算出来的ACD学以致用2、下面关于玻尔理论的解释中,不正确的说法是( )
A、原子只能处于一系列不连续的状态中,每个状态都对应一定的能量
B、原子中,虽然核外电子不断做加速运动,但只要能量状态不改变,就不会向外辐射能量
C、原子从一种定态跃迁到另一种定态时,一定要辐射一定频率的光子
D、原子的每一个能量状态都对应一个电子轨道,并且这些轨道是不连续的C3、根据玻尔理论,氢原子中,量子数N越大,则下列说法中正确的是( )
A、电子轨道半径越大 B、核外电子的速率越大
C、氢原子能级的能量越大 D、核外电子的电势能越大4、根据玻尔的原子理论,原子中电子绕核运动的半径( )
A、可以取任意值 B、可以在某一范围内取任意值
C、可以取一系列不连续的任意值
D、是一系列不连续的特定值DACD5、按照玻尔理论,一个氢原子中的电子从一半径为ra的圆轨道自发地直接跃迁到一半径为rb的圆轨道上,已知ra>rb,则在此过程中( )
A、原子要发出一系列频率的光子
B、原子要吸收一系列频率的光子
C、原子要发出某一频率的光子
D、原子要吸收某一频率的光子C6.氢原子的能级图如右图所示,欲使一处于基态的氢原子释放出一个电子而变成氢离子,氢原子需要吸收的能量至少是:
A.13.60ev B.10.20ev
C.0.54ev D.27.0evA附加知识探究二名师精讲1.原子的能量及变化规律
(1)原子中的能量:En=Ekn+Epn。
(3)当电子的轨道半径增大时,库仑引力做负功,原子的电势能增大,反之电势能减小。电子在可能的轨道上绕核运动时,r增大,则Ek减小,Ep增大,E增大;反之,r减小,则Ek增大,Ep减小,E减小,与卫星绕地球运行相似。探究二2.典例剖析探究二典例剖析探究二名师精讲3.能级图的理解
(1)能级图中n称为量子数,E1代表氢原子的基态能量,即量子数n=1时对应的能量,其值为-13.6 eV。En代表电子在第n个轨道上运动时的能量。
(2)作能级图时,能级横线间的距离和相应的能级差相对应,能级差越大,间隔越宽,所以量子数越大,能级越密,竖直线的箭头表示原子跃迁方向,长度表示辐射光子能量的大小,n=1是原子的基态,n→∞是原子电离时对应的状态。
4.能级跃迁
处于激发态的原子是不稳定的,它会自发地向较低能级跃迁,经过一次或几次跃迁到达基态。所以一群氢原子处于量子数为n的激发态时,可能辐射出的光谱线条数为探究二名师精讲5.光子的发射
原子由高能级向低能级跃迁时以光子的形式放出能量,发射光子的频率由下式决定。
hν=Em-En(Em、En是始末两个能级且m>n)
能级差越大,放出光子的频率就越高。
6.使原子能级跃迁的两种粒子——光子与实物粒子
(1)原子若是吸收光子的能量而被激发,其光子的能量必须等于两能级的能量差,否则不被吸收,不存在激发到n能级时能量有余,而激发到n+1时能量不足,则可激发到n能级的问题。
(2)原子还可吸收外来实物粒子(例如,自由电子)的能量而被激发,由于实物粒子的动能可部分地被原子吸收,所以只要入射粒子的能量大于两能级的能量差值(E=En-Ek),就可使原子发生能级跃迁。
