人教版高中化学选修4第1章第2节燃烧热 能源课件共48张PPT
文档属性
| 名称 | 人教版高中化学选修4第1章第2节燃烧热 能源课件共48张PPT |

|
|
| 格式 | zip | ||
| 文件大小 | 778.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-15 00:00:00 | ||
图片预览









文档简介
课件48张PPT。第二节 燃烧热 能源 由于反应的情况不同,反应热可分为燃烧热、中和热等,其中以燃烧热的实际应用最广泛。 思考 ? 我们知道物质燃烧都会放出热量,那么是不是物质燃烧放出的热量就叫燃烧热呢?实验测得在25℃、101kPa时,1molCH4完全燃烧放出890.31kJ的热量。CH4(g)+2O2 (g) =CO2 (g) +2H2O (l) ΔH= - 890.31kJ/mol 写出上面的热化学方程式一.燃烧热 在25℃、101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量。 单位为kJ/mol 研究的条件燃烧物的量反应程度反应程度C -- CO2 (g)
S – SO2 (g)
H– H2O(l)燃烧热通常可利用仪器由实验测得。①燃烧热为放出热量,△H<0。(在叙述时用正值描述)
H2(g)+ ?O2(g)=H2O(l) ?H =- 285.8kJ/mol ②燃烧热规定了可燃物的物质的量为1mol.H2的燃烧热为285.8kJ/mol,
表示在101kPa时,1molH2完全燃烧放出285.8kJ的热量 表示为:△H =-285.8kJ/mol
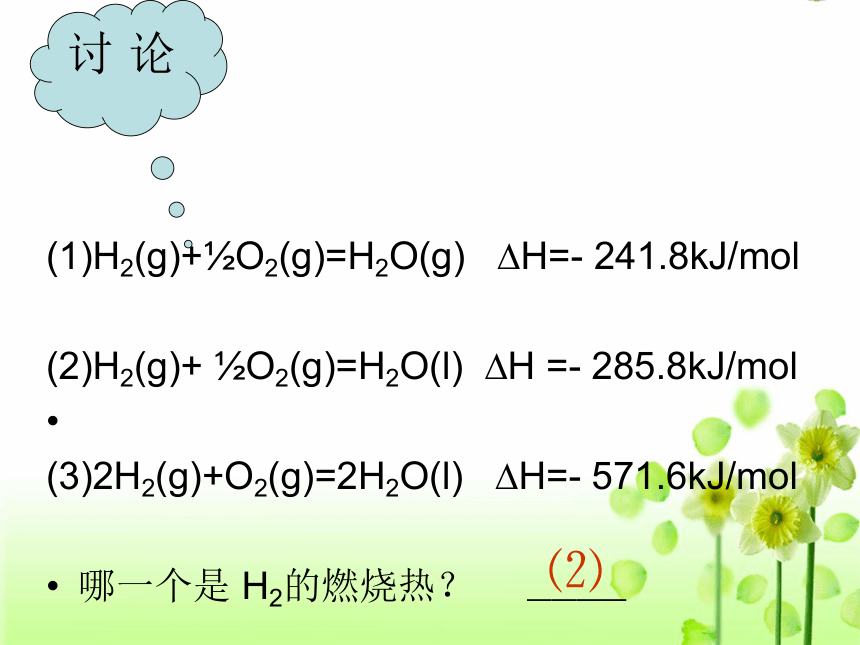
(1)H2(g)+?O2(g)=H2O(g) ?H=- 241.8kJ/mol
(2)H2(g)+ ?O2(g)=H2O(l) ?H =- 285.8kJ/mol
(3)2H2(g)+O2(g)=2H2O(l) ?H=- 571.6kJ/mol
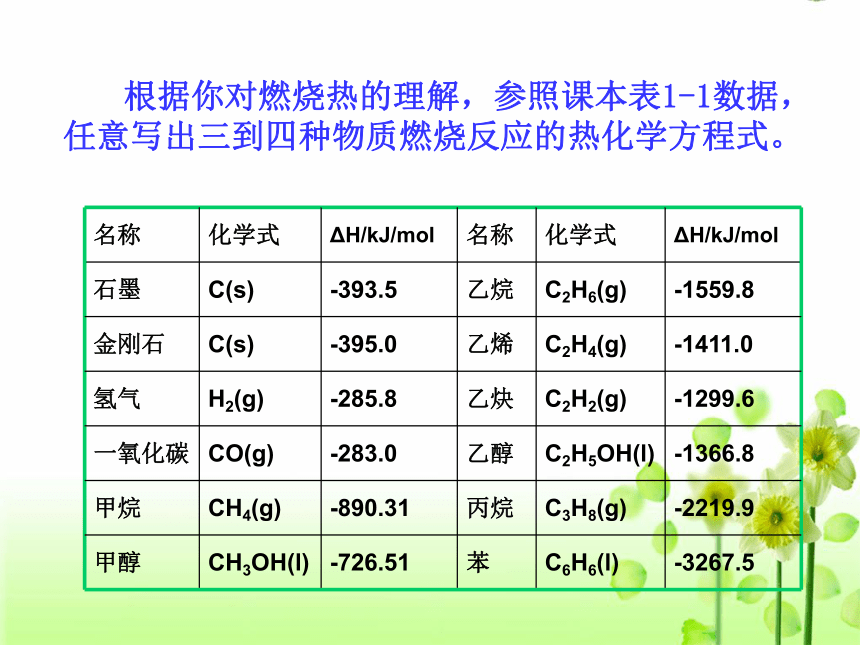
哪一个是 H2的燃烧热? ————讨 论⑵ 根据你对燃烧热的理解,参照课本表1-1数据,任意写出三到四种物质燃烧反应的热化学方程式。二、燃烧热的计算及应用
【练习2】
已知:
2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l) △H=一11036kJ/mol
C8H18的燃烧热是多少? △H=-5518kJ/mol【练习1】
H2的燃烧热为285.8 kJ / mol所表示的含义是?
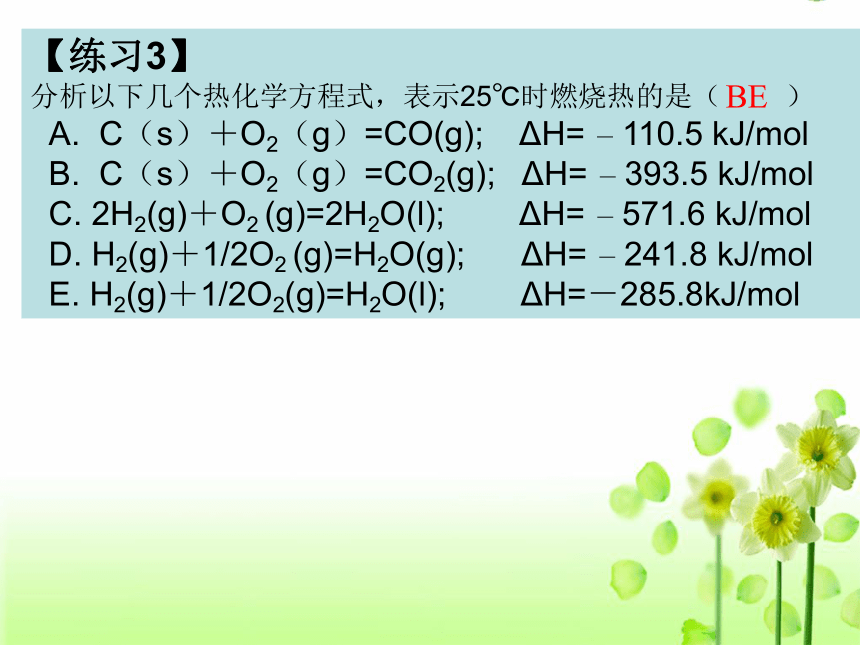
【练习3】
分析以下几个热化学方程式,表示25℃时燃烧热的是( )
A. C(s)+O2(g)=CO(g); ΔH= - 110.5 kJ/mol
B. C(s)+O2(g)=CO2(g); ΔH= - 393.5 kJ/mol
C. 2H2(g)+O2 (g)=2H2O(l); ΔH= - 571.6 kJ/mol
D. H2(g)+1/2O2 (g)=H2O(g); ΔH= - 241.8 kJ/mol
E. H2(g)+1/2O2(g)=H2O(l); ΔH=-285.8kJ/molBE【练习4】已知下列两个热化学方程式: 2H2(g)+O2(g) =2H2O(l) △H=-571.6 kJ?mol-1
C3H8(g)+5O2(g) =3CO2(g)+4 H2O(l) △H=-2 220 kJ?mol-1
(1)H2的燃烧热为____________,C3H8的燃烧热为____________
(2)2gH2和2mol C3H8组成的混合气体完全燃烧放出的热量为____________ 285.8 kJ?mol-1 2 220 kJ?mol-1 4725.8 kJ
中和反应 反应热的测定
在稀溶液中,酸和碱发生中和反应而生成1mol水时放出的热。
研究条件:稀溶液
反应物:酸与碱
生成物及其物质的量:1mol
放出的热:57.3kJ/mol注:强酸与弱碱反应,强碱与弱酸、弱酸和弱碱反应生成1molH2O放出的热小于57.3KJ/mol 中和热:●实验目的
测定强酸与强碱反应的反应热●学习重点
中和反应反应热的测定原理和方法。●实验用品
大烧杯(500 mL)、小烧杯(100 mL)
温度计、量筒(50 mL)两个、泡沫塑料 或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。
0.50 mol/L 盐酸、0.55 mol/L NaOH溶液
实验原理:
Q=mcΔt ①
Q:中和反应放出的热量。
m:反应混合液的质量。
c:反应混合液的比热容。
Δt:反应前后溶液温度的差值。
Q=(V酸ρ酸+V碱ρ碱)·c·(t2-t1)②
V酸=V碱=50 mL。
c酸=0.50 mol/L c碱=0.55 mol/L
ρ酸=ρ碱=1 g/cm3
c=4.18 J/(g·℃)
Q=0.418(t2-t1)kJ ③
计算反应热需测定哪些数据?在实验中怎样准确测定这些数据?反应热的测定自制简易量热计如何求算一个体系放出或吸收的热量呢?
Q= - C(T2 -T1)=- C0m(T2-T1)
C—热容,当物质吸收热量温度升高时,温度每升高1K所吸收的热量,称为该物质的热容;
C0—比热容,单位质量物质的热容;
T—热力学温度,也叫开尔文温度,单位为K T(K )=t(℃)+273.15.[问题]1.我们利用什么原理来测定酸、碱反应的反应热(也称中和热)呢?
2.中和热与反应热是否相同?它们之间有什么区别和联系? 不同;它们都是指化学反应放出的能量,但中和热仅指在稀溶液中,酸跟碱发生中和反应而生成1 mol水时的反应热。任何一个化学反应发生所放出的热量都叫反应热,但却不一定是中和热。[问题]3.酸、碱反应时,我们用的是它的稀溶液,它们的质量应怎样得到?量出它们的体积,再乘以它们的密度即可。 实验步骤:1.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,如下图所示。 中和热的测定
大、小烧杯放置时,为何要使两杯口相平?填碎纸条的作用是什么?对此装置,你有何更好的建议?答案:.两杯口相平,可使盖板把杯口尽量盖严,从而减少热量损失;填碎纸条的作用是为了达到保温隔热、减少实验过程中热量损失的目的。若换用隔热、密封性能更好的装置(如保温杯)会使实验结果更准确。2.用一个量筒最取50 mL 0.50 mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。然后把温度计上的酸用水冲洗干净。 温度计上的酸为何要用水冲洗干净?冲洗后的溶液能否倒入小烧杯?为什么? 因为该温度计还要用来测碱液的温度,若不冲洗,温度计上的酸会和碱发生中和反应而使热量散失,故要冲洗干净;冲洗后的溶液不能倒入小烧杯,若倒入,会使总溶液的质量增加,而导致实验结果误差。3.用另一个量筒量取50 mL 0.55 mol/L NaOH溶液,并用温度计测量NaOH溶液的温度,记入下表。.酸、碱混合时,为何要把量筒中的NaOH溶液一次倒入小烧杯而不能缓缓倒入?. 因为本实验的关键是测反应的反应热,若动作迟缓,将会使热量损失而使误差增大。4.把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒到外面)。用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入下表。 实验中所用HCl和NaOH的物质的量比为何不是1∶1而是NaOH过量?若用HCl过量行吗? 为了保证0.50 mol/L的盐酸完全被NaOH中和,采用0.55 mol/L NaOH溶液,使碱稍稍过量。若使盐酸过量,亦可。5.重复实验两次,取测量所得数据的平均值作为计算依据。 [议一议]你所测得的数据是否为57.3 kJ/mol,若不是,分析产生误差的原因。可能的原因有:
1.量取溶液的体积有误差(测量结果是按50 mL的酸、碱进行计算,若实际量取时,多于50 mL或小于50 mL都会造成误差)
2.温度计的读数有误。
3.实验过程中有液体洒在外面。
4.混合酸、碱溶液时,动作缓慢,导致实验误差。
5.隔热操作不到位,致使实验过程中热量损失而导致误差。
6.测了酸后的温度计未用水清洗而便立即去测碱的温度,致使热量损失而引起误差。 讨论下列问题 1.本实验中若把50 mL 0.50 mol/L的盐酸改为50 mL 0.50 mol/L醋酸,所测结果是否会有所变化?为什么?
2.若改用100 mL 0.50 mol/L的盐酸和100 mL 0.55 mol/L的NaOH溶液,所测中和热的数值是否约为本实验结果的二倍(假定各步操作没有失误)?答案:1.会有所变化。因为醋酸为弱电解质,其电离时要吸热,故将使测得结果偏小。
2.否。因中和热是指酸与碱发生中和反应生成1 mol H2O时放出的热量,其数值与反应物的量的多少无关,故所测结果应基本和本次实验结果相同(若所有操作都准确无误,且无热量损失,则二者结果相同)。[练习]50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L 的NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少
的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
环形玻璃搅拌棒减少实验过程中的热量损失偏小(4)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”),简述理由: 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50 mL 0.50mol/L NaOH溶液进行上述实验,测得的中和热的数值会 。(均填“偏大”“偏小”“无影响”)不相等相等 因为中和热是指酸跟碱发生中和反应生成1 mol H2O所放出的能量,与酸碱的用量无关偏小偏小 燃烧热和中和热的区别与联系 【练习4】? 在 101 kPa时,1mol CH4 完全燃烧生成CO2和液态H2O,放出 890 kJ的热量,CH4 的燃烧热为多少?1000 L CH4(标准状况)燃烧后所产生的热量为多少?【解】根据题意,在 101 kPa时,1mol CH4 完全燃烧的热化学方程式为:
CH4(g)+2O2(g)= CO2(g)+ 2H2O(l) ΔH=-890 kJ/mol
即CH4的燃烧热为 890 kJ/mol。
1000 L CH4 (标准状况)的物质的量为:
n(CH4)=V(CH4)/Vm=1000L/22.4L·mol-1 = 44.6mol
1mol CH4 完全燃烧放出890kJ的热量,44.6 molCH4 完全燃烧放出的热量为:
44.6 mol×890 kJ/mol=3.97×104kJ
答:CH4的燃烧热为 890 kJ/mol,1000 L CH4(标准状况)完全燃烧产生的热量为 3.97×104kJ。【练习5】已知下列两个热化学方程式;
H2(g)+O2 (g)===H2O(1); △H=-285.kJ/mol
C3H8(g)+5O2 (g)===3CO2 (g)+4H2O(1); △H=-2220.0kJ/mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3H8的体积比是 。
(2)已知:H2O(1)=H2O(g);△H=+44.0kJ/mol,写出丙烷燃烧生成CO2和气态水的热化学方程式。 1:1 C3H8(g)+5O2(g)===3CO2 (g)+4H2O(g)△H=-2044.0kJ/mol 反应热与参加反应的物质的物质的量成正比,因而可以采用平均值法和十字交差法来计算。要注意一些常见题型的特殊解题方法,从理论上去理解。
平均每摩尔气体燃烧放热=1252.5kJ
H2 : 285.8
1252.5
C3H8: 2220
n(H2 ):n(C3H8) ==== 967.5: 967.5 =1:1
967.5967.5【练习6】? 葡萄糖是人体所需能量的重要来源之一。葡萄糖燃烧的热化学方程式为: C6H12O6(s)+6O2(g)= 6CO2(g)+6H2O(l) ΔH=-2 800 kJ/mol 葡萄糖在人体组织中氧化的热化学方程式与它燃烧的热化学方程式相同。计算 100 g葡萄糖在人体中完全氧化时所产生的热量。 解:根据题意,葡萄糖的燃烧热为2800kJ/mol。
100 g葡萄糖的物质的量为:
n(C6H12O6)= m(C6H12O6 )/M(C6H12O6 )
=100g/180g·mol-1=0.556mol
1mol C6H12O6完全燃烧放出2800 kJ的热量,0.556 mol C6H12O6完全燃烧放出的热量为:
0.556 mol×2800 kJ/mol=1560 kJ
答:100g葡萄糖在人体中完全氧化时产生1560 kJ的热量。【练习7】 10g硫磺在O2中完全燃烧生成气态SO2,放出的热量能量使500g H2O温度由18℃升至62.4℃,则硫磺的燃烧热为 ,热化学方程式?为 ??。 ???????????????????? 解:10g硫磺燃烧共放出热量为:
则1mol(32g)硫磺燃烧放热为 ; ?热化学方程式为: ; ?【练习8】在36g碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且已知:
C(g)+1/2O2 = CO(g) ΔH=-110.5kJ/mol;
CO(g)+1/2O2(g)= CO2(g) ΔH=-283kJ/mol. 与这些碳完全燃烧相比,损失的热量是( )
A.172.5kJ B.1149kJ C.283kJ D.517.5kJ C【练习9】根据热化学方程式:
S(s)+O2(g)=SO2(g)△H=-297.23kJ/mol,分析下列说法中错误的是
A.S的燃烧热为297.23kJ/mol
B.S(g)+O2(g)=SO2(g);△H=-Q kJ/mol.Q的值大于297.23kJ/mol
C.S(g)+O2(g)=SO2(g);△H=-Q kJ/mol。Q的值小于297.23kJ/mol D.1molSO2的键能总和大于1molS和1molO2的键能和 C【练习10】已知热化学方程式:
2H2(g)+O2(g)=2H2O(g) ΔH1=-483.6kJ/mol,
则对于热化学方程式:2H2O(l)=2H2(g)+O2(g) ΔH2=b, 下列说法正确的是 A.该反应的ΔH2=+483.6kJ/mol B.|ΔH2|<|ΔH1| C.|ΔH2|>|ΔH1| D.热化学方程式中化学计量数表示分子个数 C【练习11】下列说法正确的是 A.任何化学反应都伴随着能量的变化 B.0.5molH2SO4和0.5molBa(OH)2完全反应所放出 的热量称为中和热 C.在101kPa时,1mol碳燃烧放出的热量就是碳的燃烧热 D.在化学反应中需要加热的反应就是吸热反应 A【练习12】.已知反应:
① 101 kPa时 2C(s)+ O2(g)===2CO(g) ΔH=-221 kJ?mol-1
②稀溶液中,H+(aq)+OH-(aq)==H2O(l) ΔH=-57.3 kJ?mol-1 下列结论正确的是( )
A、碳的燃烧热大于110.5 kJ?mol-1
B、 ①的反应热为221 kJ?mol-1
C、 HCl和NaOH反应的中和热ΔH=-57.3 kJ?mol-1 ,则 H2SO4和 Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ?mol-1
D、稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 A【练习13】.已知下列两个热化学方程式:
C(s)+O2(g) = CO2(g)? ΔH=-393.5 kJ·mol-1
2H2(g)+O2(g) = 2H2O(g)? ΔH=-483.6 kJ·mol-1
现有0.2 mol碳粉和氢气组成的悬浮气体,在氧气中完全燃烧,共放出63.53 kJ的热量。则碳与氢气的物质的量之比是(??? )
A.1∶1????????????? B.1∶2 ????????????C.2∶3????????????? D.3∶2A思考与交流 应根据什么标准来选择燃料?物质的燃烧热 燃料的储量 燃料的开采、运输 燃料储存的条件、价格 燃料对生态环境的影响 例:丙烷燃烧热值高石油中储量丰富开采容易燃烧时污染小储存、运输不方便能
源 化石燃料——煤、石油、天然气阳光风力流水潮汐柴草……能提供能量的资源蕴藏量有限
不能再生
污染严重开
源
节
流开发新能源节约现有能源提高能源利用率太阳能 氢能
风能 地热能
海洋能 生物质能资源丰富
可以再生
污染少燃料的充分燃烧能源的分类①一级能源与二级能源
一级能源:从自然界直接取得的能源,如:煤、石油、天然气等;
二级能源:一级能源经过加工转化后得到的能源,如:煤气、电力、沼气、 氢能等
②可再生能源与非可再生能源
可再生能源:可连续再生,永久利用的一级能源,如:水能、风能等;
非可再生能源:经过亿万年形成,短期内无法恢复的能源,如:石油、煤、 天然气等。
③常规能源与新能源
常规能源:已被广泛利用的能源,如:煤、天然气、水能等;
新能源:才刚开始被人类采用先进的方法加以利用的能源以及新发展的利用先进技术获得的能源,如:核聚变能、海洋能、太阳能等。
太阳能温泉 (﹥35℃-﹤45℃) 西藏地区众多。特殊的有温泉瀑布,如昌都沙拉温泉瀑布,该处海拔3400米。水温37.5℃,流量17.4升/秒,落差8米。 热泉(﹥45℃-低于沸点) 西藏地区热泉众多。如那曲地那水热区,泉区海拔4750米。主泉口水温79.5℃。流量3.54升/秒。 地热能沸泉(大于当地沸点,由于西藏为高海拔地区,一般沸点为85-88℃)。如突多水热区(如左图),沸泉水温88℃,泉区位于河心滩上,周围白色者为地热流体沉淀的层状钙华(如右图)。巴尔沸喷泉,在噶尔县嘎尔河山谷左侧岩壁下的河漫滩上,竖立着高约1.2m的钙质泉华锥,锥的底部面河一侧一股高温汽水柱以60度的倾角伴随着持续不断的哼吼声越过河床,喷向河对岸的山坡上(图1)。水柱从直径不是5cm的泉口喷出,向上扩容为15cm的汽水柱。汽水柱喷高可达15cm,射程在20m以上,蔚为壮观。这是我国迄今为止发现的最大的沸喷泉,照片为2000年冬拍摄,受风力影响水柱喷向不断变形,向左岸喷,在岩壁上结冰(图2),当喷向右岸,风力极大时水汽散开,形成很漂亮的“冰帘”(图3) 风能的利用荷兰——风车之国【练习】
1、下列属于一次能源的是( ),属于二次能源的是( )
A D EB C2、为了减少大气污染,许多城市正大力推广汽车清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料的主要成分均为 ( ) AA.碳氢化合物 B.碳水化合物 C.氢气 D.醇类A 风能 B 电能 C 氢能 D 阳光 E 天然气3.“能源分类相关图”如下图所示,四组能源选项中全部符合图中阴影部分的能源是( ) ??????????????
A.煤炭、石油、潮汐能 B.水能、生物能、天然气
C.太阳能、风能、沼气 D.地热能、海洋能、核能C
S – SO2 (g)
H– H2O(l)燃烧热通常可利用仪器由实验测得。①燃烧热为放出热量,△H<0。(在叙述时用正值描述)
H2(g)+ ?O2(g)=H2O(l) ?H =- 285.8kJ/mol ②燃烧热规定了可燃物的物质的量为1mol.H2的燃烧热为285.8kJ/mol,
表示在101kPa时,1molH2完全燃烧放出285.8kJ的热量 表示为:△H =-285.8kJ/mol
(1)H2(g)+?O2(g)=H2O(g) ?H=- 241.8kJ/mol
(2)H2(g)+ ?O2(g)=H2O(l) ?H =- 285.8kJ/mol
(3)2H2(g)+O2(g)=2H2O(l) ?H=- 571.6kJ/mol
哪一个是 H2的燃烧热? ————讨 论⑵ 根据你对燃烧热的理解,参照课本表1-1数据,任意写出三到四种物质燃烧反应的热化学方程式。二、燃烧热的计算及应用
【练习2】
已知:
2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l) △H=一11036kJ/mol
C8H18的燃烧热是多少? △H=-5518kJ/mol【练习1】
H2的燃烧热为285.8 kJ / mol所表示的含义是?
【练习3】
分析以下几个热化学方程式,表示25℃时燃烧热的是( )
A. C(s)+O2(g)=CO(g); ΔH= - 110.5 kJ/mol
B. C(s)+O2(g)=CO2(g); ΔH= - 393.5 kJ/mol
C. 2H2(g)+O2 (g)=2H2O(l); ΔH= - 571.6 kJ/mol
D. H2(g)+1/2O2 (g)=H2O(g); ΔH= - 241.8 kJ/mol
E. H2(g)+1/2O2(g)=H2O(l); ΔH=-285.8kJ/molBE【练习4】已知下列两个热化学方程式: 2H2(g)+O2(g) =2H2O(l) △H=-571.6 kJ?mol-1
C3H8(g)+5O2(g) =3CO2(g)+4 H2O(l) △H=-2 220 kJ?mol-1
(1)H2的燃烧热为____________,C3H8的燃烧热为____________
(2)2gH2和2mol C3H8组成的混合气体完全燃烧放出的热量为____________ 285.8 kJ?mol-1 2 220 kJ?mol-1 4725.8 kJ
中和反应 反应热的测定
在稀溶液中,酸和碱发生中和反应而生成1mol水时放出的热。
研究条件:稀溶液
反应物:酸与碱
生成物及其物质的量:1mol
放出的热:57.3kJ/mol注:强酸与弱碱反应,强碱与弱酸、弱酸和弱碱反应生成1molH2O放出的热小于57.3KJ/mol 中和热:●实验目的
测定强酸与强碱反应的反应热●学习重点
中和反应反应热的测定原理和方法。●实验用品
大烧杯(500 mL)、小烧杯(100 mL)
温度计、量筒(50 mL)两个、泡沫塑料 或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。
0.50 mol/L 盐酸、0.55 mol/L NaOH溶液
实验原理:
Q=mcΔt ①
Q:中和反应放出的热量。
m:反应混合液的质量。
c:反应混合液的比热容。
Δt:反应前后溶液温度的差值。
Q=(V酸ρ酸+V碱ρ碱)·c·(t2-t1)②
V酸=V碱=50 mL。
c酸=0.50 mol/L c碱=0.55 mol/L
ρ酸=ρ碱=1 g/cm3
c=4.18 J/(g·℃)
Q=0.418(t2-t1)kJ ③
计算反应热需测定哪些数据?在实验中怎样准确测定这些数据?反应热的测定自制简易量热计如何求算一个体系放出或吸收的热量呢?
Q= - C(T2 -T1)=- C0m(T2-T1)
C—热容,当物质吸收热量温度升高时,温度每升高1K所吸收的热量,称为该物质的热容;
C0—比热容,单位质量物质的热容;
T—热力学温度,也叫开尔文温度,单位为K T(K )=t(℃)+273.15.[问题]1.我们利用什么原理来测定酸、碱反应的反应热(也称中和热)呢?
2.中和热与反应热是否相同?它们之间有什么区别和联系? 不同;它们都是指化学反应放出的能量,但中和热仅指在稀溶液中,酸跟碱发生中和反应而生成1 mol水时的反应热。任何一个化学反应发生所放出的热量都叫反应热,但却不一定是中和热。[问题]3.酸、碱反应时,我们用的是它的稀溶液,它们的质量应怎样得到?量出它们的体积,再乘以它们的密度即可。 实验步骤:1.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,如下图所示。 中和热的测定
大、小烧杯放置时,为何要使两杯口相平?填碎纸条的作用是什么?对此装置,你有何更好的建议?答案:.两杯口相平,可使盖板把杯口尽量盖严,从而减少热量损失;填碎纸条的作用是为了达到保温隔热、减少实验过程中热量损失的目的。若换用隔热、密封性能更好的装置(如保温杯)会使实验结果更准确。2.用一个量筒最取50 mL 0.50 mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。然后把温度计上的酸用水冲洗干净。 温度计上的酸为何要用水冲洗干净?冲洗后的溶液能否倒入小烧杯?为什么? 因为该温度计还要用来测碱液的温度,若不冲洗,温度计上的酸会和碱发生中和反应而使热量散失,故要冲洗干净;冲洗后的溶液不能倒入小烧杯,若倒入,会使总溶液的质量增加,而导致实验结果误差。3.用另一个量筒量取50 mL 0.55 mol/L NaOH溶液,并用温度计测量NaOH溶液的温度,记入下表。.酸、碱混合时,为何要把量筒中的NaOH溶液一次倒入小烧杯而不能缓缓倒入?. 因为本实验的关键是测反应的反应热,若动作迟缓,将会使热量损失而使误差增大。4.把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒到外面)。用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入下表。 实验中所用HCl和NaOH的物质的量比为何不是1∶1而是NaOH过量?若用HCl过量行吗? 为了保证0.50 mol/L的盐酸完全被NaOH中和,采用0.55 mol/L NaOH溶液,使碱稍稍过量。若使盐酸过量,亦可。5.重复实验两次,取测量所得数据的平均值作为计算依据。 [议一议]你所测得的数据是否为57.3 kJ/mol,若不是,分析产生误差的原因。可能的原因有:
1.量取溶液的体积有误差(测量结果是按50 mL的酸、碱进行计算,若实际量取时,多于50 mL或小于50 mL都会造成误差)
2.温度计的读数有误。
3.实验过程中有液体洒在外面。
4.混合酸、碱溶液时,动作缓慢,导致实验误差。
5.隔热操作不到位,致使实验过程中热量损失而导致误差。
6.测了酸后的温度计未用水清洗而便立即去测碱的温度,致使热量损失而引起误差。 讨论下列问题 1.本实验中若把50 mL 0.50 mol/L的盐酸改为50 mL 0.50 mol/L醋酸,所测结果是否会有所变化?为什么?
2.若改用100 mL 0.50 mol/L的盐酸和100 mL 0.55 mol/L的NaOH溶液,所测中和热的数值是否约为本实验结果的二倍(假定各步操作没有失误)?答案:1.会有所变化。因为醋酸为弱电解质,其电离时要吸热,故将使测得结果偏小。
2.否。因中和热是指酸与碱发生中和反应生成1 mol H2O时放出的热量,其数值与反应物的量的多少无关,故所测结果应基本和本次实验结果相同(若所有操作都准确无误,且无热量损失,则二者结果相同)。[练习]50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L 的NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少
的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
环形玻璃搅拌棒减少实验过程中的热量损失偏小(4)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”),简述理由: 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50 mL 0.50mol/L NaOH溶液进行上述实验,测得的中和热的数值会 。(均填“偏大”“偏小”“无影响”)不相等相等 因为中和热是指酸跟碱发生中和反应生成1 mol H2O所放出的能量,与酸碱的用量无关偏小偏小 燃烧热和中和热的区别与联系 【练习4】? 在 101 kPa时,1mol CH4 完全燃烧生成CO2和液态H2O,放出 890 kJ的热量,CH4 的燃烧热为多少?1000 L CH4(标准状况)燃烧后所产生的热量为多少?【解】根据题意,在 101 kPa时,1mol CH4 完全燃烧的热化学方程式为:
CH4(g)+2O2(g)= CO2(g)+ 2H2O(l) ΔH=-890 kJ/mol
即CH4的燃烧热为 890 kJ/mol。
1000 L CH4 (标准状况)的物质的量为:
n(CH4)=V(CH4)/Vm=1000L/22.4L·mol-1 = 44.6mol
1mol CH4 完全燃烧放出890kJ的热量,44.6 molCH4 完全燃烧放出的热量为:
44.6 mol×890 kJ/mol=3.97×104kJ
答:CH4的燃烧热为 890 kJ/mol,1000 L CH4(标准状况)完全燃烧产生的热量为 3.97×104kJ。【练习5】已知下列两个热化学方程式;
H2(g)+O2 (g)===H2O(1); △H=-285.kJ/mol
C3H8(g)+5O2 (g)===3CO2 (g)+4H2O(1); △H=-2220.0kJ/mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3H8的体积比是 。
(2)已知:H2O(1)=H2O(g);△H=+44.0kJ/mol,写出丙烷燃烧生成CO2和气态水的热化学方程式。 1:1 C3H8(g)+5O2(g)===3CO2 (g)+4H2O(g)△H=-2044.0kJ/mol 反应热与参加反应的物质的物质的量成正比,因而可以采用平均值法和十字交差法来计算。要注意一些常见题型的特殊解题方法,从理论上去理解。
平均每摩尔气体燃烧放热=1252.5kJ
H2 : 285.8
1252.5
C3H8: 2220
n(H2 ):n(C3H8) ==== 967.5: 967.5 =1:1
967.5967.5【练习6】? 葡萄糖是人体所需能量的重要来源之一。葡萄糖燃烧的热化学方程式为: C6H12O6(s)+6O2(g)= 6CO2(g)+6H2O(l) ΔH=-2 800 kJ/mol 葡萄糖在人体组织中氧化的热化学方程式与它燃烧的热化学方程式相同。计算 100 g葡萄糖在人体中完全氧化时所产生的热量。 解:根据题意,葡萄糖的燃烧热为2800kJ/mol。
100 g葡萄糖的物质的量为:
n(C6H12O6)= m(C6H12O6 )/M(C6H12O6 )
=100g/180g·mol-1=0.556mol
1mol C6H12O6完全燃烧放出2800 kJ的热量,0.556 mol C6H12O6完全燃烧放出的热量为:
0.556 mol×2800 kJ/mol=1560 kJ
答:100g葡萄糖在人体中完全氧化时产生1560 kJ的热量。【练习7】 10g硫磺在O2中完全燃烧生成气态SO2,放出的热量能量使500g H2O温度由18℃升至62.4℃,则硫磺的燃烧热为 ,热化学方程式?为 ??。 ???????????????????? 解:10g硫磺燃烧共放出热量为:
则1mol(32g)硫磺燃烧放热为 ; ?热化学方程式为: ; ?【练习8】在36g碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且已知:
C(g)+1/2O2 = CO(g) ΔH=-110.5kJ/mol;
CO(g)+1/2O2(g)= CO2(g) ΔH=-283kJ/mol. 与这些碳完全燃烧相比,损失的热量是( )
A.172.5kJ B.1149kJ C.283kJ D.517.5kJ C【练习9】根据热化学方程式:
S(s)+O2(g)=SO2(g)△H=-297.23kJ/mol,分析下列说法中错误的是
A.S的燃烧热为297.23kJ/mol
B.S(g)+O2(g)=SO2(g);△H=-Q kJ/mol.Q的值大于297.23kJ/mol
C.S(g)+O2(g)=SO2(g);△H=-Q kJ/mol。Q的值小于297.23kJ/mol D.1molSO2的键能总和大于1molS和1molO2的键能和 C【练习10】已知热化学方程式:
2H2(g)+O2(g)=2H2O(g) ΔH1=-483.6kJ/mol,
则对于热化学方程式:2H2O(l)=2H2(g)+O2(g) ΔH2=b, 下列说法正确的是 A.该反应的ΔH2=+483.6kJ/mol B.|ΔH2|<|ΔH1| C.|ΔH2|>|ΔH1| D.热化学方程式中化学计量数表示分子个数 C【练习11】下列说法正确的是 A.任何化学反应都伴随着能量的变化 B.0.5molH2SO4和0.5molBa(OH)2完全反应所放出 的热量称为中和热 C.在101kPa时,1mol碳燃烧放出的热量就是碳的燃烧热 D.在化学反应中需要加热的反应就是吸热反应 A【练习12】.已知反应:
① 101 kPa时 2C(s)+ O2(g)===2CO(g) ΔH=-221 kJ?mol-1
②稀溶液中,H+(aq)+OH-(aq)==H2O(l) ΔH=-57.3 kJ?mol-1 下列结论正确的是( )
A、碳的燃烧热大于110.5 kJ?mol-1
B、 ①的反应热为221 kJ?mol-1
C、 HCl和NaOH反应的中和热ΔH=-57.3 kJ?mol-1 ,则 H2SO4和 Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ?mol-1
D、稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 A【练习13】.已知下列两个热化学方程式:
C(s)+O2(g) = CO2(g)? ΔH=-393.5 kJ·mol-1
2H2(g)+O2(g) = 2H2O(g)? ΔH=-483.6 kJ·mol-1
现有0.2 mol碳粉和氢气组成的悬浮气体,在氧气中完全燃烧,共放出63.53 kJ的热量。则碳与氢气的物质的量之比是(??? )
A.1∶1????????????? B.1∶2 ????????????C.2∶3????????????? D.3∶2A思考与交流 应根据什么标准来选择燃料?物质的燃烧热 燃料的储量 燃料的开采、运输 燃料储存的条件、价格 燃料对生态环境的影响 例:丙烷燃烧热值高石油中储量丰富开采容易燃烧时污染小储存、运输不方便能
源 化石燃料——煤、石油、天然气阳光风力流水潮汐柴草……能提供能量的资源蕴藏量有限
不能再生
污染严重开
源
节
流开发新能源节约现有能源提高能源利用率太阳能 氢能
风能 地热能
海洋能 生物质能资源丰富
可以再生
污染少燃料的充分燃烧能源的分类①一级能源与二级能源
一级能源:从自然界直接取得的能源,如:煤、石油、天然气等;
二级能源:一级能源经过加工转化后得到的能源,如:煤气、电力、沼气、 氢能等
②可再生能源与非可再生能源
可再生能源:可连续再生,永久利用的一级能源,如:水能、风能等;
非可再生能源:经过亿万年形成,短期内无法恢复的能源,如:石油、煤、 天然气等。
③常规能源与新能源
常规能源:已被广泛利用的能源,如:煤、天然气、水能等;
新能源:才刚开始被人类采用先进的方法加以利用的能源以及新发展的利用先进技术获得的能源,如:核聚变能、海洋能、太阳能等。
太阳能温泉 (﹥35℃-﹤45℃) 西藏地区众多。特殊的有温泉瀑布,如昌都沙拉温泉瀑布,该处海拔3400米。水温37.5℃,流量17.4升/秒,落差8米。 热泉(﹥45℃-低于沸点) 西藏地区热泉众多。如那曲地那水热区,泉区海拔4750米。主泉口水温79.5℃。流量3.54升/秒。 地热能沸泉(大于当地沸点,由于西藏为高海拔地区,一般沸点为85-88℃)。如突多水热区(如左图),沸泉水温88℃,泉区位于河心滩上,周围白色者为地热流体沉淀的层状钙华(如右图)。巴尔沸喷泉,在噶尔县嘎尔河山谷左侧岩壁下的河漫滩上,竖立着高约1.2m的钙质泉华锥,锥的底部面河一侧一股高温汽水柱以60度的倾角伴随着持续不断的哼吼声越过河床,喷向河对岸的山坡上(图1)。水柱从直径不是5cm的泉口喷出,向上扩容为15cm的汽水柱。汽水柱喷高可达15cm,射程在20m以上,蔚为壮观。这是我国迄今为止发现的最大的沸喷泉,照片为2000年冬拍摄,受风力影响水柱喷向不断变形,向左岸喷,在岩壁上结冰(图2),当喷向右岸,风力极大时水汽散开,形成很漂亮的“冰帘”(图3) 风能的利用荷兰——风车之国【练习】
1、下列属于一次能源的是( ),属于二次能源的是( )
A D EB C2、为了减少大气污染,许多城市正大力推广汽车清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料的主要成分均为 ( ) AA.碳氢化合物 B.碳水化合物 C.氢气 D.醇类A 风能 B 电能 C 氢能 D 阳光 E 天然气3.“能源分类相关图”如下图所示,四组能源选项中全部符合图中阴影部分的能源是( ) ??????????????
A.煤炭、石油、潮汐能 B.水能、生物能、天然气
C.太阳能、风能、沼气 D.地热能、海洋能、核能C
