人教版高中化学选修4第1章第3节化学反应热的计算课件共64张PPT
文档属性
| 名称 | 人教版高中化学选修4第1章第3节化学反应热的计算课件共64张PPT |

|
|
| 格式 | zip | ||
| 文件大小 | 660.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-15 00:00:00 | ||
图片预览










文档简介
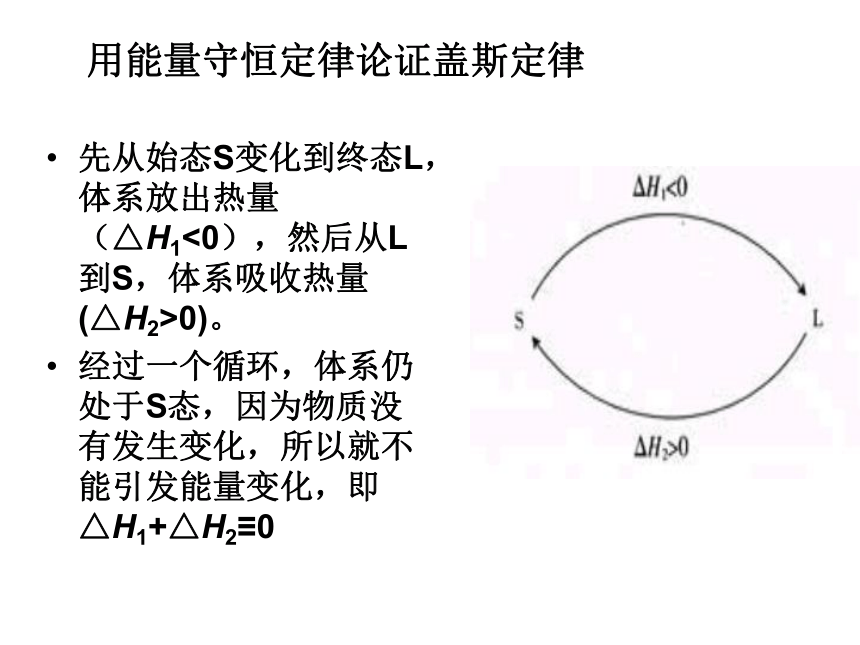
课件64张PPT。第三节 化学反应热的计算第一章 化学反应与能量一、盖斯定律换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。这就是盖斯定律。1840年,瑞士化学家盖斯(G.H.Hess)通过大量实验事实证明,不管化学反应是一步完成或分几步完成,其反应热是相同的。1.盖斯定律:不管化学反应是一步完成或分几步完成,其反应热是相同的。用能量守恒定律论证盖斯定律先从始态S变化到终态L,体系放出热量(△H1<0),然后从L到S,体系吸收热量(△H2>0)。
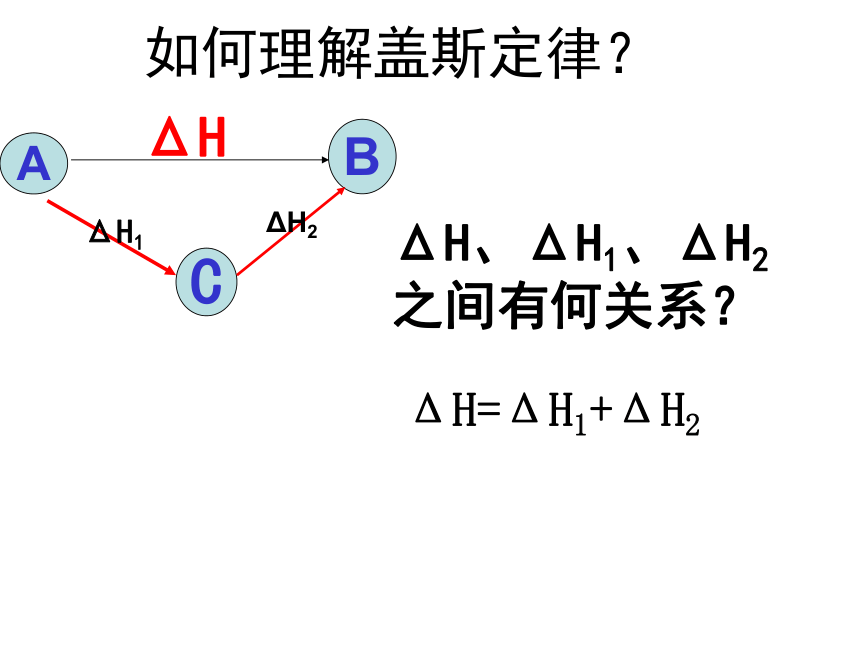
经过一个循环,体系仍处于S态,因为物质没有发生变化,所以就不能引发能量变化,即△H1+△H2≡0如何理解盖斯定律?ΔH、ΔH1、ΔH2
之间有何关系?ΔH=ΔH1+ΔH2BΔH二、盖斯定律的应用
盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热很难测得或无法直接测得,利用盖斯定律就可间接计算求得。如:碳燃烧生成CO,同素异形体的相互转化等。例如:C(s)+ ? O2(g)=CO(g)因为C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的ΔH无法直接测得,请同学们自己根据盖斯定律设计一个方案计算该反应的ΔH。
提示(1) C(s) + O2(g) = CO2(g)
△H1=-393.5 kJ/mol
(2) CO(g) + ?O2(g) = CO2(g)
△H3=-283.0 kJ/mol盖斯定律及其应用
△H1= △H2+ △H3
△H2 = △H1- △H3
= -393.5 kJ/mol -(-283.0 kJ/mol)
= -110.5 kJ/mol
C (s) + ? O2 (g) = CO (g) △H=-110.5 kJ/mol
盖斯定律及其应用
思考:同素异形体相互转化的反应热相当小且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯定律来计算反应热。
P4(白磷,s)+ 5O2 (g) = P4O10 (s);△H = ?2983.2kJ·mol-1
4P(红磷,s)+ 5O2 (g) = P4O10(s);△H = ?2954.0kJ·mol-1
则白磷转化为红磷的热化学方程式为:
____________________________________________
白磷比红磷____________(填“稳定”还是“不稳定”)P4(白磷,s)==4 P(红磷,s); △H = ? 29.2kJ·mol-1不稳定已知:金刚石、石墨的热化学方程式:
C(s,金刚石)+O2(g) =CO2(g)
△H = -395.4 kJ/mol
C(s,石墨)+O2(g) =CO2(g)
△H = -393.5 kJ/mol
则石墨转化为金刚石的反应热 △H= ,
两物质中 较为稳定。+1.9 kJ/mol石 墨课堂练习1、热化学方程式同乘以一个数时,反应热数值也必须同乘以该数值,即 ΔH的值与系数相匹配。
2、热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减;
3、将一个热化学方程式颠倒时, △H的符号也要随之改变;
4.有同素异形体的物质要注明物质名称注意要点 已知:H2(g)+1/2 O2(g) =H2O(g) ;
△H1 = -241.8kJ/mol
H2(g)+ 1/2 O2(g) =H2O(l) ;
△H2 = -285.8kJ/mol
H2O(l) = H2O(g) ;
则△H1、△H2、△H3的关系 。 △H1=△H2+△H3课堂练习△H3 = +44.0kJ/mol练习:已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
据此判断,下列说法正确的是( )
A. 由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B. 由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高;
C. 由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D. 由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高A①C(s ,石墨)+O2(g)= CO2(g) △H1=-393.5kJ/mol
②C(s ,金刚石)+O2(g)= CO2(g) △H2=-395.0kJ/mol三、ΔH大小 的比较(1)同一反应,生成物状态不同时
A(g)+B(g)===C(g) ΔH1<0
A(g)+B(g)===C(l) ΔH2<0
因为C(g)===C(l) ΔH3____,
则ΔH3=__________,ΔH2____ΔH1。(2)同一反应,反应物状态不同时
S(g)+O2(g)===SO2(g) ΔH1<0
S(s)+O2(g)===SO2(g) ΔH2<0
则ΔH1____ΔH2。(3)两个有联系的不同反应相比
C(s)+O2(g)===CO2(g) ΔH1<0
C(s)+O2(g)===CO(g) ΔH2<0
则 ΔH1____ΔH2下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)===CO2(g) ΔH1
C(s)+O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3
S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+O2(g)===H2O(l) ΔH5
2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7
CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
A.① B.④ C.②③④ D.①②③C 6、 化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知P4(白磷)、P4O6的分子结构如图所示。现提供以下化学键的键能(kJ·mol-1):P—P 198、P—O 360、O=O 498,则反应P4(s)+3O2(g)=P4O6(g)的反应热ΔH为( )
A.1638 kJ·mol-1 B.-1638 kJ·mol-1
C.-126 kJ·mol-1 D.126 kJ·mol-1
答案 B1、(2009年四川卷)25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是
A.2H+(aq)+SO42—+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(1) △H= -57.3 kJ/mol
B.KOH(aq)+ ? H2SO4(aq)= ? K2SO4(aq)+H2O(l)
△ H= -57.3kJ/mol
C.C8H18(1)+ 25/2O2(g)=8CO2(g)+ 18H2O(g)
△ H= -5518 kJ/mol
D.2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l)
△H=-5518 kJ/molB总 结一. 化学反应中的能量变化1.可燃物的燃烧反应
2.金属与酸的反应
3.酸碱中和反应放热
反应吸热
反应1.氢氧化钡晶体与氯化铵固体的反应
2.C和CO2的反应
3.某些加热分解反应3 .常见的放(吸)热反应二.燃料的充分燃烧三.当今能源技术及未来展望考试大纲要求1、了解化学反应中能量转化的原因,能说出常见的能量转化形式。
2、了解化学能与热能的相互转化,了解反应热和焓变的涵义,掌握热化学方程式的含义,能正确书写热化学方程式,能用盖斯定律进行有关反应热的简单计算。
3、了解能源是人类生存和发展的重要基础,了解化学在解决能源危机中的重要作用。(1)了解化学反应中能量转化的原因,能说出常见的能量转化形式。
(2)了解化学能与热能的相互转化,了解吸热反应和放热反应、焓变和反应热等概念。
(3)了解热化学方程式的含义,能用盖斯定律进行有关反应热的简单计算。
(4)了解能源是人类生存和社会发展的重要基础,了解化学在解决能源危机中的重要作用。 考纲预览高考热点分析1、热化学方程式的书写或正误判断
2、比较反应热的大小及反应热的计算
3、中和热的测定(重要实验)课本必修2 p30-37 选修4 p2-15高考热点之:热化学方程式的书写1、写出下列反应的热化学方程式:
(1)1mol N2(g)与适量的O2(g)起反应,生成NO2(g),吸收68KJ热量。
(2)1mol Cu(s)与适量的O2(g)起反应,生成CuO(s),放出157KJ热量。2.写出下列反应的热化学方程式
(1)1molC(固态)与适量H2O(气态) 反应,生成CO(气态)和H2(气态),吸收131.3kJ的热量
(2)0.5molCu(固态) 与适量O2(气态) 反应, 生成CuO(固态), 放出78.5 kJ的热量
C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3KJ/mol2Cu(s)+O2(g)=2CuO(s) △H= - 314KJ/mol 3.00gC2H2完全燃烧生成液态水和CO2放出的热量为99.6KJ,写出C2H2燃烧的热化学方程式。
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)
△H=-2589.6KJ/mol思考 1:将0.5mol的气态高能燃料乙硼烷(B2H6)在O2中燃烧,生成固态三氧化二硼和气态水,放出376kJ的热量,写出该反应的热化学方程式___________________________________________.B2H6(g)+3O2(g)=B2O3(s)+3H2O(g) △H =-752kJ/mol<92.4表示1molN2和3molH2完全反应放出的热量,Q表示1molN2和3molH2反应达到平衡时放出的热量,因此Q<92.4高考热点之:热化学方程式的正误判断1、(2009年四川卷)25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是
A.2H+(aq)+SO42—+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(1) △H= -57.3 kJ/mol
B.KOH(aq)+ ? H2SO4(aq)= K2SO4(aq)+H2O(l)
△ H= -57.3kJ/mol
C.C8H18(1)+ 25/2O2(g)=8CO2(g)+ 18H2O(g)
△ H= -5518 kJ/mol
D.2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l)
△H=-5518 kJ/molBA2、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
( )A. H2O(g)=H2(g)+1/2O2(g);ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l);ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g);ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g);ΔH=+484kJ·mol-1 高考热点之:比较反应热的大小及反应热的计算1.已知
① CO(g)+1/2O2(g)=CO2(g) ΔH1= -283.0 kJ/mol
② H2(g)+1/2O2(g)=H2O(l) ΔH2= -285.8 kJ/mol ③C2H5OH(l)+ 3O2(g)=2CO2(g)+3H2O(l) ΔH3=-1370 kJ/mol 试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH?①×2 + ②×4 - ③ = ④ ?? 所以,ΔH=ΔH1×2 +ΔH2×4 -ΔH3 ????? =-283.2×2 -285.8×4 +1370
=-339.2 kJ/mol 2、热化学方程式:
S(g)+O2(g)=SO2(g) ΔH=-297.3kJ/mol
分析下列说法中正确的是( )
A.S(g)+O2(g)=SO2(l) ΔH>297.3KJ/mol
B.S(g)+O2(g)=SO2(l) ΔH<297.3KJ/mol
C.1molSO2的键能总和大于1molS和1molO2键能之和
D.1molSO2的键能总和小于1molS和1molO2键能之和B D高考试题精选1.(2009年重庆卷)下列热化学方程式数学正确的是(△H 的绝对值均正确)
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)
△H= —1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H= +57.3kJ/mol(中和热)
C.S(s)+O2(g)=SO2(g) △H= —269.8kJ/mol(反应热)
D. 2NO2=O2+2NO △H=+116.2kJ/mol(反应热) 概念辨析:2.下列各组物质的标准燃烧热相等的是:( )
A.碳和一氧化碳 B.1mol碳和2mol碳
C.1mol乙炔和2mol碳 D.淀粉和纤维素B285.8 kJ/mol4.关于吸热反应和放热反应,下列说法错误的是 ( A )
A.需加热才能进行的化学反应一定是吸热反应
B.化学反应中的能量变化,除热量外,还可以是光能、电能等
C.化学反应中的能量变化,服从能量守恒定律
D.反应物的总能量高于生成物的总能量时,发生放热反应
5.已知白磷(P4)和P4O6的分子结构如下图所示;现提供以下化学键的键能:P-P 198kJ·mol-1、P-O 360kJ·mol-1、氧气分子内氧原子间的键能为498kJ·mol-1则反应P4+3O2=P4O6的反应热△H为 ( B )
A.+1638 kJ/mol B.-1638 kJ/mol
C.+126 kJ/mol D.+126 kJ/mol6.白磷与氧气可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:
P-P akJ·mol-1、P-O bkJ·mol-1、P=O ckJ·mol-1、O=O dkJ·mol-1。根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A.(6a+5d-4c-12b)kJ·mol-1
B.(4c+12b-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1
D.(4a+5d-4c-12b)kJ·mol-1 A7.(2009年全国2卷)已知:
2H2(g)+ O2(g)=2H2O(l) ΔH= -571.6KJ· mol-1
CH4(g)+ 2O2(g)=CO2(g)+2H2O(l)
ΔH= -890KJ· mol-1
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695KJ,则原混合气体中H2与CH4的物质的量之比是
A.1∶1 B.1∶3
C.1∶4 D.2∶3B反馈练习9.化石燃料的不可再生性,要求我们的努力方向是…………………………( )
A.提高燃料的燃烧效率 B.加快开发煤、石油等
C.从外国进口 D.寻找新能源10.有人预言,H2是21世纪最理想的能源,其根据不正确的是 ……………( )
A.生产H2的原料来源广阔 B.在等质量的可燃气体中,H2燃烧时放出的热量多
C. H2易液化,携带方便 D.燃烧时无污染8.对于放热反应 2H2 + O2 == 2H2O,下列说法中正确的是…………………( )
A. 产物H2O所具有的总能量高于反应物H2和O2所具有的总能量
B. 反应物H2和O2所具有的总能量高于产物H2O所具有的总能量
C. 反应物H2和O2所具有的总能量等于产物H2O所具有的总能量
D. 反应物H2和O2具有的能量相等BADC11.航天飞机用铝粉与高氯酸铵(NH4C1O4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵分解,其方程式可表示为:2NH4C1O4=N2+4H2O+Cl2+2O2+Q。下列对此反应的叙述中错误的是 ……………………………………………………( )
A.上述反应属于分解反应
B.上述反应瞬间产生大量高温气体,推动航天飞机飞行
C.反应从能量变化上说,主要是化学能转变为热能和动能
D.在反应中高氯酸铵只起氧化剂作用D12.(07广东理基19)下述做法能改善空气质量的是
A.以煤等燃料作为主要生活燃料
B.利用太阳能、风能和氢能等能源替代化石能源
C.鼓励私人购买和使用汽车代替公交车
D.限制使用电动车 B13.(07广东文基64)煤、石油、天然气是重要的能源和化工原料,下述说法正确的是
A.石油裂解得到的汽油是纯净物
B.石油产品都可用于聚合反应
C.水煤气是通过煤的液化得到的气态燃料
D.天然气是清洁燃料 D14、(2009年上海卷)已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):
H2(g)+Cl2(g)=2HCl(g) △H=-Q1 k J/mol
H2(g)+Br2(g)=2HBr(g) △H=-Q2 k J/mol
有关上述反应的叙述正确的是
A.Q1>Q2
B.生成物总能量均高于反应物总能量
C.生成1molHCl气体时放出Q1热量
D.1molHBr(g)具有的能量大于1molHBr(l)具有的能量AD15、在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示。请认真观察右图,然后回答问题。
(1)图中所示反应是________(填“吸热”或“放热”)反应,该反应_______(填“需要”或“不需要”)加热,该反应的△H =________________
(用含E1、E2的代数式表示)。放热 需要 (E2 – E1) kJ·mol-1 16、(2)已知热化学方程式:H2(g)+ O2(g) = H2O(g) △H = - 241.8 kJ?mol-1,该反应的活化能为167.2 kJ?mol-1,则其逆反应的活化能为_______________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是___________409 kJ·mol-1 使用了催化剂上图参见选修4
p317:(04上海)实验室制取下列气体,其反应放热的是 ( )
A.由无水醋酸钠制CH4
B.由乙醇制C2H4
C.电石制C2H2
D.由氯酸钾制O2
C18、已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol,计算下列反应中放出的热量。
(1)用20g NaOH 配成稀溶液跟足量稀盐酸反应,放出热量为 kJ。
(2)用0.1molBa(OH)2配成稀溶液跟足量稀硝酸反应,放出热量为 kJ。
(3)用1mol醋酸稀溶液和足量NaOH溶液反应,放出的热量 (大于、小于、等于)57.3kJ,理
由是 。28.6511.46小于醋酸是弱电解质,只是少部分电离,发生电离时要吸热,中和时放热较少 19.由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式: _____ _ __ __ _。
若1g水蒸气转化成液态水放热2.444kJ,则反应H2(g)+1/202(g)= H20(1)的△H=_________________KJ/mol。氢气的燃烧热为___________KJ/mol。
H2(g)+1/202(g)= H20(g) △H=-241.8kJ/mol-285.8kJ/mo1 285.8 20、计算:
(2009年海南卷)已知:
Fe2O3(s)+C(s)=CO2(g)+2Fe(s)
H=234.1kJ·mol-1
C(s)+O2(g)=CO2(g)
H=-393.5kJ·mol-1
则4Fe(s)+3O2(g)=2Fe2O3(s)的H是
A.-824.4 kJ·mol-1 B.-627.6 kJ·mol-1
C.-744.7 kJ·mol-1 D.-169.4 kJ·mol-1
A26.(09江苏卷17)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s) + 2H+(aq) ===Cu2+(aq) + H2(g) △H= 64.39kJ/mol
2H2O2(l) ==2H2O(l) + O2(g) △H= ?196.46kJ/mol
H2(g) +1/2 O2(g) == H2O(l) △H= ?285.84kJ/mol
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。 Cu(s) + 2H+(aq) +H2O2(l)==Cu2+(aq) +2 H2O(l)△H=?319.68kJ/mol22:在做中和热的测定实验中,使用下列用品不是为了减少实验误差的是 ( )
A.碎泡沫塑料 B.环形玻璃棒
C.底部垫纸条 D.两个量筒
23:在做中和热实验测定中和热时,应使用的仪器正确的组合是( )
①天平 ②量筒 ③烧杯 ④滴定管 ⑤温度计 ⑥试管 ⑦酒精灯
A.①②④⑤ B.②③⑤
C.②③④⑦ D.全部DB
经过一个循环,体系仍处于S态,因为物质没有发生变化,所以就不能引发能量变化,即△H1+△H2≡0如何理解盖斯定律?ΔH、ΔH1、ΔH2
之间有何关系?ΔH=ΔH1+ΔH2BΔH二、盖斯定律的应用
盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热很难测得或无法直接测得,利用盖斯定律就可间接计算求得。如:碳燃烧生成CO,同素异形体的相互转化等。例如:C(s)+ ? O2(g)=CO(g)因为C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的ΔH无法直接测得,请同学们自己根据盖斯定律设计一个方案计算该反应的ΔH。
提示(1) C(s) + O2(g) = CO2(g)
△H1=-393.5 kJ/mol
(2) CO(g) + ?O2(g) = CO2(g)
△H3=-283.0 kJ/mol盖斯定律及其应用
△H1= △H2+ △H3
△H2 = △H1- △H3
= -393.5 kJ/mol -(-283.0 kJ/mol)
= -110.5 kJ/mol
C (s) + ? O2 (g) = CO (g) △H=-110.5 kJ/mol
盖斯定律及其应用
思考:同素异形体相互转化的反应热相当小且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯定律来计算反应热。
P4(白磷,s)+ 5O2 (g) = P4O10 (s);△H = ?2983.2kJ·mol-1
4P(红磷,s)+ 5O2 (g) = P4O10(s);△H = ?2954.0kJ·mol-1
则白磷转化为红磷的热化学方程式为:
____________________________________________
白磷比红磷____________(填“稳定”还是“不稳定”)P4(白磷,s)==4 P(红磷,s); △H = ? 29.2kJ·mol-1不稳定已知:金刚石、石墨的热化学方程式:
C(s,金刚石)+O2(g) =CO2(g)
△H = -395.4 kJ/mol
C(s,石墨)+O2(g) =CO2(g)
△H = -393.5 kJ/mol
则石墨转化为金刚石的反应热 △H= ,
两物质中 较为稳定。+1.9 kJ/mol石 墨课堂练习1、热化学方程式同乘以一个数时,反应热数值也必须同乘以该数值,即 ΔH的值与系数相匹配。
2、热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减;
3、将一个热化学方程式颠倒时, △H的符号也要随之改变;
4.有同素异形体的物质要注明物质名称注意要点 已知:H2(g)+1/2 O2(g) =H2O(g) ;
△H1 = -241.8kJ/mol
H2(g)+ 1/2 O2(g) =H2O(l) ;
△H2 = -285.8kJ/mol
H2O(l) = H2O(g) ;
则△H1、△H2、△H3的关系 。 △H1=△H2+△H3课堂练习△H3 = +44.0kJ/mol练习:已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
据此判断,下列说法正确的是( )
A. 由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B. 由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高;
C. 由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D. 由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高A①C(s ,石墨)+O2(g)= CO2(g) △H1=-393.5kJ/mol
②C(s ,金刚石)+O2(g)= CO2(g) △H2=-395.0kJ/mol三、ΔH大小 的比较(1)同一反应,生成物状态不同时
A(g)+B(g)===C(g) ΔH1<0
A(g)+B(g)===C(l) ΔH2<0
因为C(g)===C(l) ΔH3____,
则ΔH3=__________,ΔH2____ΔH1。(2)同一反应,反应物状态不同时
S(g)+O2(g)===SO2(g) ΔH1<0
S(s)+O2(g)===SO2(g) ΔH2<0
则ΔH1____ΔH2。(3)两个有联系的不同反应相比
C(s)+O2(g)===CO2(g) ΔH1<0
C(s)+O2(g)===CO(g) ΔH2<0
则 ΔH1____ΔH2下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)===CO2(g) ΔH1
C(s)+O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3
S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+O2(g)===H2O(l) ΔH5
2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7
CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
A.① B.④ C.②③④ D.①②③C 6、 化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知P4(白磷)、P4O6的分子结构如图所示。现提供以下化学键的键能(kJ·mol-1):P—P 198、P—O 360、O=O 498,则反应P4(s)+3O2(g)=P4O6(g)的反应热ΔH为( )
A.1638 kJ·mol-1 B.-1638 kJ·mol-1
C.-126 kJ·mol-1 D.126 kJ·mol-1
答案 B1、(2009年四川卷)25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是
A.2H+(aq)+SO42—+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(1) △H= -57.3 kJ/mol
B.KOH(aq)+ ? H2SO4(aq)= ? K2SO4(aq)+H2O(l)
△ H= -57.3kJ/mol
C.C8H18(1)+ 25/2O2(g)=8CO2(g)+ 18H2O(g)
△ H= -5518 kJ/mol
D.2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l)
△H=-5518 kJ/molB总 结一. 化学反应中的能量变化1.可燃物的燃烧反应
2.金属与酸的反应
3.酸碱中和反应放热
反应吸热
反应1.氢氧化钡晶体与氯化铵固体的反应
2.C和CO2的反应
3.某些加热分解反应3 .常见的放(吸)热反应二.燃料的充分燃烧三.当今能源技术及未来展望考试大纲要求1、了解化学反应中能量转化的原因,能说出常见的能量转化形式。
2、了解化学能与热能的相互转化,了解反应热和焓变的涵义,掌握热化学方程式的含义,能正确书写热化学方程式,能用盖斯定律进行有关反应热的简单计算。
3、了解能源是人类生存和发展的重要基础,了解化学在解决能源危机中的重要作用。(1)了解化学反应中能量转化的原因,能说出常见的能量转化形式。
(2)了解化学能与热能的相互转化,了解吸热反应和放热反应、焓变和反应热等概念。
(3)了解热化学方程式的含义,能用盖斯定律进行有关反应热的简单计算。
(4)了解能源是人类生存和社会发展的重要基础,了解化学在解决能源危机中的重要作用。 考纲预览高考热点分析1、热化学方程式的书写或正误判断
2、比较反应热的大小及反应热的计算
3、中和热的测定(重要实验)课本必修2 p30-37 选修4 p2-15高考热点之:热化学方程式的书写1、写出下列反应的热化学方程式:
(1)1mol N2(g)与适量的O2(g)起反应,生成NO2(g),吸收68KJ热量。
(2)1mol Cu(s)与适量的O2(g)起反应,生成CuO(s),放出157KJ热量。2.写出下列反应的热化学方程式
(1)1molC(固态)与适量H2O(气态) 反应,生成CO(气态)和H2(气态),吸收131.3kJ的热量
(2)0.5molCu(固态) 与适量O2(气态) 反应, 生成CuO(固态), 放出78.5 kJ的热量
C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3KJ/mol2Cu(s)+O2(g)=2CuO(s) △H= - 314KJ/mol 3.00gC2H2完全燃烧生成液态水和CO2放出的热量为99.6KJ,写出C2H2燃烧的热化学方程式。
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)
△H=-2589.6KJ/mol思考 1:将0.5mol的气态高能燃料乙硼烷(B2H6)在O2中燃烧,生成固态三氧化二硼和气态水,放出376kJ的热量,写出该反应的热化学方程式___________________________________________.B2H6(g)+3O2(g)=B2O3(s)+3H2O(g) △H =-752kJ/mol<92.4表示1molN2和3molH2完全反应放出的热量,Q表示1molN2和3molH2反应达到平衡时放出的热量,因此Q<92.4高考热点之:热化学方程式的正误判断1、(2009年四川卷)25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是
A.2H+(aq)+SO42—+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(1) △H= -57.3 kJ/mol
B.KOH(aq)+ ? H2SO4(aq)= K2SO4(aq)+H2O(l)
△ H= -57.3kJ/mol
C.C8H18(1)+ 25/2O2(g)=8CO2(g)+ 18H2O(g)
△ H= -5518 kJ/mol
D.2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l)
△H=-5518 kJ/molBA2、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
( )A. H2O(g)=H2(g)+1/2O2(g);ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l);ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g);ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g);ΔH=+484kJ·mol-1 高考热点之:比较反应热的大小及反应热的计算1.已知
① CO(g)+1/2O2(g)=CO2(g) ΔH1= -283.0 kJ/mol
② H2(g)+1/2O2(g)=H2O(l) ΔH2= -285.8 kJ/mol ③C2H5OH(l)+ 3O2(g)=2CO2(g)+3H2O(l) ΔH3=-1370 kJ/mol 试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH?①×2 + ②×4 - ③ = ④ ?? 所以,ΔH=ΔH1×2 +ΔH2×4 -ΔH3 ????? =-283.2×2 -285.8×4 +1370
=-339.2 kJ/mol 2、热化学方程式:
S(g)+O2(g)=SO2(g) ΔH=-297.3kJ/mol
分析下列说法中正确的是( )
A.S(g)+O2(g)=SO2(l) ΔH>297.3KJ/mol
B.S(g)+O2(g)=SO2(l) ΔH<297.3KJ/mol
C.1molSO2的键能总和大于1molS和1molO2键能之和
D.1molSO2的键能总和小于1molS和1molO2键能之和B D高考试题精选1.(2009年重庆卷)下列热化学方程式数学正确的是(△H 的绝对值均正确)
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)
△H= —1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H= +57.3kJ/mol(中和热)
C.S(s)+O2(g)=SO2(g) △H= —269.8kJ/mol(反应热)
D. 2NO2=O2+2NO △H=+116.2kJ/mol(反应热) 概念辨析:2.下列各组物质的标准燃烧热相等的是:( )
A.碳和一氧化碳 B.1mol碳和2mol碳
C.1mol乙炔和2mol碳 D.淀粉和纤维素B285.8 kJ/mol4.关于吸热反应和放热反应,下列说法错误的是 ( A )
A.需加热才能进行的化学反应一定是吸热反应
B.化学反应中的能量变化,除热量外,还可以是光能、电能等
C.化学反应中的能量变化,服从能量守恒定律
D.反应物的总能量高于生成物的总能量时,发生放热反应
5.已知白磷(P4)和P4O6的分子结构如下图所示;现提供以下化学键的键能:P-P 198kJ·mol-1、P-O 360kJ·mol-1、氧气分子内氧原子间的键能为498kJ·mol-1则反应P4+3O2=P4O6的反应热△H为 ( B )
A.+1638 kJ/mol B.-1638 kJ/mol
C.+126 kJ/mol D.+126 kJ/mol6.白磷与氧气可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:
P-P akJ·mol-1、P-O bkJ·mol-1、P=O ckJ·mol-1、O=O dkJ·mol-1。根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A.(6a+5d-4c-12b)kJ·mol-1
B.(4c+12b-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1
D.(4a+5d-4c-12b)kJ·mol-1 A7.(2009年全国2卷)已知:
2H2(g)+ O2(g)=2H2O(l) ΔH= -571.6KJ· mol-1
CH4(g)+ 2O2(g)=CO2(g)+2H2O(l)
ΔH= -890KJ· mol-1
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695KJ,则原混合气体中H2与CH4的物质的量之比是
A.1∶1 B.1∶3
C.1∶4 D.2∶3B反馈练习9.化石燃料的不可再生性,要求我们的努力方向是…………………………( )
A.提高燃料的燃烧效率 B.加快开发煤、石油等
C.从外国进口 D.寻找新能源10.有人预言,H2是21世纪最理想的能源,其根据不正确的是 ……………( )
A.生产H2的原料来源广阔 B.在等质量的可燃气体中,H2燃烧时放出的热量多
C. H2易液化,携带方便 D.燃烧时无污染8.对于放热反应 2H2 + O2 == 2H2O,下列说法中正确的是…………………( )
A. 产物H2O所具有的总能量高于反应物H2和O2所具有的总能量
B. 反应物H2和O2所具有的总能量高于产物H2O所具有的总能量
C. 反应物H2和O2所具有的总能量等于产物H2O所具有的总能量
D. 反应物H2和O2具有的能量相等BADC11.航天飞机用铝粉与高氯酸铵(NH4C1O4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵分解,其方程式可表示为:2NH4C1O4=N2+4H2O+Cl2+2O2+Q。下列对此反应的叙述中错误的是 ……………………………………………………( )
A.上述反应属于分解反应
B.上述反应瞬间产生大量高温气体,推动航天飞机飞行
C.反应从能量变化上说,主要是化学能转变为热能和动能
D.在反应中高氯酸铵只起氧化剂作用D12.(07广东理基19)下述做法能改善空气质量的是
A.以煤等燃料作为主要生活燃料
B.利用太阳能、风能和氢能等能源替代化石能源
C.鼓励私人购买和使用汽车代替公交车
D.限制使用电动车 B13.(07广东文基64)煤、石油、天然气是重要的能源和化工原料,下述说法正确的是
A.石油裂解得到的汽油是纯净物
B.石油产品都可用于聚合反应
C.水煤气是通过煤的液化得到的气态燃料
D.天然气是清洁燃料 D14、(2009年上海卷)已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):
H2(g)+Cl2(g)=2HCl(g) △H=-Q1 k J/mol
H2(g)+Br2(g)=2HBr(g) △H=-Q2 k J/mol
有关上述反应的叙述正确的是
A.Q1>Q2
B.生成物总能量均高于反应物总能量
C.生成1molHCl气体时放出Q1热量
D.1molHBr(g)具有的能量大于1molHBr(l)具有的能量AD15、在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示。请认真观察右图,然后回答问题。
(1)图中所示反应是________(填“吸热”或“放热”)反应,该反应_______(填“需要”或“不需要”)加热,该反应的△H =________________
(用含E1、E2的代数式表示)。放热 需要 (E2 – E1) kJ·mol-1 16、(2)已知热化学方程式:H2(g)+ O2(g) = H2O(g) △H = - 241.8 kJ?mol-1,该反应的活化能为167.2 kJ?mol-1,则其逆反应的活化能为_______________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是___________409 kJ·mol-1 使用了催化剂上图参见选修4
p317:(04上海)实验室制取下列气体,其反应放热的是 ( )
A.由无水醋酸钠制CH4
B.由乙醇制C2H4
C.电石制C2H2
D.由氯酸钾制O2
C18、已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol,计算下列反应中放出的热量。
(1)用20g NaOH 配成稀溶液跟足量稀盐酸反应,放出热量为 kJ。
(2)用0.1molBa(OH)2配成稀溶液跟足量稀硝酸反应,放出热量为 kJ。
(3)用1mol醋酸稀溶液和足量NaOH溶液反应,放出的热量 (大于、小于、等于)57.3kJ,理
由是 。28.6511.46小于醋酸是弱电解质,只是少部分电离,发生电离时要吸热,中和时放热较少 19.由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式: _____ _ __ __ _。
若1g水蒸气转化成液态水放热2.444kJ,则反应H2(g)+1/202(g)= H20(1)的△H=_________________KJ/mol。氢气的燃烧热为___________KJ/mol。
H2(g)+1/202(g)= H20(g) △H=-241.8kJ/mol-285.8kJ/mo1 285.8 20、计算:
(2009年海南卷)已知:
Fe2O3(s)+C(s)=CO2(g)+2Fe(s)
H=234.1kJ·mol-1
C(s)+O2(g)=CO2(g)
H=-393.5kJ·mol-1
则4Fe(s)+3O2(g)=2Fe2O3(s)的H是
A.-824.4 kJ·mol-1 B.-627.6 kJ·mol-1
C.-744.7 kJ·mol-1 D.-169.4 kJ·mol-1
A26.(09江苏卷17)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s) + 2H+(aq) ===Cu2+(aq) + H2(g) △H= 64.39kJ/mol
2H2O2(l) ==2H2O(l) + O2(g) △H= ?196.46kJ/mol
H2(g) +1/2 O2(g) == H2O(l) △H= ?285.84kJ/mol
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。 Cu(s) + 2H+(aq) +H2O2(l)==Cu2+(aq) +2 H2O(l)△H=?319.68kJ/mol22:在做中和热的测定实验中,使用下列用品不是为了减少实验误差的是 ( )
A.碎泡沫塑料 B.环形玻璃棒
C.底部垫纸条 D.两个量筒
23:在做中和热实验测定中和热时,应使用的仪器正确的组合是( )
①天平 ②量筒 ③烧杯 ④滴定管 ⑤温度计 ⑥试管 ⑦酒精灯
A.①②④⑤ B.②③⑤
C.②③④⑦ D.全部DB
