2019年高考化学真题分类汇编专题10:物质结构与性质
文档属性
| 名称 | 2019年高考化学真题分类汇编专题10:物质结构与性质 |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-14 15:31:44 | ||
图片预览



文档简介
2019年高考化学真题分类汇编专题10:物质结构与性质
一、单选题(共2题)
1.(2019?江苏)反应NH4Cl+NaNO2=NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是(?? )
A.?中子数为18的氯原子: ?????????????????????????????? ?B.?N2的结构式:N=N C.?Na+的结构示意图: ???????????????????? D.?H2O的电子式:
2.(2019?全国Ⅰ)固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。下列叙述错误的是(?? )
A.?冰表面第一层中,HCl以分子形式存在 B.?冰表面第二层中,H+浓度为5×10?3 mol·L?1(设冰的密度为0.9 g·cm?3) C.?冰表面第三层中,冰的氢键网格结构保持不变
D.?冰表面各层之间,均存在可逆反应HCl H++Cl?
二、综合题(共4题)
3.(2019?江苏) A.[物质结构与性质]
Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu?O。
(1)Cu2+基态核外电子排布式为________。
(2) 的空间构型为________(用文字描述);Cu2+与OH?反应能生成[Cu(OH)4]2? , [Cu(OH)4]2?中的配位原子为________(填元素符号)。
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为________;推测抗坏血酸在水中的溶解性:________(填“难溶于水”或“易溶于水”)。
(4)一个Cu2O晶胞(见图2)中,Cu原子的数目为________。
4.(2019?全国Ⅰ)【选修三:物质结构与性质】
在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要村料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是??????????? (填标号)。
A.?[Ne] ????????????????????????B.?[Ne] ????????????????????????C.?[Ne] ????????????????????????D.?[Ne]
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是________、________。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是________,其中与乙二胺形成的化合物稳定性相对较高的是________(填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如下表所示:
氧化物
Li2O
MgO
P4O6
SO2
熔点/°C
1570
2800
23.8
?75.5
解释表中氧化物之间熔点差异的原因________。
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=________pm,Mg原子之间最短距离y=________pm。设阿伏加德罗常数的值为NA , 则MgCu2的密度是________g·cm?3(列出计算表达式)。
5.(2019?全国Ⅱ)【选修三:物质结构与性质】
近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe?Sm?As?F?O组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为________,其沸点比NH3的________(填“高”或“低”),其判断理由是________。
(2)Fe成为阳离子时首先失去________轨道电子,Sm的价层电子排布式为4f66s2 , Sm3+的价层电子排布式为________。
(3)比较离子半径:F?________O2?(填“大于”等于”或“小于”)。
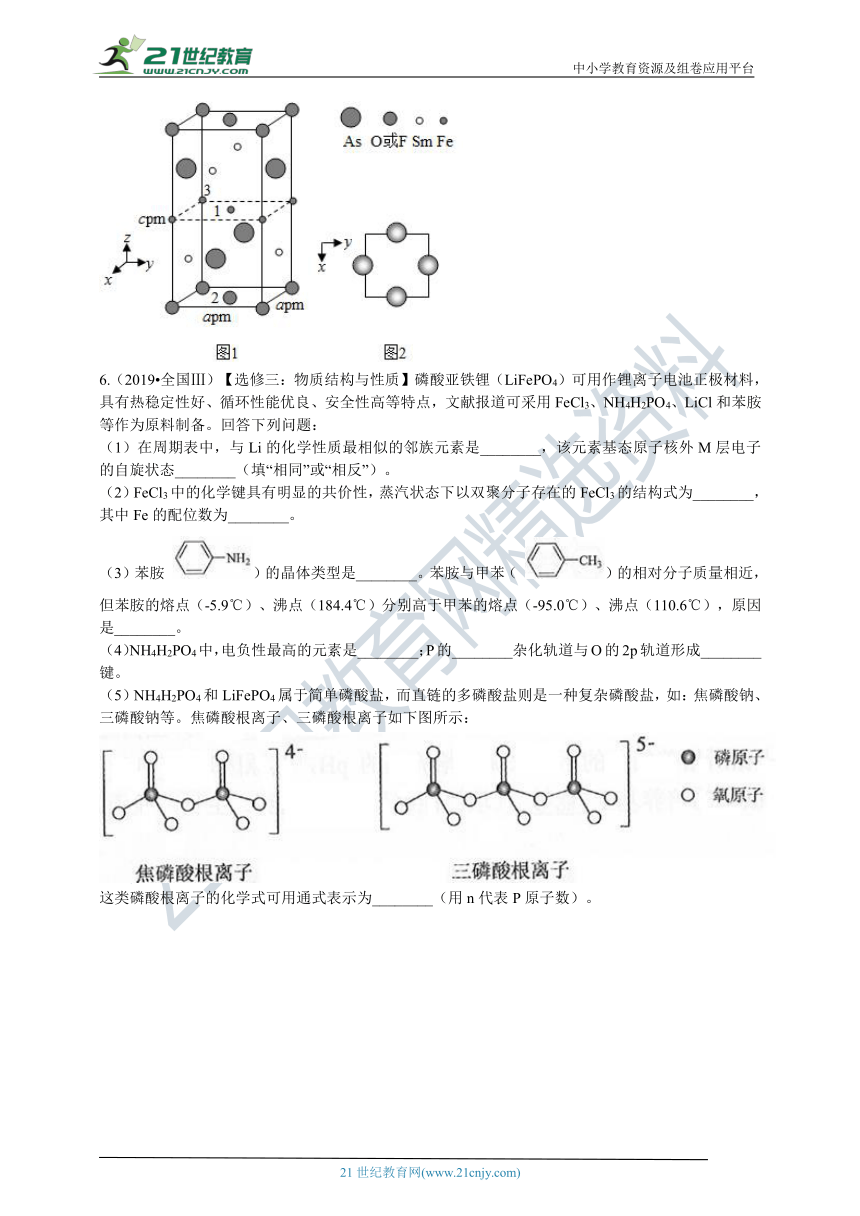
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。
图中F?和O2?共同占据晶胞的上下底面位置,若两者的比例依次用x和1?x代表,则该化合物的化学式表示为________,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=________g·cm?3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为( , , ),则原子2和3的坐标分别为________、________。
6.(2019?全国Ⅲ)【选修三:物质结构与性质】磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是________,该元素基态原子核外M层电子的自旋状态________(填“相同”或“相反”)。
(2)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为________,其中Fe的配位数为________。
(3)苯胺 )的晶体类型是________。苯胺与甲苯( )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是________。
(4)NH4H2PO4中,电负性最高的元素是________;P的________杂化轨道与O的2p轨道形成________键。
(5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
这类磷酸根离子的化学式可用通式表示为________(用n代表P原子数)。
答案解析部分
一、单选题
1. D
【考点】原子中的数量关系,电子式、化学式或化学符号及名称的综合
解:【解答】A、中子数为18的氯原子,其质量数=质子数+中子数=17+18=35,因此该原子的表示方法为: , A不符合题意; B、N2的结构式为N≡N,B不符合题意; C、Na的最外层电子数为11,失去一个电子后形成Na+,其离子结构示意图为, C不符合题意; D、H2O中存在两个氢氧共价键,其电子式为, D符合题意; 故答案为:D 【分析】A、标在元素符号左上角的数字表示的是质量数,质量数=质子数+中子数; B、N2分子中存在N≡N; C、Na+是在Na原子的基础上失去最外层一个电子形成的; D、H2O中存在着氢氧共价键;
2. D
【考点】物质的组成、结构和性质的关系,电离方程式的书写,物质的量浓度的计算
解:【解答】 A.根据题目信息HCl分子被冰表面吸附判断,A说法正确,不符合题意。 B.根据分子数之比等于物质的量之比,设水的物质的量为1mol,则为18g,HCl的物质的量为10-4mol,根据密度公式,V=m/p,得出体积,然后计算HCl的物质的量浓度,B正确,不符合题意。 C.HCl分子不能与水形成氢键,所以冰分子中氢键结构不变,故C正确,不符合题意。 D.HClH++Cl-此式子是电离,但盐酸水解不是可逆反应,应用等号故D错误,符合题意。 故正确答案为:D。 【分析】根据题目信息进行解题,其次注意氢键知识点的应用,对于HCl分子的性质不能因题目信息的变化而变化。
二、综合题
3. (1)[Ar]3d9或1s22s22p63s23p63d9 (2)正四面体;O (3)sp3、sp2;易溶于水 (4)4
【考点】原子核外电子排布,判断简单分子或离子的构型,晶胞的计算,原子轨道杂化方式及杂化类型判断
解:【解答】(1)Cu的基态核外电子排布式为1s22s22p23s23p23d104s1 , 形成Cu2+时,失去2个电子,即失去4s和3d能级上各自一个电子,因此Cu2+的基态电子排布式为:1s22s22p23s23p23d9; (2)SO42-的中心原子为S,四个氧原子在周围,此时为正四面体;根据配位键理论,此时铜离子提供空轨道,OH-中的氧原子提供孤对电子,因此氧原子为配位原子; (3)由抗坏血酸的分子结构可知,结构中,碳原子以双键和单键的形式存在,形成双键的碳原子为sp2杂化,形成单键的碳原子为sp3杂化;由于抗坏血酸分子结构中含有-COOH、-OH;且含有多个氧原子,可以和水形成氢键,氢键可增大物质在水中的溶解性,因此抗坏血酸易溶于水; (4)根据Cu2O的原子个数比可知,铜原子和氧原子的个数比为2:1,根据晶胞中的白球和黑球的个数,可以知道白球有2个,黑球有4个,因此黑球代表的是铜原子。 【分析】(1)根据Cu的核外电子排布式确定Cu2+的核外电子排布式,注意Cu的3d和4s分别为全充满和半充满状态时,更稳定; (2)要解决空间构型有一些技巧,当为XY4型为正四面体,XY3型若无孤对电子则为平面三角形,若有孤对电子则为三角锥,当为XY2型若无孤对电子则为直线型,有孤对电子则为V型,当为XY型则为直线型;形成配合物时,提供孤对电子的为配位原子; (3)根据抗坏血酸中碳原子的成键情况,确定其轨道杂化类型;分子结构中含有多个氧原子,可形成氢键,氢键可增大物质在水中的溶解度; (4)根据晶胞的化学式,结合原子个数比分析;
4. (1)A (2)sp3;sp3;乙二胺的两个N提供孤对电子给金属离子形成配位键;Cu2+ (3)Li2O、MgO为离子晶体,P4O6、SO2为分子晶体。晶格能MgO>Li2O。分子间力(分子量)P4O6>SO2 (4);;
【考点】晶体熔沸点的比较,晶胞的计算,原子轨道杂化方式及杂化类型判断
解:【解答】(1)电离最外层一个电子所需能量也即是失去一个电子所需的能量,A是第二电离能,B是第一电离能。CD都是激发态容易失去一个电子所以能量最大的是A。 (2)根据N、C都接的单键可以判断杂化类型是 sp3 、 sp3 , 乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是: 乙二胺的两个N提供孤对电子给金属离子形成配位键?; 其中与乙二胺形成的化合物稳定性相对较高的是 Cu2+ ,因为其半径大,空轨道易与N 原子形成配位键。 (3) 氧化物之间熔点差异的原因 :先判断晶体类型,由于晶体类型不同导致影响熔点的作用力不同,?离子晶体的熔点大于分子晶体。Li2O、MgO为离子晶体,P4O6、SO2为分子晶体。晶格能MgO>Li2O。分子间力(分子量)P4O6>SO2 (4)根据图像发现 Cu原子之间最短距离 是面对角线的1/4,故答案为: ,而 Mg原子之间最短距离 是体对角线的1/4,所以答案为: ?? 根据密度计算公式p===得出 。 【分析】(1)基态能量小于激发态,第一电离能小于第二电离能,根据此知识点可以解答。 (2)杂化类型判断根据杂化理论,利用化学键进行判断。对于配位键则需要看有无孤对电子和空轨道。 (3)熔沸点比较看晶体类型,根据化学键的不同进行判断。 (4)根据图像利用数学公式进行计算距离和体积,根据物质的量公式进行推到得出密度。
5. (1)三角锥形 ;低;NH3分子间存在氢键 (2)4s;4f5 (3)小于 (4)SmFeAsO1?xFx;;( );( )
【考点】原子核外电子排布,晶体熔沸点的比较,晶胞的计算,原子结构示意图,微粒半径大小的比较
解:【解答】(1)氨气为三角锥形,因为元素As与N同族 ,所以 As的氢化物分子的立体结构为 三角锥形,因为氨气分子间形成氢键,所以沸点高。 (2) Fe?的价层电子排布式为3d64s2,形成阳离子最先失去最外层4s轨道上的电子。同理 Sm的价层电子排布式为4f66s2, Sm3+的价层电子排布式为 4f5. (3) F? , O2? 核外电子层数相同,但氟的原子序数大于氧,所以 F??半径小于?O2?。 (4)根据晶胞计算规则,晶胞中Fe个数为2, Sm 个数为2, As 个数为2,所以化学式为 SmFeAsO1?xFx?。密度表达式为 ρ= 代入数据即可,答案为: ?。因为1的坐标为(),因为2位于底面且与1在地面投影位置重合所以坐标为 (??) ,因为3位于棱中心,且与1共面所以坐标为 (??) 。 【分析】(2)失电子时先失去最外层电子 (3)电子层结构一样的的阴离子,原子序数越大半径越小 (4)晶胞的计算,包括化学式的确定,密度计算,坐标的标定。
6. (1)Mg;相反 (2);4 (3)分子晶体;苯胺分子之间存在氢键 (4)O;sp3;σ (5)(PnO3n+1)(n+2)-
【考点】晶体的类型与物质熔点、硬度、导电性等的关系,原子轨道杂化方式及杂化类型判断,化学键和分子间作用力的区别,结构式
解:【解答】(1)有些元素的化学性质和周期表中在它左上方或右下方,并与其相邻的另一主族元素的化学性质相似,称之为对角线规则;因此与Li化学性质最相似的邻族元素是Mg;镁的M层电子有两个电子,占据s轨道,而s轨道最多容纳两个电子,因此其自旋方向相反; (2)FeCl3中的化学键具有明显的共价性,则蒸汽状态下,双聚分子中的化学键以共价键形式结合,因此其结构式为:;由双聚分子的结构式可知,Fe的配位数为4; (3)苯胺属于有机物,绝大多数有机物都属于分子晶体,因此苯胺属于分子晶体;苯胺中含有氮元素,氮原子能形成氢键,氢键的存在会使得物质的熔沸点升高,因此苯胺的熔沸点都高于甲苯; (4)非金属性越强,其电负性越高,NH4H2PO4中所含的元素为H、N、O、P;其中非金属性最强的为O,因此电负性最强的元素是O;在NH4H2PO4中P以sp3形式杂化,P的sp3杂化轨道与O的2p轨道形成σ键; (5)由图可知,焦磷酸根离子的化学式为:P2O74- , 三磷酸根离子的化学式为P3O105- , 而磷酸根离子的化学式为:PO43-;因此,用n表示P原子的个数时,这类磷酸根离子的化学式可用通式(PnO3n+1)(n+2)-表示; 【分析】(1)根据对角线规则确定与Li化学性质相似的元素;结合该元素原子的和外电子排布确定M层电子的自旋状态; (2)FeCl3中的化学键具有明显的共价性,其双聚分子中化学键以共价键形式结合,据此书写双聚分子的结构式;由其结构式确定Fe的配位数; (3)绝大多数的有机物属于分子晶体;苯胺分子中含有氮原子,可形成氢键,氢键会影响物质的熔沸点; (4)根据电负性的递变规律分析;在NH4H2PO4中P以sp3形式杂化,P的sp3杂化轨道与O的2p轨道形成σ键; (5)根据磷酸根离子、焦磷酸根离子、三磷酸根离子的化学式确定这类磷酸根离子的化学式的通式;
一、单选题(共2题)
1.(2019?江苏)反应NH4Cl+NaNO2=NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是(?? )
A.?中子数为18的氯原子: ?????????????????????????????? ?B.?N2的结构式:N=N C.?Na+的结构示意图: ???????????????????? D.?H2O的电子式:
2.(2019?全国Ⅰ)固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。下列叙述错误的是(?? )
A.?冰表面第一层中,HCl以分子形式存在 B.?冰表面第二层中,H+浓度为5×10?3 mol·L?1(设冰的密度为0.9 g·cm?3) C.?冰表面第三层中,冰的氢键网格结构保持不变
D.?冰表面各层之间,均存在可逆反应HCl H++Cl?
二、综合题(共4题)
3.(2019?江苏) A.[物质结构与性质]
Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu?O。
(1)Cu2+基态核外电子排布式为________。
(2) 的空间构型为________(用文字描述);Cu2+与OH?反应能生成[Cu(OH)4]2? , [Cu(OH)4]2?中的配位原子为________(填元素符号)。
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为________;推测抗坏血酸在水中的溶解性:________(填“难溶于水”或“易溶于水”)。
(4)一个Cu2O晶胞(见图2)中,Cu原子的数目为________。
4.(2019?全国Ⅰ)【选修三:物质结构与性质】
在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要村料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是??????????? (填标号)。
A.?[Ne] ????????????????????????B.?[Ne] ????????????????????????C.?[Ne] ????????????????????????D.?[Ne]
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是________、________。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是________,其中与乙二胺形成的化合物稳定性相对较高的是________(填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如下表所示:
氧化物
Li2O
MgO
P4O6
SO2
熔点/°C
1570
2800
23.8
?75.5
解释表中氧化物之间熔点差异的原因________。
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=________pm,Mg原子之间最短距离y=________pm。设阿伏加德罗常数的值为NA , 则MgCu2的密度是________g·cm?3(列出计算表达式)。
5.(2019?全国Ⅱ)【选修三:物质结构与性质】
近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe?Sm?As?F?O组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为________,其沸点比NH3的________(填“高”或“低”),其判断理由是________。
(2)Fe成为阳离子时首先失去________轨道电子,Sm的价层电子排布式为4f66s2 , Sm3+的价层电子排布式为________。
(3)比较离子半径:F?________O2?(填“大于”等于”或“小于”)。
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。
图中F?和O2?共同占据晶胞的上下底面位置,若两者的比例依次用x和1?x代表,则该化合物的化学式表示为________,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=________g·cm?3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为( , , ),则原子2和3的坐标分别为________、________。
6.(2019?全国Ⅲ)【选修三:物质结构与性质】磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是________,该元素基态原子核外M层电子的自旋状态________(填“相同”或“相反”)。
(2)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为________,其中Fe的配位数为________。
(3)苯胺 )的晶体类型是________。苯胺与甲苯( )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是________。
(4)NH4H2PO4中,电负性最高的元素是________;P的________杂化轨道与O的2p轨道形成________键。
(5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
这类磷酸根离子的化学式可用通式表示为________(用n代表P原子数)。
答案解析部分
一、单选题
1. D
【考点】原子中的数量关系,电子式、化学式或化学符号及名称的综合
解:【解答】A、中子数为18的氯原子,其质量数=质子数+中子数=17+18=35,因此该原子的表示方法为: , A不符合题意; B、N2的结构式为N≡N,B不符合题意; C、Na的最外层电子数为11,失去一个电子后形成Na+,其离子结构示意图为, C不符合题意; D、H2O中存在两个氢氧共价键,其电子式为, D符合题意; 故答案为:D 【分析】A、标在元素符号左上角的数字表示的是质量数,质量数=质子数+中子数; B、N2分子中存在N≡N; C、Na+是在Na原子的基础上失去最外层一个电子形成的; D、H2O中存在着氢氧共价键;
2. D
【考点】物质的组成、结构和性质的关系,电离方程式的书写,物质的量浓度的计算
解:【解答】 A.根据题目信息HCl分子被冰表面吸附判断,A说法正确,不符合题意。 B.根据分子数之比等于物质的量之比,设水的物质的量为1mol,则为18g,HCl的物质的量为10-4mol,根据密度公式,V=m/p,得出体积,然后计算HCl的物质的量浓度,B正确,不符合题意。 C.HCl分子不能与水形成氢键,所以冰分子中氢键结构不变,故C正确,不符合题意。 D.HClH++Cl-此式子是电离,但盐酸水解不是可逆反应,应用等号故D错误,符合题意。 故正确答案为:D。 【分析】根据题目信息进行解题,其次注意氢键知识点的应用,对于HCl分子的性质不能因题目信息的变化而变化。
二、综合题
3. (1)[Ar]3d9或1s22s22p63s23p63d9 (2)正四面体;O (3)sp3、sp2;易溶于水 (4)4
【考点】原子核外电子排布,判断简单分子或离子的构型,晶胞的计算,原子轨道杂化方式及杂化类型判断
解:【解答】(1)Cu的基态核外电子排布式为1s22s22p23s23p23d104s1 , 形成Cu2+时,失去2个电子,即失去4s和3d能级上各自一个电子,因此Cu2+的基态电子排布式为:1s22s22p23s23p23d9; (2)SO42-的中心原子为S,四个氧原子在周围,此时为正四面体;根据配位键理论,此时铜离子提供空轨道,OH-中的氧原子提供孤对电子,因此氧原子为配位原子; (3)由抗坏血酸的分子结构可知,结构中,碳原子以双键和单键的形式存在,形成双键的碳原子为sp2杂化,形成单键的碳原子为sp3杂化;由于抗坏血酸分子结构中含有-COOH、-OH;且含有多个氧原子,可以和水形成氢键,氢键可增大物质在水中的溶解性,因此抗坏血酸易溶于水; (4)根据Cu2O的原子个数比可知,铜原子和氧原子的个数比为2:1,根据晶胞中的白球和黑球的个数,可以知道白球有2个,黑球有4个,因此黑球代表的是铜原子。 【分析】(1)根据Cu的核外电子排布式确定Cu2+的核外电子排布式,注意Cu的3d和4s分别为全充满和半充满状态时,更稳定; (2)要解决空间构型有一些技巧,当为XY4型为正四面体,XY3型若无孤对电子则为平面三角形,若有孤对电子则为三角锥,当为XY2型若无孤对电子则为直线型,有孤对电子则为V型,当为XY型则为直线型;形成配合物时,提供孤对电子的为配位原子; (3)根据抗坏血酸中碳原子的成键情况,确定其轨道杂化类型;分子结构中含有多个氧原子,可形成氢键,氢键可增大物质在水中的溶解度; (4)根据晶胞的化学式,结合原子个数比分析;
4. (1)A (2)sp3;sp3;乙二胺的两个N提供孤对电子给金属离子形成配位键;Cu2+ (3)Li2O、MgO为离子晶体,P4O6、SO2为分子晶体。晶格能MgO>Li2O。分子间力(分子量)P4O6>SO2 (4);;
【考点】晶体熔沸点的比较,晶胞的计算,原子轨道杂化方式及杂化类型判断
解:【解答】(1)电离最外层一个电子所需能量也即是失去一个电子所需的能量,A是第二电离能,B是第一电离能。CD都是激发态容易失去一个电子所以能量最大的是A。 (2)根据N、C都接的单键可以判断杂化类型是 sp3 、 sp3 , 乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是: 乙二胺的两个N提供孤对电子给金属离子形成配位键?; 其中与乙二胺形成的化合物稳定性相对较高的是 Cu2+ ,因为其半径大,空轨道易与N 原子形成配位键。 (3) 氧化物之间熔点差异的原因 :先判断晶体类型,由于晶体类型不同导致影响熔点的作用力不同,?离子晶体的熔点大于分子晶体。Li2O、MgO为离子晶体,P4O6、SO2为分子晶体。晶格能MgO>Li2O。分子间力(分子量)P4O6>SO2 (4)根据图像发现 Cu原子之间最短距离 是面对角线的1/4,故答案为: ,而 Mg原子之间最短距离 是体对角线的1/4,所以答案为: ?? 根据密度计算公式p===得出 。 【分析】(1)基态能量小于激发态,第一电离能小于第二电离能,根据此知识点可以解答。 (2)杂化类型判断根据杂化理论,利用化学键进行判断。对于配位键则需要看有无孤对电子和空轨道。 (3)熔沸点比较看晶体类型,根据化学键的不同进行判断。 (4)根据图像利用数学公式进行计算距离和体积,根据物质的量公式进行推到得出密度。
5. (1)三角锥形 ;低;NH3分子间存在氢键 (2)4s;4f5 (3)小于 (4)SmFeAsO1?xFx;;( );( )
【考点】原子核外电子排布,晶体熔沸点的比较,晶胞的计算,原子结构示意图,微粒半径大小的比较
解:【解答】(1)氨气为三角锥形,因为元素As与N同族 ,所以 As的氢化物分子的立体结构为 三角锥形,因为氨气分子间形成氢键,所以沸点高。 (2) Fe?的价层电子排布式为3d64s2,形成阳离子最先失去最外层4s轨道上的电子。同理 Sm的价层电子排布式为4f66s2, Sm3+的价层电子排布式为 4f5. (3) F? , O2? 核外电子层数相同,但氟的原子序数大于氧,所以 F??半径小于?O2?。 (4)根据晶胞计算规则,晶胞中Fe个数为2, Sm 个数为2, As 个数为2,所以化学式为 SmFeAsO1?xFx?。密度表达式为 ρ= 代入数据即可,答案为: ?。因为1的坐标为(),因为2位于底面且与1在地面投影位置重合所以坐标为 (??) ,因为3位于棱中心,且与1共面所以坐标为 (??) 。 【分析】(2)失电子时先失去最外层电子 (3)电子层结构一样的的阴离子,原子序数越大半径越小 (4)晶胞的计算,包括化学式的确定,密度计算,坐标的标定。
6. (1)Mg;相反 (2);4 (3)分子晶体;苯胺分子之间存在氢键 (4)O;sp3;σ (5)(PnO3n+1)(n+2)-
【考点】晶体的类型与物质熔点、硬度、导电性等的关系,原子轨道杂化方式及杂化类型判断,化学键和分子间作用力的区别,结构式
解:【解答】(1)有些元素的化学性质和周期表中在它左上方或右下方,并与其相邻的另一主族元素的化学性质相似,称之为对角线规则;因此与Li化学性质最相似的邻族元素是Mg;镁的M层电子有两个电子,占据s轨道,而s轨道最多容纳两个电子,因此其自旋方向相反; (2)FeCl3中的化学键具有明显的共价性,则蒸汽状态下,双聚分子中的化学键以共价键形式结合,因此其结构式为:;由双聚分子的结构式可知,Fe的配位数为4; (3)苯胺属于有机物,绝大多数有机物都属于分子晶体,因此苯胺属于分子晶体;苯胺中含有氮元素,氮原子能形成氢键,氢键的存在会使得物质的熔沸点升高,因此苯胺的熔沸点都高于甲苯; (4)非金属性越强,其电负性越高,NH4H2PO4中所含的元素为H、N、O、P;其中非金属性最强的为O,因此电负性最强的元素是O;在NH4H2PO4中P以sp3形式杂化,P的sp3杂化轨道与O的2p轨道形成σ键; (5)由图可知,焦磷酸根离子的化学式为:P2O74- , 三磷酸根离子的化学式为P3O105- , 而磷酸根离子的化学式为:PO43-;因此,用n表示P原子的个数时,这类磷酸根离子的化学式可用通式(PnO3n+1)(n+2)-表示; 【分析】(1)根据对角线规则确定与Li化学性质相似的元素;结合该元素原子的和外电子排布确定M层电子的自旋状态; (2)FeCl3中的化学键具有明显的共价性,其双聚分子中化学键以共价键形式结合,据此书写双聚分子的结构式;由其结构式确定Fe的配位数; (3)绝大多数的有机物属于分子晶体;苯胺分子中含有氮原子,可形成氢键,氢键会影响物质的熔沸点; (4)根据电负性的递变规律分析;在NH4H2PO4中P以sp3形式杂化,P的sp3杂化轨道与O的2p轨道形成σ键; (5)根据磷酸根离子、焦磷酸根离子、三磷酸根离子的化学式确定这类磷酸根离子的化学式的通式;
同课章节目录
