高中化学选修四第二章化学反应速率和化学平衡第二节影响化学反应速率的因素课件(共34张PPT)
文档属性
| 名称 | 高中化学选修四第二章化学反应速率和化学平衡第二节影响化学反应速率的因素课件(共34张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 699.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-17 16:22:37 | ||
图片预览









文档简介
课件34张PPT。第二节
影响化学反应速率的因素一辆汽车行驶速率的决定因素是什么?影响因素是什么?
决定因素是:汽车的性能(如QQ和宝马)
影响因素:⑴天气
⑵路况
⑶燃料质量
⑷司机的驾驶水平和经验
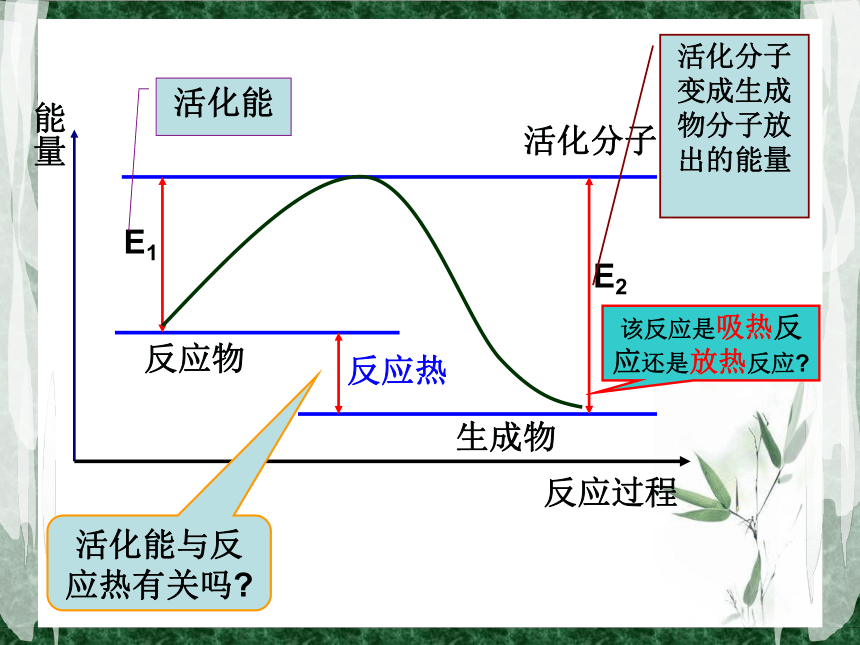
……想一想?有效碰撞理论回顾化学反应发生的先决条件是反应物分子必须发生碰撞;但不是任何两种反应物分子之间的碰撞都能发生反应,只有少数分子的碰撞能发生反应,这种能够发生化学反应的碰撞称为有效碰撞。活化分子:活化能:活化分子比普通分子高的能量, 符号Ea。
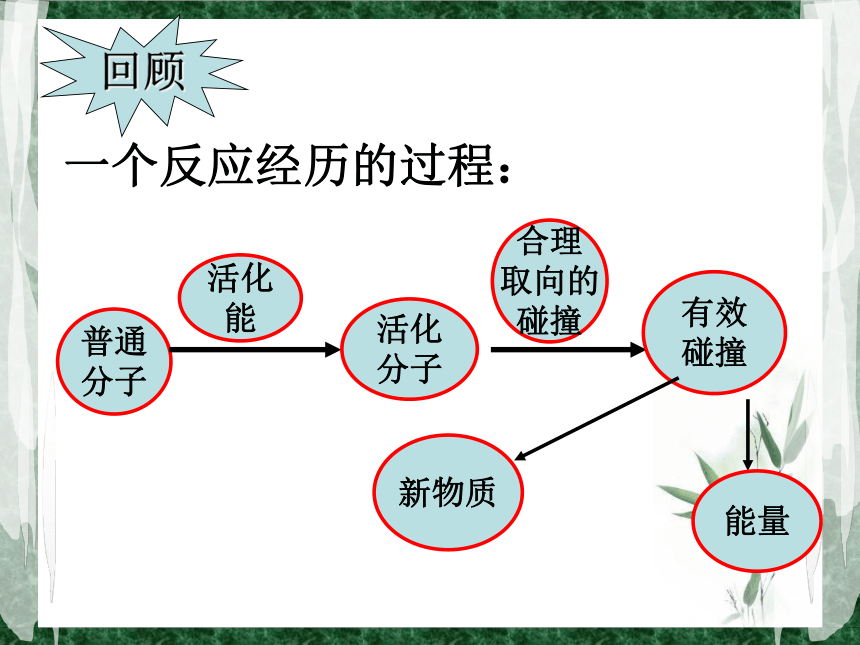
单位 : kJ·mol-1 活化分子间的碰撞 为有效碰撞。能够发生有效碰撞的分子。不一定能量反应过程E1E2反应物生成物活化分子活化能活化分子变成生成物分子放出的能量该反应是吸热反应还是放热反应?活化能与反应热有关吗?反应热普通
分子活化
能活化
分子合理
取向的
碰撞有效
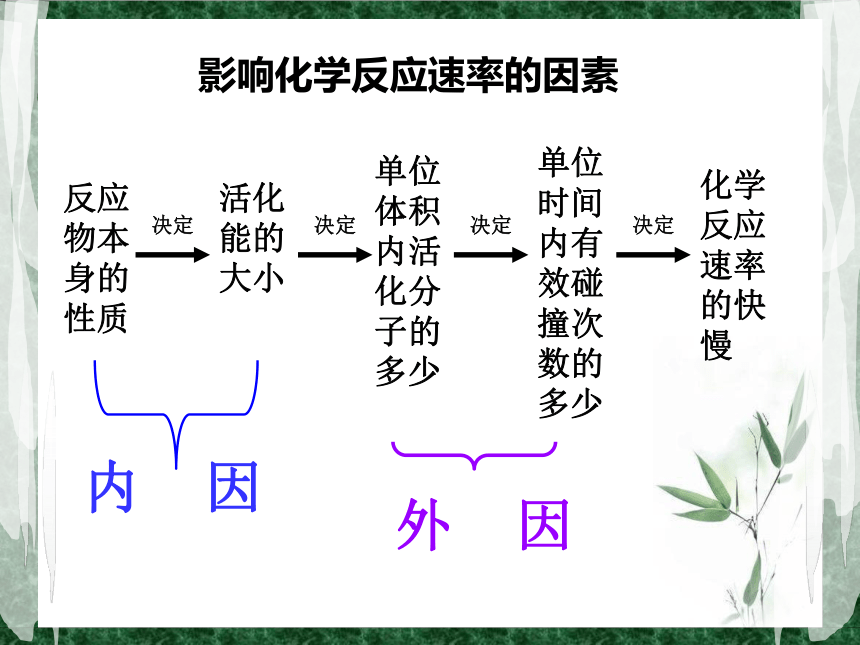
碰撞一个反应经历的过程:回顾⑤.相同条件下,Ea越大,活化分子百分数(f) ,反应 。反之,Ea越小,f ,反应 。小知识:①.某一化学反应的速率大小与单位时间内 有关。③.活化分子百分数: (活化分子数/反应物分子总数)×100%②.Ea的大小与反应物本性(物质的分子结构、化学键)有关。④.在一定条件下(P、T一定),反应物中活化分子的百分数为定值。N活=N总×活%有效碰撞的次数 越小越慢越大越快反应物本身的性质活化能的大小单位体积内活化分子的多少单位时间内有效碰撞次数的多少化学反应速率的快慢内 因外 因影响化学反应速率的因素一.内部因素(主要因素)参加反应物质的性质二.外部因素1.浓度:(实验2-2)实验2-2结论:浓度大的H2C2O4(aq)先褪色。在其他条件不变时,增大反应物浓度,可以增大反应速率。2KMnO4 + 5H2C2O4 +3H2SO4=K2SO4 +2MnSO4 +10CO2↑+8H2O实验原理:规律:其他条件不变时,增大反应物的浓度,可以增大反应速率;减小反应物的浓度,可以减小化学反应的速率。(P、T一定时:C反应物↑,ν↑ C反应物↓,ν↓)本质原因反应物浓度增大,单位体积内活化分子数增多,有效碰撞的频率增加,反应速率增大。浓度增大→单位体积内n总↑T不变,活%不变→有效碰撞↑→ν↑分析:注意:a.此规律只适用于气体或溶液的反应,对于纯固体或液体的反应物,一般情况下其浓度是常数,因此改变它们的量一般不会改变化学反应速率。 b.一般来说,固体反应物表面积越大,反应速率越大,固体反应物表面积越小,反应速率越小。c.随着化学反应的进行,反应物的浓度会逐渐减小,因此一般反应速率也会逐渐减小。1.一定条件下,在CaCO3(块状)+2HCl=CaCl2+H2O+CO2的反应中,为了加快反应的速率,下列那些方法可行:
A、增加HCl的浓度 B、加水
C、增加同浓度盐酸的量 D、改加CaCO3粉末 AD2.如反应:3KSCN+FeCl3 =Fe(SCN)3+3KCl
若在上述反应体系中加入KCl晶体,会不会影响化学反应速率?不会3.
10mL、6mol/L硫酸与过量锌粉反应,在一定温度下,为了减慢反应的速率,但又不影响生成H2的总量,可向反应物中加入适量的( )
A、碳酸钠固体 B、水
C、硫酸钾溶液 D、氢氧化钠固体BC2.压强:请试根据浓度对化学反应速率的影响推出压强对化学反应速率的影响情况 其他条件不变,压强增大,体积缩小,化学反应速率加快。其他条件不变气体的压强增大气体浓度增大反应速率加快气体体积减小注意:压强增大→ 体积减小
其他条件不变规律:对于有气体参加的反应,若其他条件不变,压强对于反应速率的影响是通过对浓度的影响实现的
p增大→c成比例增大,p减小→c成比例减小1、压强对反应速率的影响仅适用于有气体参加的反应。2、由于固体、液体粒子间的空隙很小,增大压强几乎不能改变它们的浓度,因此对只有固体或液体参加的反应,压强的变化对于反应速率的影响可以忽略不计。分析:→ν↑→C活增大3.在N2+3H2 2NH3中,当其他外界条件不变时?减小体系压强,该反应的速率怎么变??在反应中保持体系容积不变,充入N2 ,反应的速率怎么变??在反应中保持体系容积不变,充入He,反应的速率怎么变??在反应中保持体系压强不变,充入He,反应的速率怎么变? 压强影响反应速率,必须伴随有压强改变时体积的改变现象。否则,压强的变化并没有作用到反应的体系上。即压强变则体积变,实际是浓度的变化。若容器的体积不变,因为各气体的浓度没有变,则速率不变。如在密闭容器中通入惰性气体。注意:对于气体有下列几种情况:1、恒温时:增大压强→体积减少→C增大→反应速率增大。2、恒容时:3、恒压时:冲入“无关气体”(如He等)→引起体积增大, →各反应物浓度减少→反应速率减慢。注意:压强对反应速率的影响应看是否改变了气体反应物的浓度。A、充入气体反应物→反应物浓度增大→总压增大→反应速率增大;B、冲入“无关气体”(如He、N2等)→引起总压增大,但各反应物的分压不变,各物质的浓度不变→反应速率不变练习4:
对于反应N2+O2=2NO在密闭容器中进行,下列条件哪些不能加快该反应的化学反应速率( )
A、缩小体积使压强增大
B、体积不变充入 N2 使压强增大
C、体积不变充入 O2使压强增大
D、使体积增大到原来的2倍
E、体积不变充入氦气使压强增大DE3.温度:实验2-3Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O实验2-3结论:其他条件不变,温度升高,反应速率加快1、规律:其他条件不变时,升高温度,反应速率增大;降低温度,反应速率减小。实验测得:温度每升高10℃,反应速率通常增大到原来的2~4倍。本质原因升高温度,一部分非活化分子吸收能量转化为活化分子,使得活化分子百分数提高,活化分子间的有效碰撞频率变大,故反应速率增大。次要原因:温度升高,分子的运动速度加快,能量较高的分子之间碰撞频率随之提高。1、其他条件不变,温度升高,反应速率加快→ C活↑2、温度对反应速率影响的规律,对吸热反应,放热反应都适用。3、反应若是可逆反应,升高温度,正、逆反应速率都加快,降低温度,正、逆反应速率都减小。T↑普通分子变为活化分子活%↑→V↑→有效碰撞↑N总一定→→把除去氧化膜的 Mg 条,投入到盛有稀盐酸的试管中,发现 H2 的产生速率(v)与时间(t)的变化情况如右图所示,
t1 ~ t2 速率变化的主要原因是: _______ ;
t2 ~ t3 速率变化的主要原因是:_________。4.催化剂:实验2-4结论:加入催化剂可以加快反应的速率实验2-4使用催化剂,能够降低反应所需的能量,这样会使更多的反应物的分子成为活化分子,大大增加单位体积内反应物分子中活化分子所占的百分数。因而使反应速率加快。催化剂:能改变化学反应速率而自身的化学组成和质量在反应前后保持不变加快化学反应速率减慢化学反应速率注:不说明指正催化剂使用催化剂→降低反应所需活化能活%↑有效碰撞↑→V↑N总一定→C活↑→→能量反应过程E1E2反应物生成物活化分子活化能活化分子变成生成物分子放出的能量反应热没加催化剂加了催化剂 ?催化剂是能改变反应速率而自身在反应前后化学性质和质量没有发生变化的物质。
?使用催化剂同等程度的改变正逆反应速率。
?催化剂一定的具有选择性和高效性。
?催化剂只能催化可能发生的反应,对不发生的反应无作用
?催化剂中毒:催化剂的活性因接触少量的杂质而明显下降甚至遭到破坏,这种现象叫催化剂中毒。注意:5.其他如光照、反应物固体的颗粒大小、电磁波、超声波、溶剂的性质等,也会对化学反应的速率产生影响。 下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是( )
A、增大浓度 B、增大压强 C、升高温度 D、使用催化剂D各条件对速率的影响大小是:
催化剂 >>温度>浓度=压强(体积变化引起的)
各种影响都有其局限性,要针对具体反应具体分析。总结:练习1.下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是( )
A.增大浓度 B.增大压强
C.升高温度 D.使用催化剂B练习2. 设C+CO2 2CO(正反应吸热)反应速率为v1;N2+3H2 2NH3(正反应放热)反应速率为v2。对于前述反应,当温度升高时,v1和v2变化情况为( )
A、同时增大 B、 同时减小
C、 v1减少,v2增大 D、 v1增大,v2减小A外界条件对化学反应速率的影响(总结)增多增多不变 增多不变不变不变 增多不变增多增多 增多加快加快加快增加增加 增加不变增多 增加 增加增加加快练习3.①.增大反应物的浓度使反应速率加快的主要原因( )
②.对于气体参与体系增大压强使反应速率加快的主要原因是( )
③.升高温度使反应速率加快的主要原因是( )
④.使用催化剂使反应速率加快的主要原因是( )
A、活化分子百分数不变,但提高单位体积内活化分子的总数
B、 增大分子的运动速率而使有效碰撞增加
C、 升高反应物分子的能量,使活化分子的百分数增加
D、降低反应所需的能量,使活化分子百分数增加AACD练习4.将一定浓度的盐酸倒入碳酸钙中,若作如下改变的情况,其中能使最初的化学反应速率增大的是 ( )
A.盐酸的浓度不变,而使盐酸的用量一倍
B.盐酸的浓度增大一倍,而使盐酸的用量减少到原来的一半
C.盐酸的浓度和用量都不变,增加碳酸钙的量
D.盐酸和碳酸钙不变,增大压强一倍
E.加入CaCl2溶液
F.加入CaCl2固体
G.将CaCO3用CaCO3粉末代替BG练习5.硫代硫酸钠(Na2S2O3)与稀硫酸发生如下反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O下列四种情况中最早出现浑浊的是:( )
A. 10℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4各 5 mL
B. 10℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4 各5 mL,加水10mL
C . 20℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4各 5 mL
D. 20℃ 时0.2mol /L Na2S2O3和0.1 mol /L H2SO4各5 mL,加水10 mLC谢谢观赏!
影响化学反应速率的因素一辆汽车行驶速率的决定因素是什么?影响因素是什么?
决定因素是:汽车的性能(如QQ和宝马)
影响因素:⑴天气
⑵路况
⑶燃料质量
⑷司机的驾驶水平和经验
……想一想?有效碰撞理论回顾化学反应发生的先决条件是反应物分子必须发生碰撞;但不是任何两种反应物分子之间的碰撞都能发生反应,只有少数分子的碰撞能发生反应,这种能够发生化学反应的碰撞称为有效碰撞。活化分子:活化能:活化分子比普通分子高的能量, 符号Ea。
单位 : kJ·mol-1 活化分子间的碰撞 为有效碰撞。能够发生有效碰撞的分子。不一定能量反应过程E1E2反应物生成物活化分子活化能活化分子变成生成物分子放出的能量该反应是吸热反应还是放热反应?活化能与反应热有关吗?反应热普通
分子活化
能活化
分子合理
取向的
碰撞有效
碰撞一个反应经历的过程:回顾⑤.相同条件下,Ea越大,活化分子百分数(f) ,反应 。反之,Ea越小,f ,反应 。小知识:①.某一化学反应的速率大小与单位时间内 有关。③.活化分子百分数: (活化分子数/反应物分子总数)×100%②.Ea的大小与反应物本性(物质的分子结构、化学键)有关。④.在一定条件下(P、T一定),反应物中活化分子的百分数为定值。N活=N总×活%有效碰撞的次数 越小越慢越大越快反应物本身的性质活化能的大小单位体积内活化分子的多少单位时间内有效碰撞次数的多少化学反应速率的快慢内 因外 因影响化学反应速率的因素一.内部因素(主要因素)参加反应物质的性质二.外部因素1.浓度:(实验2-2)实验2-2结论:浓度大的H2C2O4(aq)先褪色。在其他条件不变时,增大反应物浓度,可以增大反应速率。2KMnO4 + 5H2C2O4 +3H2SO4=K2SO4 +2MnSO4 +10CO2↑+8H2O实验原理:规律:其他条件不变时,增大反应物的浓度,可以增大反应速率;减小反应物的浓度,可以减小化学反应的速率。(P、T一定时:C反应物↑,ν↑ C反应物↓,ν↓)本质原因反应物浓度增大,单位体积内活化分子数增多,有效碰撞的频率增加,反应速率增大。浓度增大→单位体积内n总↑T不变,活%不变→有效碰撞↑→ν↑分析:注意:a.此规律只适用于气体或溶液的反应,对于纯固体或液体的反应物,一般情况下其浓度是常数,因此改变它们的量一般不会改变化学反应速率。 b.一般来说,固体反应物表面积越大,反应速率越大,固体反应物表面积越小,反应速率越小。c.随着化学反应的进行,反应物的浓度会逐渐减小,因此一般反应速率也会逐渐减小。1.一定条件下,在CaCO3(块状)+2HCl=CaCl2+H2O+CO2的反应中,为了加快反应的速率,下列那些方法可行:
A、增加HCl的浓度 B、加水
C、增加同浓度盐酸的量 D、改加CaCO3粉末 AD2.如反应:3KSCN+FeCl3 =Fe(SCN)3+3KCl
若在上述反应体系中加入KCl晶体,会不会影响化学反应速率?不会3.
10mL、6mol/L硫酸与过量锌粉反应,在一定温度下,为了减慢反应的速率,但又不影响生成H2的总量,可向反应物中加入适量的( )
A、碳酸钠固体 B、水
C、硫酸钾溶液 D、氢氧化钠固体BC2.压强:请试根据浓度对化学反应速率的影响推出压强对化学反应速率的影响情况 其他条件不变,压强增大,体积缩小,化学反应速率加快。其他条件不变气体的压强增大气体浓度增大反应速率加快气体体积减小注意:压强增大→ 体积减小
其他条件不变规律:对于有气体参加的反应,若其他条件不变,压强对于反应速率的影响是通过对浓度的影响实现的
p增大→c成比例增大,p减小→c成比例减小1、压强对反应速率的影响仅适用于有气体参加的反应。2、由于固体、液体粒子间的空隙很小,增大压强几乎不能改变它们的浓度,因此对只有固体或液体参加的反应,压强的变化对于反应速率的影响可以忽略不计。分析:→ν↑→C活增大3.在N2+3H2 2NH3中,当其他外界条件不变时?减小体系压强,该反应的速率怎么变??在反应中保持体系容积不变,充入N2 ,反应的速率怎么变??在反应中保持体系容积不变,充入He,反应的速率怎么变??在反应中保持体系压强不变,充入He,反应的速率怎么变? 压强影响反应速率,必须伴随有压强改变时体积的改变现象。否则,压强的变化并没有作用到反应的体系上。即压强变则体积变,实际是浓度的变化。若容器的体积不变,因为各气体的浓度没有变,则速率不变。如在密闭容器中通入惰性气体。注意:对于气体有下列几种情况:1、恒温时:增大压强→体积减少→C增大→反应速率增大。2、恒容时:3、恒压时:冲入“无关气体”(如He等)→引起体积增大, →各反应物浓度减少→反应速率减慢。注意:压强对反应速率的影响应看是否改变了气体反应物的浓度。A、充入气体反应物→反应物浓度增大→总压增大→反应速率增大;B、冲入“无关气体”(如He、N2等)→引起总压增大,但各反应物的分压不变,各物质的浓度不变→反应速率不变练习4:
对于反应N2+O2=2NO在密闭容器中进行,下列条件哪些不能加快该反应的化学反应速率( )
A、缩小体积使压强增大
B、体积不变充入 N2 使压强增大
C、体积不变充入 O2使压强增大
D、使体积增大到原来的2倍
E、体积不变充入氦气使压强增大DE3.温度:实验2-3Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O实验2-3结论:其他条件不变,温度升高,反应速率加快1、规律:其他条件不变时,升高温度,反应速率增大;降低温度,反应速率减小。实验测得:温度每升高10℃,反应速率通常增大到原来的2~4倍。本质原因升高温度,一部分非活化分子吸收能量转化为活化分子,使得活化分子百分数提高,活化分子间的有效碰撞频率变大,故反应速率增大。次要原因:温度升高,分子的运动速度加快,能量较高的分子之间碰撞频率随之提高。1、其他条件不变,温度升高,反应速率加快→ C活↑2、温度对反应速率影响的规律,对吸热反应,放热反应都适用。3、反应若是可逆反应,升高温度,正、逆反应速率都加快,降低温度,正、逆反应速率都减小。T↑普通分子变为活化分子活%↑→V↑→有效碰撞↑N总一定→→把除去氧化膜的 Mg 条,投入到盛有稀盐酸的试管中,发现 H2 的产生速率(v)与时间(t)的变化情况如右图所示,
t1 ~ t2 速率变化的主要原因是: _______ ;
t2 ~ t3 速率变化的主要原因是:_________。4.催化剂:实验2-4结论:加入催化剂可以加快反应的速率实验2-4使用催化剂,能够降低反应所需的能量,这样会使更多的反应物的分子成为活化分子,大大增加单位体积内反应物分子中活化分子所占的百分数。因而使反应速率加快。催化剂:能改变化学反应速率而自身的化学组成和质量在反应前后保持不变加快化学反应速率减慢化学反应速率注:不说明指正催化剂使用催化剂→降低反应所需活化能活%↑有效碰撞↑→V↑N总一定→C活↑→→能量反应过程E1E2反应物生成物活化分子活化能活化分子变成生成物分子放出的能量反应热没加催化剂加了催化剂 ?催化剂是能改变反应速率而自身在反应前后化学性质和质量没有发生变化的物质。
?使用催化剂同等程度的改变正逆反应速率。
?催化剂一定的具有选择性和高效性。
?催化剂只能催化可能发生的反应,对不发生的反应无作用
?催化剂中毒:催化剂的活性因接触少量的杂质而明显下降甚至遭到破坏,这种现象叫催化剂中毒。注意:5.其他如光照、反应物固体的颗粒大小、电磁波、超声波、溶剂的性质等,也会对化学反应的速率产生影响。 下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是( )
A、增大浓度 B、增大压强 C、升高温度 D、使用催化剂D各条件对速率的影响大小是:
催化剂 >>温度>浓度=压强(体积变化引起的)
各种影响都有其局限性,要针对具体反应具体分析。总结:练习1.下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是( )
A.增大浓度 B.增大压强
C.升高温度 D.使用催化剂B练习2. 设C+CO2 2CO(正反应吸热)反应速率为v1;N2+3H2 2NH3(正反应放热)反应速率为v2。对于前述反应,当温度升高时,v1和v2变化情况为( )
A、同时增大 B、 同时减小
C、 v1减少,v2增大 D、 v1增大,v2减小A外界条件对化学反应速率的影响(总结)增多增多不变 增多不变不变不变 增多不变增多增多 增多加快加快加快增加增加 增加不变增多 增加 增加增加加快练习3.①.增大反应物的浓度使反应速率加快的主要原因( )
②.对于气体参与体系增大压强使反应速率加快的主要原因是( )
③.升高温度使反应速率加快的主要原因是( )
④.使用催化剂使反应速率加快的主要原因是( )
A、活化分子百分数不变,但提高单位体积内活化分子的总数
B、 增大分子的运动速率而使有效碰撞增加
C、 升高反应物分子的能量,使活化分子的百分数增加
D、降低反应所需的能量,使活化分子百分数增加AACD练习4.将一定浓度的盐酸倒入碳酸钙中,若作如下改变的情况,其中能使最初的化学反应速率增大的是 ( )
A.盐酸的浓度不变,而使盐酸的用量一倍
B.盐酸的浓度增大一倍,而使盐酸的用量减少到原来的一半
C.盐酸的浓度和用量都不变,增加碳酸钙的量
D.盐酸和碳酸钙不变,增大压强一倍
E.加入CaCl2溶液
F.加入CaCl2固体
G.将CaCO3用CaCO3粉末代替BG练习5.硫代硫酸钠(Na2S2O3)与稀硫酸发生如下反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O下列四种情况中最早出现浑浊的是:( )
A. 10℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4各 5 mL
B. 10℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4 各5 mL,加水10mL
C . 20℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4各 5 mL
D. 20℃ 时0.2mol /L Na2S2O3和0.1 mol /L H2SO4各5 mL,加水10 mLC谢谢观赏!
