人教版高中化学必修二1.3《化学键》课件(共27张PPT)
文档属性
| 名称 | 人教版高中化学必修二1.3《化学键》课件(共27张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 494.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-21 00:00:00 | ||
图片预览





文档简介
课件27张PPT。第三节化学键你有想过吗?
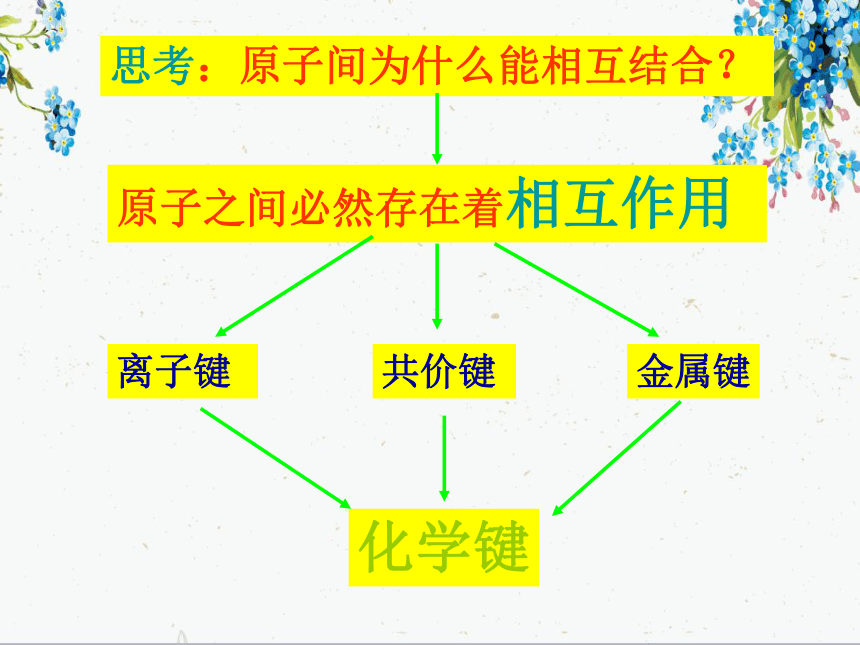
化学键思考:原子间为什么能相互结合?原子之间必然存在着相互作用离子键共价键金属键2.物质中原子为什么总是按一定数目相结合?
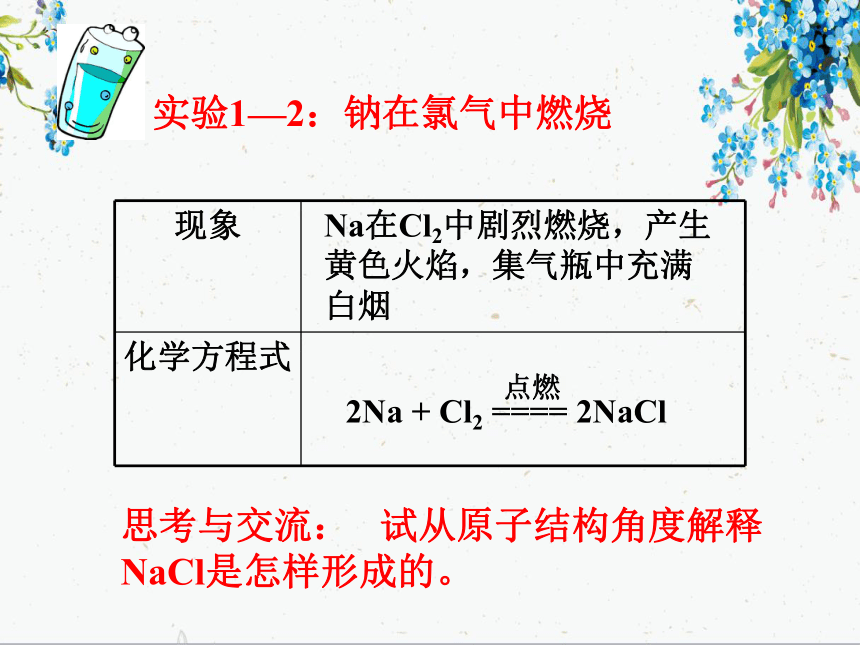
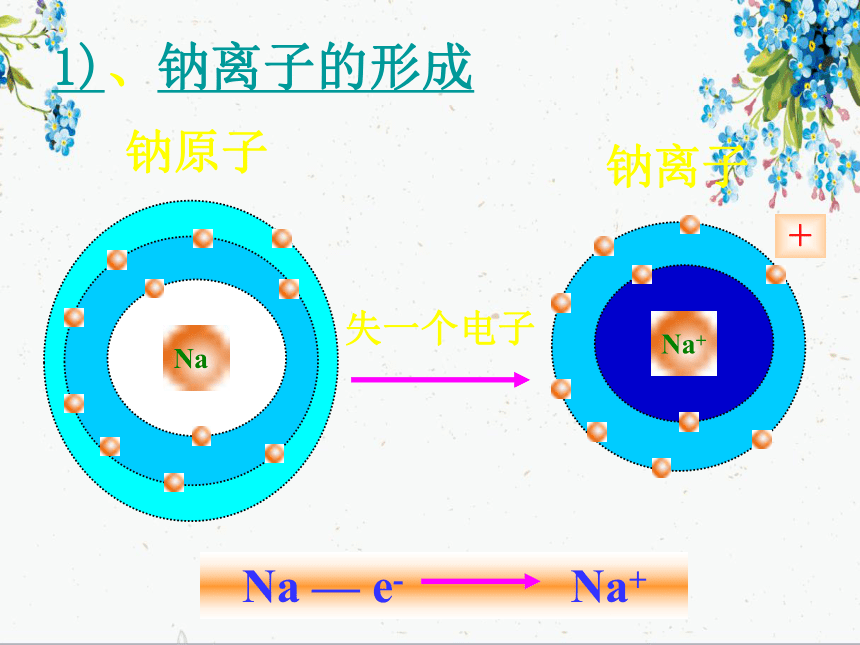
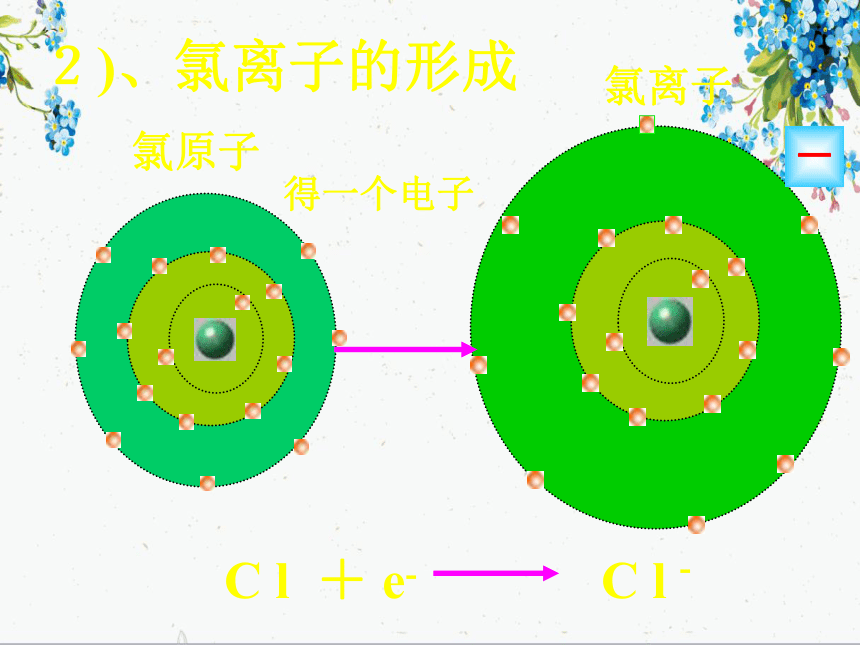
实验1—2:钠在氯气中燃烧Na在Cl2中剧烈燃烧,产生黄色火焰,集气瓶中充满白烟思考与交流: 试从原子结构角度解释NaCl是怎样形成的。失一个电子钠原子钠离子+NaNa+1)、钠离子的形成2)、氯离子的形成得一个电子氯原子氯离子-氯化钠的形成氯化钠的形成思考在氯化钠晶体中,Na+和Cl- 间存在哪些力? Na+离子和Cl-离子原子核和核外电子之间的静电相互吸引作用当阴阳离子接近到某一定距离时,吸引和排斥作用
达到平衡,阴阳离子间形成稳定的化学键。 阴阳离子间电子与电子、原子核与原子核间的相互排斥作用定义: 使阴阳离子结合成化合物的静电作用,叫做离子键。1、成键微粒:2、成键本质:3、成键过程:一、离子键[归纳与整理] 思考 哪些粒子能形成离子键?4、形成离子键的条件: 1)、活泼的金属元素(IA,IIA)和活泼的非金属
元素(VIA,VIIA)之间的化合物。阴阳离子静电作用(静电引力和斥力)阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。
2)、 活泼的金属元素和酸根离子形成的盐3)、铵根离子和酸根离子(或活泼非金属元素)形成的盐。酸根离子:SO42-、NO3-、Cl-等把NH4+看作是活泼的金属阳离子[归纳与整理] 5.成键原因
a 原子相互得失电子形成稳定的阴、阳离子。
b 离子间吸引和排斥处于平衡状态。
C 体系的总能量降低。
6、离子化合物 一般来说活泼金属 和活泼非金属 之间可形成离子化合物(简单离子化合物)。 从结构上说,形成离子化合物的金属元素原子最外层一般为1或2个电子;非金属元素原子一般为6或7个电子。通过离子键而形成的化合物叫离子化合物。IA 和 IIA族 VIA和VIIA族1、下列说法正确的是( )
A.含有金属元素的化合物一定是离子化合物
B.第IA族和第VIIA族原子化合时,一定生成离子键
C.由非金属元素形成的化合物一定不是离子化合物
D.活泼金属与非金属化合时,能形成离子键D课堂练习二、表示方法在元素符号周围用小黑点或小叉表示最外层电子的式子叫电子式H ·Na · ·Mg · ·Ca · 1、原子的电子式: 2、离子的电子式:H+Na+Mg2+Ca2+[归纳与整理] (1)原子的电子式:常把其最外层电子数用小黑点“.”或小叉“×”来表示。(2)阳离子的电子式:不要求画出离子最外层电子数,只要在元素、符号右上角标出“n+”电荷字样。(3)阴离子的电子式:不但要画出最外层电子数,而且还应用于括号“[ ]”括起来,并在右上角标出“n·-”电荷字样。电子式[归纳与整理] [ 练习] 写出下列微粒的电子式:
硫原子、 溴原子、 硫离子、溴离子、铝离子用电子式可以直观地看到原子结构特点与键之间的关系。表示出原子之间是怎样结合的Al3+3、离子化合物的电子式:由阴、阳离子的电子式组成,但对相同离子不能合并AB型AB2型A2B型[课堂练习] KBr CaCl2 K2O4、用 电子式 表示 离子化合物 的 形成过程 用电子式表示氯化钠的形成过程 用电子式表示溴化钙的形成过程 注意点1 离子须注明电荷数;2 相同的原子可以合并写,相同的离子要单个写;3.阴离子要用方括号括起;4.不能把 “→”写成 “ ==”5.用箭头表明电子转移方向(也可不标)[ 练习] ⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程 箭头左方相同的微粒可以合并,
箭头右方相同的微粒不可以合并。注
意课堂练习练习3、下列说法正确的是:
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠原子与氯原子结合成氯化钠后体系能量降低 ( D )练习4、下列各数值表示有关元素的原子序数,能形成 AB2型离子化合物的是:
A.6与8 B.11与13 C. 11与16 D.12与17( D )放热反应小结一、离子键:
1、定义:使阴阳离子结合成化合物的静电作用,叫做离子键。
2、形成离子键的条件:
3、离子化合物:含有离子键的化合物
二、电子式
化学键思考:原子间为什么能相互结合?原子之间必然存在着相互作用离子键共价键金属键2.物质中原子为什么总是按一定数目相结合?
实验1—2:钠在氯气中燃烧Na在Cl2中剧烈燃烧,产生黄色火焰,集气瓶中充满白烟思考与交流: 试从原子结构角度解释NaCl是怎样形成的。失一个电子钠原子钠离子+NaNa+1)、钠离子的形成2)、氯离子的形成得一个电子氯原子氯离子-氯化钠的形成氯化钠的形成思考在氯化钠晶体中,Na+和Cl- 间存在哪些力? Na+离子和Cl-离子原子核和核外电子之间的静电相互吸引作用当阴阳离子接近到某一定距离时,吸引和排斥作用
达到平衡,阴阳离子间形成稳定的化学键。 阴阳离子间电子与电子、原子核与原子核间的相互排斥作用定义: 使阴阳离子结合成化合物的静电作用,叫做离子键。1、成键微粒:2、成键本质:3、成键过程:一、离子键[归纳与整理] 思考 哪些粒子能形成离子键?4、形成离子键的条件: 1)、活泼的金属元素(IA,IIA)和活泼的非金属
元素(VIA,VIIA)之间的化合物。阴阳离子静电作用(静电引力和斥力)阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。
2)、 活泼的金属元素和酸根离子形成的盐3)、铵根离子和酸根离子(或活泼非金属元素)形成的盐。酸根离子:SO42-、NO3-、Cl-等把NH4+看作是活泼的金属阳离子[归纳与整理] 5.成键原因
a 原子相互得失电子形成稳定的阴、阳离子。
b 离子间吸引和排斥处于平衡状态。
C 体系的总能量降低。
6、离子化合物 一般来说活泼金属 和活泼非金属 之间可形成离子化合物(简单离子化合物)。 从结构上说,形成离子化合物的金属元素原子最外层一般为1或2个电子;非金属元素原子一般为6或7个电子。通过离子键而形成的化合物叫离子化合物。IA 和 IIA族 VIA和VIIA族1、下列说法正确的是( )
A.含有金属元素的化合物一定是离子化合物
B.第IA族和第VIIA族原子化合时,一定生成离子键
C.由非金属元素形成的化合物一定不是离子化合物
D.活泼金属与非金属化合时,能形成离子键D课堂练习二、表示方法在元素符号周围用小黑点或小叉表示最外层电子的式子叫电子式H ·Na · ·Mg · ·Ca · 1、原子的电子式: 2、离子的电子式:H+Na+Mg2+Ca2+[归纳与整理] (1)原子的电子式:常把其最外层电子数用小黑点“.”或小叉“×”来表示。(2)阳离子的电子式:不要求画出离子最外层电子数,只要在元素、符号右上角标出“n+”电荷字样。(3)阴离子的电子式:不但要画出最外层电子数,而且还应用于括号“[ ]”括起来,并在右上角标出“n·-”电荷字样。电子式[归纳与整理] [ 练习] 写出下列微粒的电子式:
硫原子、 溴原子、 硫离子、溴离子、铝离子用电子式可以直观地看到原子结构特点与键之间的关系。表示出原子之间是怎样结合的Al3+3、离子化合物的电子式:由阴、阳离子的电子式组成,但对相同离子不能合并AB型AB2型A2B型[课堂练习] KBr CaCl2 K2O4、用 电子式 表示 离子化合物 的 形成过程 用电子式表示氯化钠的形成过程 用电子式表示溴化钙的形成过程 注意点1 离子须注明电荷数;2 相同的原子可以合并写,相同的离子要单个写;3.阴离子要用方括号括起;4.不能把 “→”写成 “ ==”5.用箭头表明电子转移方向(也可不标)[ 练习] ⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程 箭头左方相同的微粒可以合并,
箭头右方相同的微粒不可以合并。注
意课堂练习练习3、下列说法正确的是:
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠原子与氯原子结合成氯化钠后体系能量降低 ( D )练习4、下列各数值表示有关元素的原子序数,能形成 AB2型离子化合物的是:
A.6与8 B.11与13 C. 11与16 D.12与17( D )放热反应小结一、离子键:
1、定义:使阴阳离子结合成化合物的静电作用,叫做离子键。
2、形成离子键的条件:
3、离子化合物:含有离子键的化合物
二、电子式
