人教版九年级化学第八单元课题二《金属的化学性质》(第1课时)教学设计
文档属性
| 名称 | 人教版九年级化学第八单元课题二《金属的化学性质》(第1课时)教学设计 |

|
|
| 格式 | zip | ||
| 文件大小 | 30.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-21 00:00:00 | ||
图片预览

文档简介
《金属的化学性质》(第1课时)教学设计
一、教学目标
(一)知识与技能
1.知道镁、锌、铁、铜等常见金属能与氧气反应,并能根据反应的难易程度判断金属的的活泼性。
2.初步认识常见金属与盐酸、硫酸的反应, 并能根据反应的剧烈程度判断金属的的活泼性。
(二)过程与方法
1.通过演示实验、自主阅读、复习、联系生活等方法学习金属与氧气的反应;通过对比金属与氧气反应的条件判断金属的活泼性。
2.通过探究实验学习金属和稀盐酸、稀硫酸的反应;并通过对比反应的剧烈程度判断金属活动性顺序。
(三)情感态度与价值观
1.通过五彩缤纷的化学现象的观察,激发学生好奇心和求知欲,发展学习化学的兴趣,体验学习的快乐。
2.培养学生合作意识以及勤于思考、勇于实践、严谨求实的科学精神。
3.了解化学与生活的密切联系,提高学生解决实际问题的能力。
二、教学重点
1.金属的化学性质:金属与氧气的反应;金属与盐酸、稀硫酸的反应。
2.根据反应的难易和剧烈程度判断金属的活动性。
三、教学难点
探究金属与盐酸、稀硫酸的反应,并判断金属活动性强弱。
四、教学准备
教学设备(投影仪,计算机)、镁棒、卫生纸、铁盒、打火机、酒精灯、坩埚钳、镊子、试管、试管架、稀盐酸、稀硫酸、镁带、锌粒、铁钉、铜丝、废液缸
五、教学过程
环节 教师活动 学生活动 设计意图
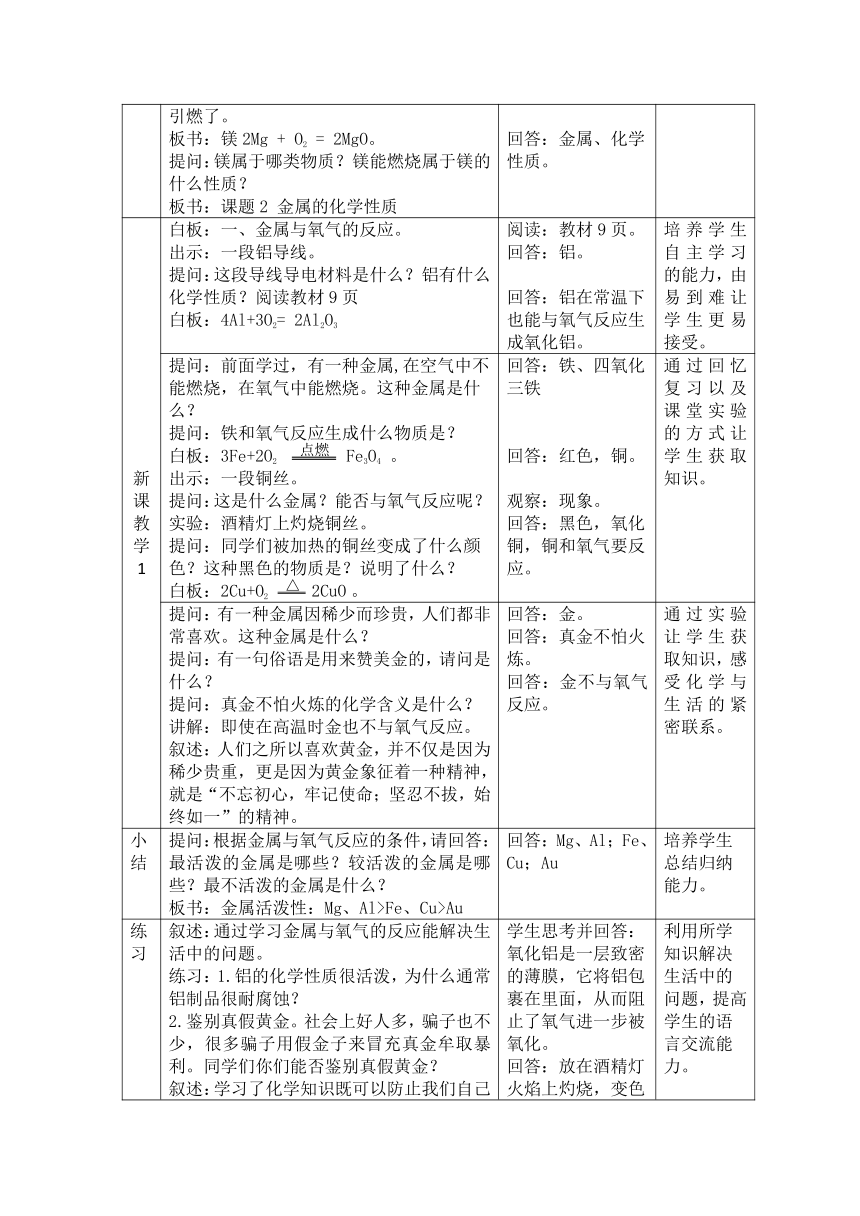
新课导入 出示:一团卫生纸。 提问:现在不用打火机和火柴,你们能把它点燃吗? 叙述:老师能,用这个点火神器。 实验:点火神器点火。 提问:点火神器是哪类物质?是那种金属? 讲解:镁粉的着火点很低,在摩擦时生热将镁粉点燃,镁粉燃烧放出高热,进而将纸给引燃了。 板书:镁2Mg + O2 = 2MgO。 提问:镁属于哪类物质?镁能燃烧属于镁的什么性质? 板书:课题2 金属的化学性质 回答:不能。 观察:现象。 回答:金属、镁。 回答:金属、化学性质。 通过镁棒生火实验激发学生兴趣。
新课教学 1 白板:一、金属与氧气的反应。 出示:一段铝导线。 提问:这段导线导电材料是什么?铝有什么化学性质?阅读教材9页 白板:4Al+3O2= 2Al2O3 阅读:教材9页。 回答:铝。 回答:铝在常温下也能与氧气反应生成氧化铝。 培养学生自主学习的能力,由易到难让学生更易接受。
提问:前面学过,有一种金属,在空气中不能燃烧,在氧气中能燃烧。这种金属是什么? (
点燃
)提问:铁和氧气反应生成什么物质是? 白板:3Fe+2O2 Fe3O4 。 出示:一段铜丝。 提问:这是什么金属?能否与氧气反应呢? 实验:酒精灯上灼烧铜丝。 (
△
)提问:同学们被加热的铜丝变成了什么颜色?这种黑色的物质是?说明了什么? 白板:2Cu+O2 2CuO 。 回答:铁、四氧化三铁 回答:红色,铜。 观察:现象。 回答:黑色,氧化铜,铜和氧气要反应。 通过回忆复习以及课堂实验的方式让学生获取知识。
提问:有一种金属因稀少而珍贵,人们都非常喜欢。这种金属是什么? 提问:有一句俗语是用来赞美金的,请问是什么? 提问:真金不怕火炼的化学含义是什么? 讲解:即使在高温时金也不与氧气反应。 叙述:人们之所以喜欢黄金,并不仅是因为稀少贵重,更是因为黄金象征着一种精神,就是“不忘初心,牢记使命;坚忍不拔,始终如一”的精神。 回答:金。 回答:真金不怕火炼。 回答:金不与氧气反应。 通过实验让学生获取知识,感受化学与生活的紧密联系。
小结 提问:根据金属与氧气反应的条件,请回答:最活泼的金属是哪些?较活泼的金属是哪些?最不活泼的金属是什么? 板书:金属活泼性:Mg、Al>Fe、Cu>Au 回答:Mg、Al;Fe、Cu;Au 培养学生总结归纳能力。
练习 叙述:通过学习金属与氧气的反应能解决生活中的问题。 练习:1.铝的化学性质很活泼,为什么通常铝制品很耐腐蚀? 2.鉴别真假黄金。社会上好人多,骗子也不少,很多骗子用假金子来冒充真金牟取暴利。同学们你们能否鉴别真假黄金? 叙述:学习了化学知识既可以防止我们自己上当受骗,还能揭穿骗子的把戏。 学生思考并回答:氧化铝是一层致密的薄膜,它将铝包裹在里面,从而阻止了氧气进一步被氧化。 回答:放在酒精灯火焰上灼烧,变色的是假黄金,不变色的是真金。 利用所学知识解决生活中的问题,提高学生的语言交流能力。
新课教学2 叙述:金属的第一条性质我们已经学习完了,接下来我们来学习金属的第二条性质。 提问:有一种气体,它燃烧不产生任何污染,这种气体是什么?在实验室是如何制备氢气的? 提问:锌属于哪一类物质?稀硫酸属于哪一类物质? 白板:金属与盐酸、稀硫酸的反应。 提问:是不是所有金属都能与盐酸、稀硫酸反应呢?如果要反应,反应现象是否相同? 回答:氢气;锌和稀硫酸反应来制备氢气。 回答:金属;酸。 思考问题 由已知到未知,进行知识的迁移,培养学生猜想能力。
叙述:金属与盐酸、稀硫酸的反应的探究就交由同学们自己来完成。 叙述:实验提供了四种金属、两种酸,需做8个实验。由于时间原因,我们分成盐酸组和硫酸组,各做4个实验。 讲解:在动手实验之前有几点需要注意: 1.酸有腐蚀性。实验时要注意什么? 2.注意用量。金属取2-3颗。酸是液体用量不超过多少?四个实验酸的用量能否相差太多? 3.注意观察实验现象,在书上记录现象完成相关化学反应方程式。 宣布:开始实验。 回答:注意安全,防止泼洒。 回答:1/3,不能。 动手实验:观察、记录实验现象,讨论化学方程式的书写。 明确实验任务,规范实验操作,注意实验安全。 培养学生实验操作、观察、分析能力。
叙述:请分享实验现象和实验结果。 叙述:请分享书写的化学反应方程式。 白板:展示化学方程式。 讲解:氢气是气体,要打气体符号;铁与盐酸、稀硫酸反应生成的是二价的亚铁离子。 分享实验现象:镁、锌、铁与盐酸、稀硫酸反应,产生气泡,镁产生气泡最快,锌产生气泡较快,铁产生气泡很慢。铜无明显现象。 修改:化学反应方程式。 培养学生交流、书写化学用语的能力。
小结 根据金属与酸反应的剧烈程度,请回答: 1.这四种金属的活动性由强到弱的顺序是? 2.通过以上实验,初步将金属分为两类。 板书:金属活动性:Mg>Zn>Fe>Cu 回答:活动性:镁>锌>铁>铜. 回答:活泼金属,不活泼金属。 培养学生分析问题和总结归纳能力。
练习 叙述:学习的最高境界是学习致用。 练习:运用金属与酸反应的性质解决下面问题。除去铜粉中少量的铁粉。除杂原理和操作分别是? 讲解:加入酸,充分反应,过滤,洗涤,干燥。 回答:原理:铁能盐酸、稀硫酸反应,而铜不能。 操作:在混合物中加入盐酸、稀硫酸充分反应。 利用所学知识解决实际问题,提高学生的语言表达能力。
课堂总结 通过今天的学习,你学到了哪些知识? 回答:1.大部分金属可以和氧气反应,金在高温下也不和氧气反应。 2.活泼金属能与盐酸、稀硫酸反应,不活泼金属不能与盐酸、稀硫酸反应。 3.根据反应的难易和剧烈程度可以判断金属的活泼性和活动性。
课堂练习 (
)练习:写出镁、铜、氧气、盐酸两两间能发生的发应的化学方程式。 (
△
)书写:2Mg+O2 2MgO (
)2Cu+O2 2CuO Mg+2HCl MgCl2+H2↑
六、板书设计
课题2 金属的化学性质
(
)金属+氧气
常温:2Mg+O2 2MgO
金属活泼性:镁、铝>铁、铜>金。
金属 + 酸
(
)Mg、Zn、Fe、Cu HCl、H2SO4
Zn+H2SO4 ZnSO4+H2↑
金属活动性:Mg>Zn>Fe>Cu
一、教学目标
(一)知识与技能
1.知道镁、锌、铁、铜等常见金属能与氧气反应,并能根据反应的难易程度判断金属的的活泼性。
2.初步认识常见金属与盐酸、硫酸的反应, 并能根据反应的剧烈程度判断金属的的活泼性。
(二)过程与方法
1.通过演示实验、自主阅读、复习、联系生活等方法学习金属与氧气的反应;通过对比金属与氧气反应的条件判断金属的活泼性。
2.通过探究实验学习金属和稀盐酸、稀硫酸的反应;并通过对比反应的剧烈程度判断金属活动性顺序。
(三)情感态度与价值观
1.通过五彩缤纷的化学现象的观察,激发学生好奇心和求知欲,发展学习化学的兴趣,体验学习的快乐。
2.培养学生合作意识以及勤于思考、勇于实践、严谨求实的科学精神。
3.了解化学与生活的密切联系,提高学生解决实际问题的能力。
二、教学重点
1.金属的化学性质:金属与氧气的反应;金属与盐酸、稀硫酸的反应。
2.根据反应的难易和剧烈程度判断金属的活动性。
三、教学难点
探究金属与盐酸、稀硫酸的反应,并判断金属活动性强弱。
四、教学准备
教学设备(投影仪,计算机)、镁棒、卫生纸、铁盒、打火机、酒精灯、坩埚钳、镊子、试管、试管架、稀盐酸、稀硫酸、镁带、锌粒、铁钉、铜丝、废液缸
五、教学过程
环节 教师活动 学生活动 设计意图
新课导入 出示:一团卫生纸。 提问:现在不用打火机和火柴,你们能把它点燃吗? 叙述:老师能,用这个点火神器。 实验:点火神器点火。 提问:点火神器是哪类物质?是那种金属? 讲解:镁粉的着火点很低,在摩擦时生热将镁粉点燃,镁粉燃烧放出高热,进而将纸给引燃了。 板书:镁2Mg + O2 = 2MgO。 提问:镁属于哪类物质?镁能燃烧属于镁的什么性质? 板书:课题2 金属的化学性质 回答:不能。 观察:现象。 回答:金属、镁。 回答:金属、化学性质。 通过镁棒生火实验激发学生兴趣。
新课教学 1 白板:一、金属与氧气的反应。 出示:一段铝导线。 提问:这段导线导电材料是什么?铝有什么化学性质?阅读教材9页 白板:4Al+3O2= 2Al2O3 阅读:教材9页。 回答:铝。 回答:铝在常温下也能与氧气反应生成氧化铝。 培养学生自主学习的能力,由易到难让学生更易接受。
提问:前面学过,有一种金属,在空气中不能燃烧,在氧气中能燃烧。这种金属是什么? (
点燃
)提问:铁和氧气反应生成什么物质是? 白板:3Fe+2O2 Fe3O4 。 出示:一段铜丝。 提问:这是什么金属?能否与氧气反应呢? 实验:酒精灯上灼烧铜丝。 (
△
)提问:同学们被加热的铜丝变成了什么颜色?这种黑色的物质是?说明了什么? 白板:2Cu+O2 2CuO 。 回答:铁、四氧化三铁 回答:红色,铜。 观察:现象。 回答:黑色,氧化铜,铜和氧气要反应。 通过回忆复习以及课堂实验的方式让学生获取知识。
提问:有一种金属因稀少而珍贵,人们都非常喜欢。这种金属是什么? 提问:有一句俗语是用来赞美金的,请问是什么? 提问:真金不怕火炼的化学含义是什么? 讲解:即使在高温时金也不与氧气反应。 叙述:人们之所以喜欢黄金,并不仅是因为稀少贵重,更是因为黄金象征着一种精神,就是“不忘初心,牢记使命;坚忍不拔,始终如一”的精神。 回答:金。 回答:真金不怕火炼。 回答:金不与氧气反应。 通过实验让学生获取知识,感受化学与生活的紧密联系。
小结 提问:根据金属与氧气反应的条件,请回答:最活泼的金属是哪些?较活泼的金属是哪些?最不活泼的金属是什么? 板书:金属活泼性:Mg、Al>Fe、Cu>Au 回答:Mg、Al;Fe、Cu;Au 培养学生总结归纳能力。
练习 叙述:通过学习金属与氧气的反应能解决生活中的问题。 练习:1.铝的化学性质很活泼,为什么通常铝制品很耐腐蚀? 2.鉴别真假黄金。社会上好人多,骗子也不少,很多骗子用假金子来冒充真金牟取暴利。同学们你们能否鉴别真假黄金? 叙述:学习了化学知识既可以防止我们自己上当受骗,还能揭穿骗子的把戏。 学生思考并回答:氧化铝是一层致密的薄膜,它将铝包裹在里面,从而阻止了氧气进一步被氧化。 回答:放在酒精灯火焰上灼烧,变色的是假黄金,不变色的是真金。 利用所学知识解决生活中的问题,提高学生的语言交流能力。
新课教学2 叙述:金属的第一条性质我们已经学习完了,接下来我们来学习金属的第二条性质。 提问:有一种气体,它燃烧不产生任何污染,这种气体是什么?在实验室是如何制备氢气的? 提问:锌属于哪一类物质?稀硫酸属于哪一类物质? 白板:金属与盐酸、稀硫酸的反应。 提问:是不是所有金属都能与盐酸、稀硫酸反应呢?如果要反应,反应现象是否相同? 回答:氢气;锌和稀硫酸反应来制备氢气。 回答:金属;酸。 思考问题 由已知到未知,进行知识的迁移,培养学生猜想能力。
叙述:金属与盐酸、稀硫酸的反应的探究就交由同学们自己来完成。 叙述:实验提供了四种金属、两种酸,需做8个实验。由于时间原因,我们分成盐酸组和硫酸组,各做4个实验。 讲解:在动手实验之前有几点需要注意: 1.酸有腐蚀性。实验时要注意什么? 2.注意用量。金属取2-3颗。酸是液体用量不超过多少?四个实验酸的用量能否相差太多? 3.注意观察实验现象,在书上记录现象完成相关化学反应方程式。 宣布:开始实验。 回答:注意安全,防止泼洒。 回答:1/3,不能。 动手实验:观察、记录实验现象,讨论化学方程式的书写。 明确实验任务,规范实验操作,注意实验安全。 培养学生实验操作、观察、分析能力。
叙述:请分享实验现象和实验结果。 叙述:请分享书写的化学反应方程式。 白板:展示化学方程式。 讲解:氢气是气体,要打气体符号;铁与盐酸、稀硫酸反应生成的是二价的亚铁离子。 分享实验现象:镁、锌、铁与盐酸、稀硫酸反应,产生气泡,镁产生气泡最快,锌产生气泡较快,铁产生气泡很慢。铜无明显现象。 修改:化学反应方程式。 培养学生交流、书写化学用语的能力。
小结 根据金属与酸反应的剧烈程度,请回答: 1.这四种金属的活动性由强到弱的顺序是? 2.通过以上实验,初步将金属分为两类。 板书:金属活动性:Mg>Zn>Fe>Cu 回答:活动性:镁>锌>铁>铜. 回答:活泼金属,不活泼金属。 培养学生分析问题和总结归纳能力。
练习 叙述:学习的最高境界是学习致用。 练习:运用金属与酸反应的性质解决下面问题。除去铜粉中少量的铁粉。除杂原理和操作分别是? 讲解:加入酸,充分反应,过滤,洗涤,干燥。 回答:原理:铁能盐酸、稀硫酸反应,而铜不能。 操作:在混合物中加入盐酸、稀硫酸充分反应。 利用所学知识解决实际问题,提高学生的语言表达能力。
课堂总结 通过今天的学习,你学到了哪些知识? 回答:1.大部分金属可以和氧气反应,金在高温下也不和氧气反应。 2.活泼金属能与盐酸、稀硫酸反应,不活泼金属不能与盐酸、稀硫酸反应。 3.根据反应的难易和剧烈程度可以判断金属的活泼性和活动性。
课堂练习 (
)练习:写出镁、铜、氧气、盐酸两两间能发生的发应的化学方程式。 (
△
)书写:2Mg+O2 2MgO (
)2Cu+O2 2CuO Mg+2HCl MgCl2+H2↑
六、板书设计
课题2 金属的化学性质
(
)金属+氧气
常温:2Mg+O2 2MgO
金属活泼性:镁、铝>铁、铜>金。
金属 + 酸
(
)Mg、Zn、Fe、Cu HCl、H2SO4
Zn+H2SO4 ZnSO4+H2↑
金属活动性:Mg>Zn>Fe>Cu
同课章节目录
