2019年秋沪教版九年级上学期化学 3.1 构成物质的基本微粒课件(共42张PPT)
文档属性
| 名称 | 2019年秋沪教版九年级上学期化学 3.1 构成物质的基本微粒课件(共42张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-21 19:22:27 | ||
图片预览









文档简介
课件42张PPT。第3章 物质构成的奥秘
第1节 构成物质的基本微粒绚丽多姿的物质一、微粒的性质湿衣服晾干;
远处闻到花香;
物质的挥发、溶解;
“酒香不怕巷子深”。
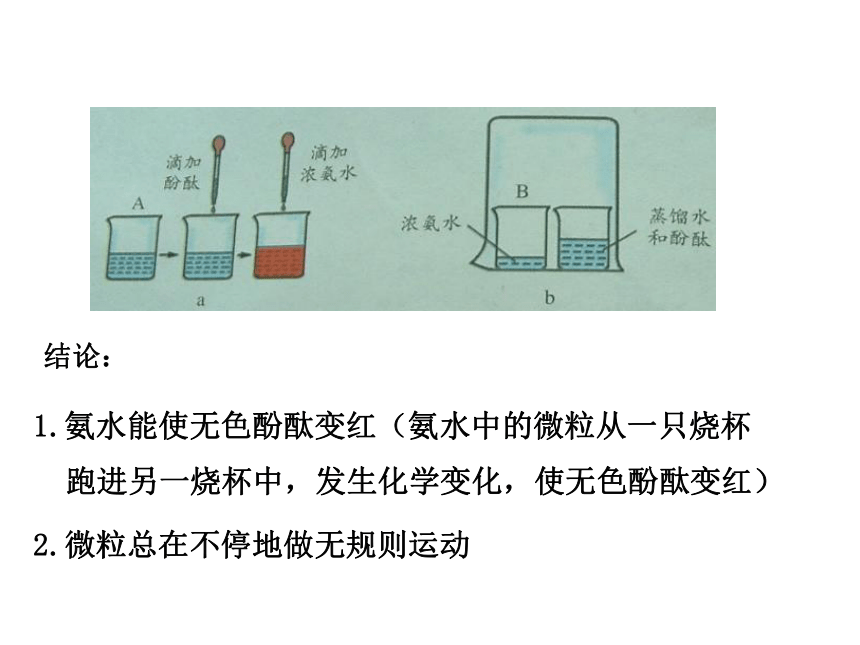
......结论:1.氨水能使无色酚酞变红(氨水中的微粒从一只烧杯跑进另一烧杯中,发生化学变化,使无色酚酞变红)
2.微粒总在不停地做无规则运动
3.微粒之间存在间隙 先用胶头滴管向玻璃管中加水,使其充满玻璃管容
积的二分之一,再用胶头滴管慢慢滴入酒精,使其充满
玻璃管。用手指堵紧开口的一端,颠倒数次。观察体积
是否变化。因为酒精微粒和水微粒分别填补了对方微粒
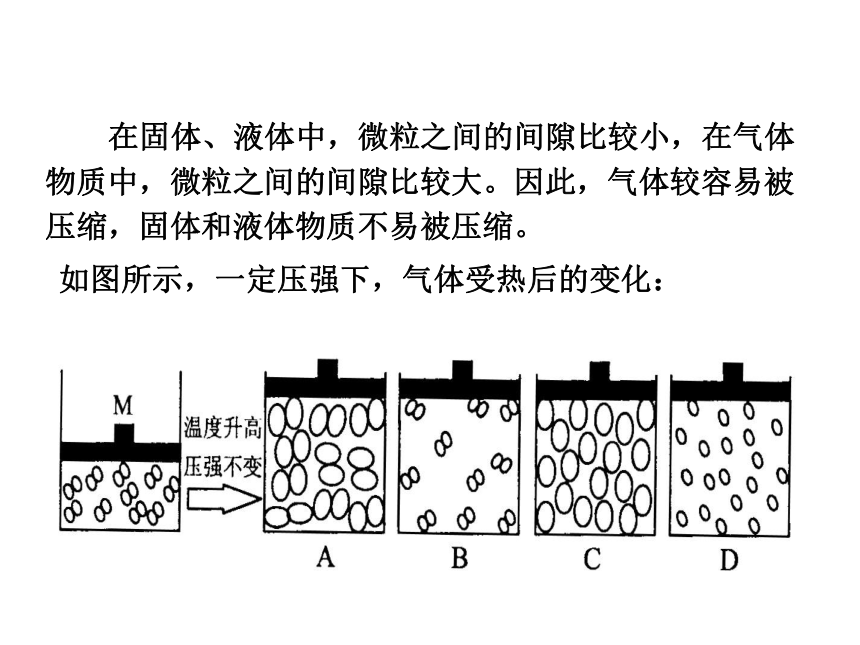
相互之间的空隙,从而使得总体积变小。固态固态 液态液态 气态物质状态的变化微观三维模拟动画 在固体、液体中,微粒之间的间隙比较小,在气体物质中,微粒之间的间隙比较大。因此,气体较容易被压缩,固体和液体物质不易被压缩。如图所示,一定压强下,气体受热后的变化:( 微粒本身没有变化 )物质的“固态、液态、气态的三态”变化实际上就是微粒之间的间隙发生改变的过程。构成物质的基本粒子有分子、原子和离子。二、分子阿伏伽德罗(意大利)提出了分子学说。分子是构成物质的一种微粒。氧气、水等大多数物质是由分子构成,而且它们的分子不同,导致性质不同。(一)定义分子是保持物质化学性质的最小微粒。(二)分子的性质1.分子很小(小)
2.分子不停地运动(动)
3.分子间有空隙(隙)可简记为“小东西”三、原子(一)定义:原子是化学变化中的最小微粒。原子学说创始人-道尔顿48个铁原
子的图像硅表面的
原子图像通过移动硅原子构成的文字原子操纵技术(二)性质1. 原子很小;
2. 原子不断地运动;
3. 原子间有间隙。分子与原子的比较在化学变化中,分子可以再分,而原子不可以再分。原子→分子→物质分子与原子的本质区别:①金属(铜、铁等)
②稀有气体(氦气、氩气等)③部分固态非金属由原子直接构成的物质(金刚石、石墨、磷等 )(三)原子的构成( 汤姆生发现电子 )质子中子电子原子核核外电子原子质子中子(每个电子带一个单位的负电荷)(每个质子带一个单位正电荷)(不带电)一个质子和一个电子所带的电量相等,电性相反。核电荷数=质子数=电子数,所以整个原子呈电中性。一个质子和一个中子的质量约相等。原子的质量主要集中在原子核上。相对原子质量=1个原子质量1个碳原子质量×1/12(2)相对原子质量的计算公式 以一种碳原子的质量的1/12 作为基准,其他原子的质量与这一基准的比,称为这种原子的相对原子质量。(1)概念: 相对原子质量(Ar)相对原子质量是个比值,单位是 一、符号是1四、 离子 (一)核外电子排布规律:2.离核越远,能量越高;3.每层最多可排2n2个电子;4.最外层不超过8 个电子。1.核外电子是分层排布的;质子数电子层该层电子数原子结构示意图元素金属元素原子:少于4个电子非金属元素原子:多于4个电子 稀有气体元素原子 :8个(He为2个)稳定结构在化学反应中易失电子在化学反应中易得电子NaNa+AlAl3+ClCl-SS2-元素化学性质与最外层电子数关系密切。 (在化学变化中,电中性的原子常会得到或失去电子而成为带电荷的微粒,这种带电荷的微粒称为离子。)(二)定义离子是带电荷的原子或原子团(三)分类阳离子阴离子Na+ Mg2+ NH4+ Cl- O2- CO32-原子阳离子阴离子失电子得电子失电子得电子原子中:质子数 电子数(原子不显电性)阳离子中:质子数 电子数(带正电)原子和离子的联系和区别阴离子中:质子数 电子数(带负电)= > <(四)离子结构示意图Na+Cl-(五)离子符号的意义: Mg2+一个镁离子带两
个单位的正电荷2表示两个镁离子一个镁离子由阴阳离子相互作用而形成的化合物。(六)离子化合物如:氯化钠等氯化钠由________________构成。氯离子和钠离子(七)分子、原子、离子与物质离子构成物质(如:钠原子)分子构成构成构成得到或失去电子原子(如:钠离子)(如:氧原子)(如:铜原子)(如:氧分子)(如:氧气)(如:铜)(如:氯化钠 ) 1999年度诺贝尔化学奖获得者哈迈德·泽维尔开创了“飞秒(10-15 S)化学”的新领域,使运用激光光谱技术观测化学反应时分子中原子的运动成为可能,你认为运用该技术不能观测到的是 ( )
A.氧分子的不规则运动
B.氧原子结合成氧分子的过程
C.氧分子分解成氧原子的过程
D.氧原子内部的质子、中子、电子的运动D同步练习:谢谢观赏~
第1节 构成物质的基本微粒绚丽多姿的物质一、微粒的性质湿衣服晾干;
远处闻到花香;
物质的挥发、溶解;
“酒香不怕巷子深”。
......结论:1.氨水能使无色酚酞变红(氨水中的微粒从一只烧杯跑进另一烧杯中,发生化学变化,使无色酚酞变红)
2.微粒总在不停地做无规则运动
3.微粒之间存在间隙 先用胶头滴管向玻璃管中加水,使其充满玻璃管容
积的二分之一,再用胶头滴管慢慢滴入酒精,使其充满
玻璃管。用手指堵紧开口的一端,颠倒数次。观察体积
是否变化。因为酒精微粒和水微粒分别填补了对方微粒
相互之间的空隙,从而使得总体积变小。固态固态 液态液态 气态物质状态的变化微观三维模拟动画 在固体、液体中,微粒之间的间隙比较小,在气体物质中,微粒之间的间隙比较大。因此,气体较容易被压缩,固体和液体物质不易被压缩。如图所示,一定压强下,气体受热后的变化:( 微粒本身没有变化 )物质的“固态、液态、气态的三态”变化实际上就是微粒之间的间隙发生改变的过程。构成物质的基本粒子有分子、原子和离子。二、分子阿伏伽德罗(意大利)提出了分子学说。分子是构成物质的一种微粒。氧气、水等大多数物质是由分子构成,而且它们的分子不同,导致性质不同。(一)定义分子是保持物质化学性质的最小微粒。(二)分子的性质1.分子很小(小)
2.分子不停地运动(动)
3.分子间有空隙(隙)可简记为“小东西”三、原子(一)定义:原子是化学变化中的最小微粒。原子学说创始人-道尔顿48个铁原
子的图像硅表面的
原子图像通过移动硅原子构成的文字原子操纵技术(二)性质1. 原子很小;
2. 原子不断地运动;
3. 原子间有间隙。分子与原子的比较在化学变化中,分子可以再分,而原子不可以再分。原子→分子→物质分子与原子的本质区别:①金属(铜、铁等)
②稀有气体(氦气、氩气等)③部分固态非金属由原子直接构成的物质(金刚石、石墨、磷等 )(三)原子的构成( 汤姆生发现电子 )质子中子电子原子核核外电子原子质子中子(每个电子带一个单位的负电荷)(每个质子带一个单位正电荷)(不带电)一个质子和一个电子所带的电量相等,电性相反。核电荷数=质子数=电子数,所以整个原子呈电中性。一个质子和一个中子的质量约相等。原子的质量主要集中在原子核上。相对原子质量=1个原子质量1个碳原子质量×1/12(2)相对原子质量的计算公式 以一种碳原子的质量的1/12 作为基准,其他原子的质量与这一基准的比,称为这种原子的相对原子质量。(1)概念: 相对原子质量(Ar)相对原子质量是个比值,单位是 一、符号是1四、 离子 (一)核外电子排布规律:2.离核越远,能量越高;3.每层最多可排2n2个电子;4.最外层不超过8 个电子。1.核外电子是分层排布的;质子数电子层该层电子数原子结构示意图元素金属元素原子:少于4个电子非金属元素原子:多于4个电子 稀有气体元素原子 :8个(He为2个)稳定结构在化学反应中易失电子在化学反应中易得电子NaNa+AlAl3+ClCl-SS2-元素化学性质与最外层电子数关系密切。 (在化学变化中,电中性的原子常会得到或失去电子而成为带电荷的微粒,这种带电荷的微粒称为离子。)(二)定义离子是带电荷的原子或原子团(三)分类阳离子阴离子Na+ Mg2+ NH4+ Cl- O2- CO32-原子阳离子阴离子失电子得电子失电子得电子原子中:质子数 电子数(原子不显电性)阳离子中:质子数 电子数(带正电)原子和离子的联系和区别阴离子中:质子数 电子数(带负电)= > <(四)离子结构示意图Na+Cl-(五)离子符号的意义: Mg2+一个镁离子带两
个单位的正电荷2表示两个镁离子一个镁离子由阴阳离子相互作用而形成的化合物。(六)离子化合物如:氯化钠等氯化钠由________________构成。氯离子和钠离子(七)分子、原子、离子与物质离子构成物质(如:钠原子)分子构成构成构成得到或失去电子原子(如:钠离子)(如:氧原子)(如:铜原子)(如:氧分子)(如:氧气)(如:铜)(如:氯化钠 ) 1999年度诺贝尔化学奖获得者哈迈德·泽维尔开创了“飞秒(10-15 S)化学”的新领域,使运用激光光谱技术观测化学反应时分子中原子的运动成为可能,你认为运用该技术不能观测到的是 ( )
A.氧分子的不规则运动
B.氧原子结合成氧分子的过程
C.氧分子分解成氧原子的过程
D.氧原子内部的质子、中子、电子的运动D同步练习:谢谢观赏~
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
