2019年秋沪教版九年级上学期化学 5.3 金属防护和废金属回收课件(19张PPT)
文档属性
| 名称 | 2019年秋沪教版九年级上学期化学 5.3 金属防护和废金属回收课件(19张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-21 19:28:27 | ||
图片预览






文档简介
课件19张PPT。第5章 金属的冶炼与利用
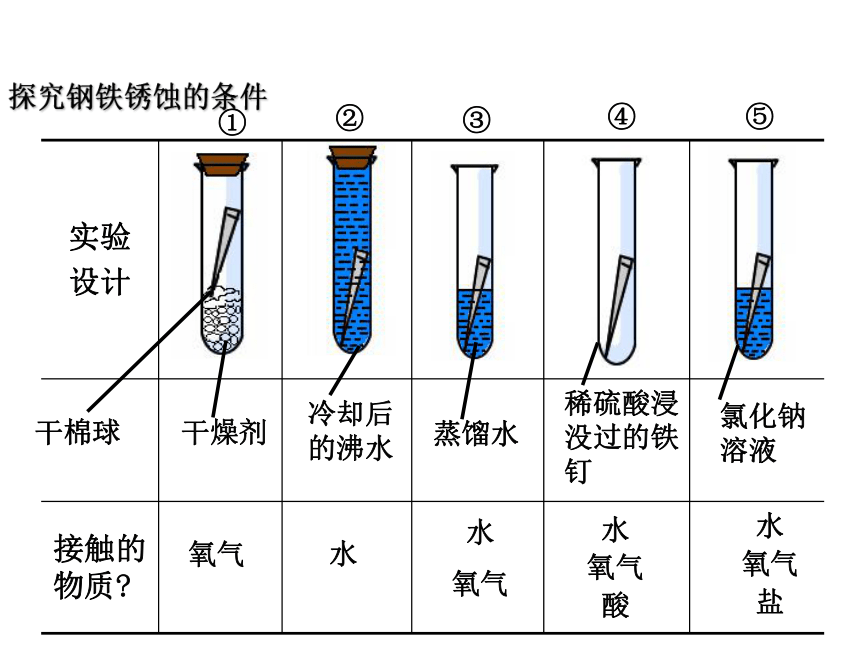
第3节 金属防护和废金属回收每年因为生锈而损失的钢铁约占世界钢铁年产量的1/10! 金属锈蚀给人类带来了巨大的损失,为了减少损失,需要研究金属锈蚀的原因和防护的方法,寻求废金属回收利用的途径。问题思考:钢铁为什么会生锈?钢铁生锈的条件是什么呢?水
氧气
酸水
氧气
盐水
氧气水 氧气探究钢铁锈蚀的条件干棉球干燥剂冷却后
的沸水蒸馏水稀硫酸浸没过的铁钉氯化钠
溶液①②④⑤③稀硫酸浸没过的铁钉食盐水冷却后的沸水第一天蒸馏水①②④⑤③干燥剂干棉球无明显现象出现少量铁锈第三天稀硫酸浸没过的铁钉食盐水冷却后的沸水蒸馏水①②④⑤③干燥剂干棉球无明显现象出现铁锈铁锈增多第七天稀硫酸浸没过的铁钉食盐水冷却后的沸水蒸馏水①②④⑤③干燥剂干棉球无明显现象铁锈增多铁锈增多实验结论: 铁生锈的条件是:与氧气和水同时接触。
酸、盐溶液存在会加速铁的生锈。铁生锈的实质是铁与氧气和水等物质作用,发生一系列复杂的化学反应,转化为铁的化合物的过程。(缓慢氧化)
铁锈是褐色固体,主要成分是Fe2O3 。思考下列问题:1.为什么铝能自我保护?家用铝制物品能用铁丝球用力擦洗吗?
2.铁锈能对铁起保护作用吗?铁生锈后要不要及时除去铁锈?如何除去铁锈?
3.有哪些办法可以防止铁生锈?原理是什么? 铝在空气中与氧气反应,形成一层致密而结实的氧化铝膜覆盖在铝的表面,防止铝与氧气继续反应。 铁锈是一种疏松多孔的物质,具有吸水性,能让空气中的氧气和水分穿过它的空隙,不断向内层渗透,持续跟铁反应,直至铁被完全锈蚀。因此铁锈如不除去,会加速里层铁的生锈。常用除锈方法:(1)打磨除去铁锈。
(2)用稀盐酸、稀硫酸除去铁锈。
Fe2O3 + 6HCl == 2FeCl3 + 3H2O
Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O防锈的原理和方法:防锈原理:隔绝水和氧气
防锈措施:
(1)在铁的表面覆盖保护层:喷涂油漆、涂防锈油、烧涂搪瓷等;
(2)在钢铁表面镀上其他金属:镀锡、镀锌、镀铬等。
废金属的回收利用1.废金属的危害
(1)造成资源浪费;
(2)污染环境。如:废旧电池中的镉、汞等有毒金属会污染环境。2.回收利用废金属的意义
既可以节约大量的煤等能源和金属资源,又能减少环境污染。3.如何保护金属资源
(1)防止金属腐蚀
(2)回收和利用废旧金属
(3)合理开采矿物
(4)寻找金属的代用品
(5)物尽其用1.埋藏在地下的钢铁管道在下列哪种情况下容易生锈( )
A.在干燥、致密的土壤中
B.在潮湿、致密的土壤中
C.在潮湿、疏松的土壤中
D.在干燥、疏松的土壤中
练一练:C2.下列做法能防止铁制品生锈的是( )
A.自行车脏了用清水冲洗 B.用废酸液冲洗铁制污水管道 C.在铁制篮球架上刷一层油漆 D.切完咸菜后,尽快将菜刀洗净擦干
CD3.自行车的构件如支架、链条、钢圈等,分别采取了什么防锈措施?刷漆、涂油、镀铬等4.(1)下列家庭生活垃圾:①废旧书刊报纸 ②废电池 ③废弃橡胶、塑料制品 ④易拉罐饮料瓶 ⑤废弃电线 ⑥破旧铁锅、铝壶 ⑦变质剩饭菜 ⑧瓜皮果壳 ⑨废弃玻璃物品等,其中可回收利用的有________。回收利用与保护金属资源的相关联的是______。
(2)请你联系实际再提出两条节约金属资源的建议。①③④⑤⑥⑨⑤⑥5.下面是一种金属的自述:我身穿银白色衣服,身体柔软,能屈能伸,我乐于传递热量,电流在我身体中也畅通无阻。我有三怕:一怕潮湿的空气,它会让我浑身长满褐色的疮;二怕酸溶液,遇到它们我就会生气;三怕盐溶液,它们能让我长更多的疮。不过我喜欢一种蓝色的盐溶液,它能给我穿上一层漂亮的红色外衣,还把我变成一种浅绿色溶液。我的用处可大了,日常生活中、建筑工地上、飞机、轮船、汽车、铁路上,到处都有我的身影。根据这段文字回答下面问题:
(1)上述金属是________。文中提到的该金属的物理性质有______________________ ________;
(2)上述文字中提到的该金属的化学性质有(能写出化学方程式的用化学方程式回答): 。铁(Fe)能导热、导电,银白色、延展性良好Fe+CuCl2===FeCl2+Cu
第3节 金属防护和废金属回收每年因为生锈而损失的钢铁约占世界钢铁年产量的1/10! 金属锈蚀给人类带来了巨大的损失,为了减少损失,需要研究金属锈蚀的原因和防护的方法,寻求废金属回收利用的途径。问题思考:钢铁为什么会生锈?钢铁生锈的条件是什么呢?水
氧气
酸水
氧气
盐水
氧气水 氧气探究钢铁锈蚀的条件干棉球干燥剂冷却后
的沸水蒸馏水稀硫酸浸没过的铁钉氯化钠
溶液①②④⑤③稀硫酸浸没过的铁钉食盐水冷却后的沸水第一天蒸馏水①②④⑤③干燥剂干棉球无明显现象出现少量铁锈第三天稀硫酸浸没过的铁钉食盐水冷却后的沸水蒸馏水①②④⑤③干燥剂干棉球无明显现象出现铁锈铁锈增多第七天稀硫酸浸没过的铁钉食盐水冷却后的沸水蒸馏水①②④⑤③干燥剂干棉球无明显现象铁锈增多铁锈增多实验结论: 铁生锈的条件是:与氧气和水同时接触。
酸、盐溶液存在会加速铁的生锈。铁生锈的实质是铁与氧气和水等物质作用,发生一系列复杂的化学反应,转化为铁的化合物的过程。(缓慢氧化)
铁锈是褐色固体,主要成分是Fe2O3 。思考下列问题:1.为什么铝能自我保护?家用铝制物品能用铁丝球用力擦洗吗?
2.铁锈能对铁起保护作用吗?铁生锈后要不要及时除去铁锈?如何除去铁锈?
3.有哪些办法可以防止铁生锈?原理是什么? 铝在空气中与氧气反应,形成一层致密而结实的氧化铝膜覆盖在铝的表面,防止铝与氧气继续反应。 铁锈是一种疏松多孔的物质,具有吸水性,能让空气中的氧气和水分穿过它的空隙,不断向内层渗透,持续跟铁反应,直至铁被完全锈蚀。因此铁锈如不除去,会加速里层铁的生锈。常用除锈方法:(1)打磨除去铁锈。
(2)用稀盐酸、稀硫酸除去铁锈。
Fe2O3 + 6HCl == 2FeCl3 + 3H2O
Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O防锈的原理和方法:防锈原理:隔绝水和氧气
防锈措施:
(1)在铁的表面覆盖保护层:喷涂油漆、涂防锈油、烧涂搪瓷等;
(2)在钢铁表面镀上其他金属:镀锡、镀锌、镀铬等。
废金属的回收利用1.废金属的危害
(1)造成资源浪费;
(2)污染环境。如:废旧电池中的镉、汞等有毒金属会污染环境。2.回收利用废金属的意义
既可以节约大量的煤等能源和金属资源,又能减少环境污染。3.如何保护金属资源
(1)防止金属腐蚀
(2)回收和利用废旧金属
(3)合理开采矿物
(4)寻找金属的代用品
(5)物尽其用1.埋藏在地下的钢铁管道在下列哪种情况下容易生锈( )
A.在干燥、致密的土壤中
B.在潮湿、致密的土壤中
C.在潮湿、疏松的土壤中
D.在干燥、疏松的土壤中
练一练:C2.下列做法能防止铁制品生锈的是( )
A.自行车脏了用清水冲洗 B.用废酸液冲洗铁制污水管道 C.在铁制篮球架上刷一层油漆 D.切完咸菜后,尽快将菜刀洗净擦干
CD3.自行车的构件如支架、链条、钢圈等,分别采取了什么防锈措施?刷漆、涂油、镀铬等4.(1)下列家庭生活垃圾:①废旧书刊报纸 ②废电池 ③废弃橡胶、塑料制品 ④易拉罐饮料瓶 ⑤废弃电线 ⑥破旧铁锅、铝壶 ⑦变质剩饭菜 ⑧瓜皮果壳 ⑨废弃玻璃物品等,其中可回收利用的有________。回收利用与保护金属资源的相关联的是______。
(2)请你联系实际再提出两条节约金属资源的建议。①③④⑤⑥⑨⑤⑥5.下面是一种金属的自述:我身穿银白色衣服,身体柔软,能屈能伸,我乐于传递热量,电流在我身体中也畅通无阻。我有三怕:一怕潮湿的空气,它会让我浑身长满褐色的疮;二怕酸溶液,遇到它们我就会生气;三怕盐溶液,它们能让我长更多的疮。不过我喜欢一种蓝色的盐溶液,它能给我穿上一层漂亮的红色外衣,还把我变成一种浅绿色溶液。我的用处可大了,日常生活中、建筑工地上、飞机、轮船、汽车、铁路上,到处都有我的身影。根据这段文字回答下面问题:
(1)上述金属是________。文中提到的该金属的物理性质有______________________ ________;
(2)上述文字中提到的该金属的化学性质有(能写出化学方程式的用化学方程式回答): 。铁(Fe)能导热、导电,银白色、延展性良好Fe+CuCl2===FeCl2+Cu
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
