第3节 化学方程式的书写与应用 第2课时课件(20张PPT)
文档属性
| 名称 | 第3节 化学方程式的书写与应用 第2课时课件(20张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 901.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-22 00:00:00 | ||
图片预览







文档简介
课件20张PPT。欢迎同学们步入化学殿堂 同学们好!趣味实验实验原理:
CaCO3+2HCl=CaCl2+H2O+CO2 ↑实验步骤:
把气球中的碳酸钙粉末投入到盛有稀盐酸的锥形瓶中。比一比谁吹的气球大实验说明:锥形瓶中盛有相同且足量的稀盐酸,然后分别加入不同质量的碳酸钙粉末。请你思考:气球的大小为什么会不相同?(忽略气球本身的因素影响)1.初步理解利用化学方程式的计算是根据化 学反应中反应物和生成物之间的质量比进行的。
2. 掌握利用化学方程式计算的基本思路和规范的解题格式。明确学习目标第3节
化学方程式的书写与应用
(第2课时)活动一、实验探究化学反应中各物 质的质量比例关系请你思考:
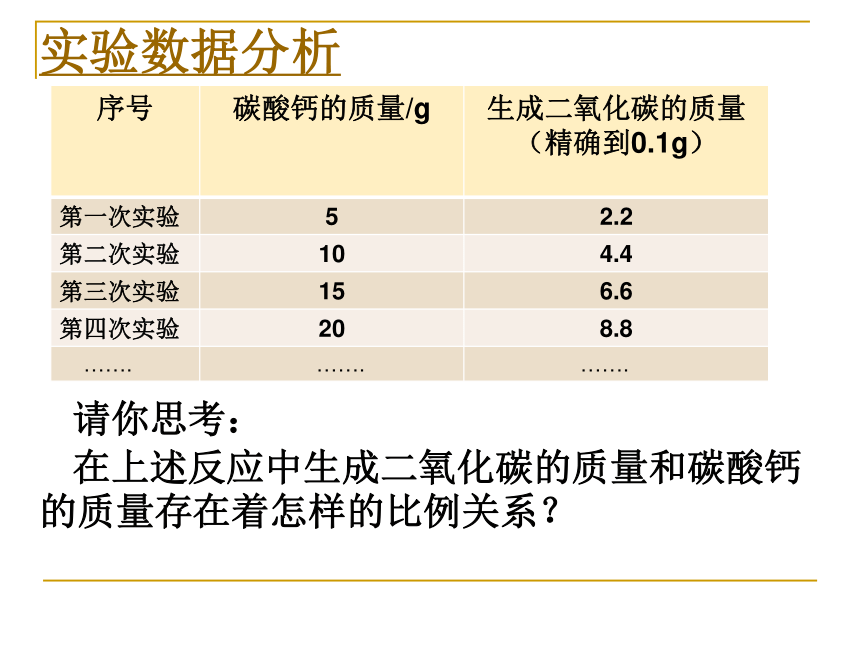
如何用实验的方法测定上述实验中产生二氧化碳气体的质量?实验数据分析请你思考:
在上述反应中生成二氧化碳的质量和碳酸钙的质量存在着怎样的比例关系?二氧化碳的质量/g碳酸钙的质量/g返回8.820==44100数据分析后,你能得到什么结论? 生成二氧化碳的质量和反应的碳酸钙的质量成正比例关系,且生成二氧化碳和参加反应碳酸钙的质量比是一个定值:(即44:100)5 10 15 208.8 6.6 4.4 2.2CaCO3+2HCl=CaCl2+H2O+CO2↑ 1×100 1×44 10g ( ) 8.8g4.4g 20g 相对原子量:H ---1 ,O----16,Ca---40,Cl---35.5,C----12通过实验找出在同一个化学反应中,不同物
质之间的质量关系( ) 22g50g 精彩瞬间,扬我国威
请你思考:
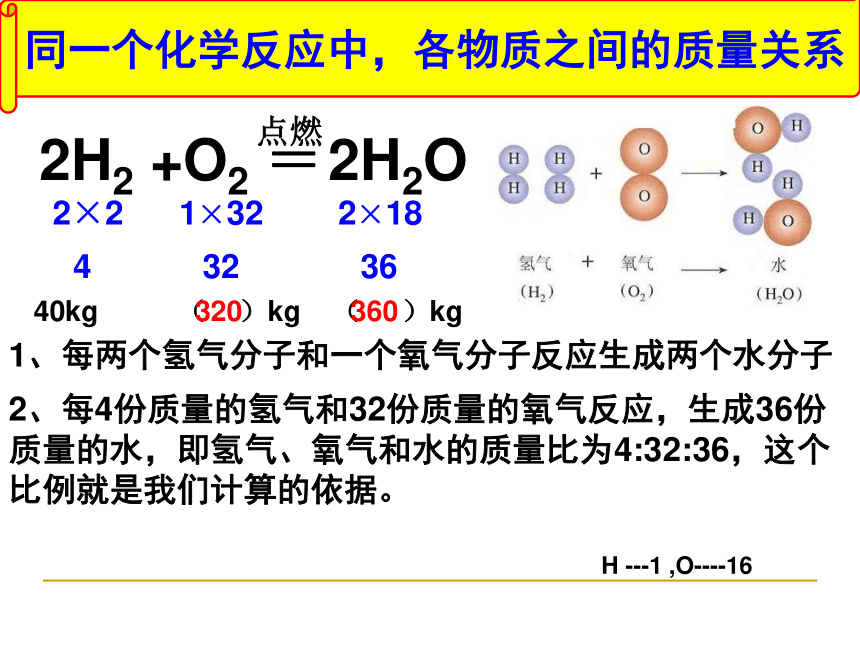
如果在二级火箭推进器中使用液态氢气和氧气,科学家是如何计算一定质量的氢气完全燃烧需要氧气的质量呢?1、每两个氢气分子和一个氧气分子反应生成两个水分子 2、每4份质量的氢气和32份质量的氧气反应,生成36份质量的水,即氢气、氧气和水的质量比为4:32:36,这个比例就是我们计算的依据。2H2 +O2 = 2H2O点燃4 32 362×2 1×32 2×18H ---1 ,O----16同一个化学反应中,各物质之间的质量关系 40kg ( )kg ( )kg320360 在一切化学反应中反应物与生成物之间的质量比是成正比例关系(即参加反应的各物质与生成的各物质的质量比等于其___________乘以____________之比)因此,我们只要知道_______ 反应物或生成物的质量,就可以求出________ 未知物的质量,这就是利用化学方程式计算的理论依据。恍然大悟相对分子量_________ 一种其它化学计量数 活动二、利用化学方程式计 算的解题格式
请同学们自学课本第107页的例题
自学要求:
1.请你用最简要的语言总结一下利用化学方程式计算的步骤。
考一考你的观察力题目:加热分解6.3g高锰酸钾,可以得到多少克氧气?2 2×2×计算结果错X gKMnO4 158 x g=1.21.2g氧气87[例1] 加热分解6.3g高锰酸钾,可以得到多少克氧气?根据化学方程式计算的步骤(1)设未知量
(2)写出化学方程式并配平
(3)找出相关物质的相对分子质量和已知量、未知量
(4)列出比例式
(5)求解
(6)简明地写出答案解:设可以得到氧气的质量为x答:加热分解 6.3g高锰酸钾,可以得到0.6g氧气。根据化学方程式计算的注意事项:
(1)要正确书写方程式
(2)根据物质的组成求各化学式的相对分子质量与化学计量数的乘积之比,计算时必须准确无误。
(3)解题格式的书写要规范化。
(4)注意单位的书写要求。 我思我悟
2.请你尽快能的说说利用化学方程式计算的注意事项有哪些? 如果火箭用氢气作燃料,而你是火箭发动机设计师,火箭助推上升时需要燃烧氢气200Kg,你会在火箭助燃剂仓中填充多少氧气使之完全燃烧?800Kg氧气行吗?为什么?【解决问题】该怎么计算呢?解:设燃烧200kg氢气至少需要的氧气的质量为x。
【参考解答】所以 800kg氧气不够,会剩下100kg的氢气无法燃烧而正常推动火箭。2H2 + O2 === 2H2O2×2 32200kg x点燃答:需要1600kg氧气;800kg氧气不够,使燃料无法完全燃烧。 坏了! 火箭掉下去啦· · · · · 当堂检测 2、10克碳酸钙与足量的稀盐酸反应,能生成多少克二氧化碳气体?
(反应原理:CaCO3+2HCl=CaCl2+H2O+CO2 ↑)
1、工业上高温煅烧石灰石(CaCO3)可制得生石灰(CaO)和二氧化碳,如果要制取5.6 t氧化钙,需要碳酸钙多少吨? (反应原理:CaCO3====CaO+CO2 ↑)高温我来出题:著名的物理学家爱因斯坦曾经说过:“提出一个问题比解决一个问题更重要”,请你从老师提供的两个素材中任意选择一个,选择合适的数据编写一道有关化学方程式的计算题。(要求给出解题参考答案) 爱因斯坦: 学习后的总结有时比学习本身更重要。 通过这节课的学习,同学们有什么收获?
同学们再见!谢谢
CaCO3+2HCl=CaCl2+H2O+CO2 ↑实验步骤:
把气球中的碳酸钙粉末投入到盛有稀盐酸的锥形瓶中。比一比谁吹的气球大实验说明:锥形瓶中盛有相同且足量的稀盐酸,然后分别加入不同质量的碳酸钙粉末。请你思考:气球的大小为什么会不相同?(忽略气球本身的因素影响)1.初步理解利用化学方程式的计算是根据化 学反应中反应物和生成物之间的质量比进行的。
2. 掌握利用化学方程式计算的基本思路和规范的解题格式。明确学习目标第3节
化学方程式的书写与应用
(第2课时)活动一、实验探究化学反应中各物 质的质量比例关系请你思考:
如何用实验的方法测定上述实验中产生二氧化碳气体的质量?实验数据分析请你思考:
在上述反应中生成二氧化碳的质量和碳酸钙的质量存在着怎样的比例关系?二氧化碳的质量/g碳酸钙的质量/g返回8.820==44100数据分析后,你能得到什么结论? 生成二氧化碳的质量和反应的碳酸钙的质量成正比例关系,且生成二氧化碳和参加反应碳酸钙的质量比是一个定值:(即44:100)5 10 15 208.8 6.6 4.4 2.2CaCO3+2HCl=CaCl2+H2O+CO2↑ 1×100 1×44 10g ( ) 8.8g4.4g 20g 相对原子量:H ---1 ,O----16,Ca---40,Cl---35.5,C----12通过实验找出在同一个化学反应中,不同物
质之间的质量关系( ) 22g50g 精彩瞬间,扬我国威
请你思考:
如果在二级火箭推进器中使用液态氢气和氧气,科学家是如何计算一定质量的氢气完全燃烧需要氧气的质量呢?1、每两个氢气分子和一个氧气分子反应生成两个水分子 2、每4份质量的氢气和32份质量的氧气反应,生成36份质量的水,即氢气、氧气和水的质量比为4:32:36,这个比例就是我们计算的依据。2H2 +O2 = 2H2O点燃4 32 362×2 1×32 2×18H ---1 ,O----16同一个化学反应中,各物质之间的质量关系 40kg ( )kg ( )kg320360 在一切化学反应中反应物与生成物之间的质量比是成正比例关系(即参加反应的各物质与生成的各物质的质量比等于其___________乘以____________之比)因此,我们只要知道_______ 反应物或生成物的质量,就可以求出________ 未知物的质量,这就是利用化学方程式计算的理论依据。恍然大悟相对分子量_________ 一种其它化学计量数 活动二、利用化学方程式计 算的解题格式
请同学们自学课本第107页的例题
自学要求:
1.请你用最简要的语言总结一下利用化学方程式计算的步骤。
考一考你的观察力题目:加热分解6.3g高锰酸钾,可以得到多少克氧气?2 2×2×计算结果错X gKMnO4 158 x g=1.21.2g氧气87[例1] 加热分解6.3g高锰酸钾,可以得到多少克氧气?根据化学方程式计算的步骤(1)设未知量
(2)写出化学方程式并配平
(3)找出相关物质的相对分子质量和已知量、未知量
(4)列出比例式
(5)求解
(6)简明地写出答案解:设可以得到氧气的质量为x答:加热分解 6.3g高锰酸钾,可以得到0.6g氧气。根据化学方程式计算的注意事项:
(1)要正确书写方程式
(2)根据物质的组成求各化学式的相对分子质量与化学计量数的乘积之比,计算时必须准确无误。
(3)解题格式的书写要规范化。
(4)注意单位的书写要求。 我思我悟
2.请你尽快能的说说利用化学方程式计算的注意事项有哪些? 如果火箭用氢气作燃料,而你是火箭发动机设计师,火箭助推上升时需要燃烧氢气200Kg,你会在火箭助燃剂仓中填充多少氧气使之完全燃烧?800Kg氧气行吗?为什么?【解决问题】该怎么计算呢?解:设燃烧200kg氢气至少需要的氧气的质量为x。
【参考解答】所以 800kg氧气不够,会剩下100kg的氢气无法燃烧而正常推动火箭。2H2 + O2 === 2H2O2×2 32200kg x点燃答:需要1600kg氧气;800kg氧气不够,使燃料无法完全燃烧。 坏了! 火箭掉下去啦· · · · · 当堂检测 2、10克碳酸钙与足量的稀盐酸反应,能生成多少克二氧化碳气体?
(反应原理:CaCO3+2HCl=CaCl2+H2O+CO2 ↑)
1、工业上高温煅烧石灰石(CaCO3)可制得生石灰(CaO)和二氧化碳,如果要制取5.6 t氧化钙,需要碳酸钙多少吨? (反应原理:CaCO3====CaO+CO2 ↑)高温我来出题:著名的物理学家爱因斯坦曾经说过:“提出一个问题比解决一个问题更重要”,请你从老师提供的两个素材中任意选择一个,选择合适的数据编写一道有关化学方程式的计算题。(要求给出解题参考答案) 爱因斯坦: 学习后的总结有时比学习本身更重要。 通过这节课的学习,同学们有什么收获?
同学们再见!谢谢
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
