第二节 金属矿物 铁的冶炼(20张PPT)
文档属性
| 名称 | 第二节 金属矿物 铁的冶炼(20张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 189.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-22 16:23:09 | ||
图片预览




文档简介
课件20张PPT。 第五章
金属矿物及金属的冶炼复习目标1 知道金属资源在自然界的存在。
2.掌握实验室炼铁的原理、操作步骤、现象和注意事项。
3.了解工业炼铁的原料、原理、设备及产物。
4.掌握有关不纯物质的计算。 1.自然界中极少数不活泼的金属如金、银
____形式存在外,其余都以______形式存在。
2.常见的金属矿石的主要成分,如赤铁矿
_____;磁铁矿_____; 铝土矿_____; 孔雀石
__________.
3.C、CO和 H2 都具有还原性,可以还原
金属氧化物,C、H2 还原氧化铜的化学方程
式分别为________________,_____________
一 氧化碳还原四氧化三铁的化学方程式为
:___________________
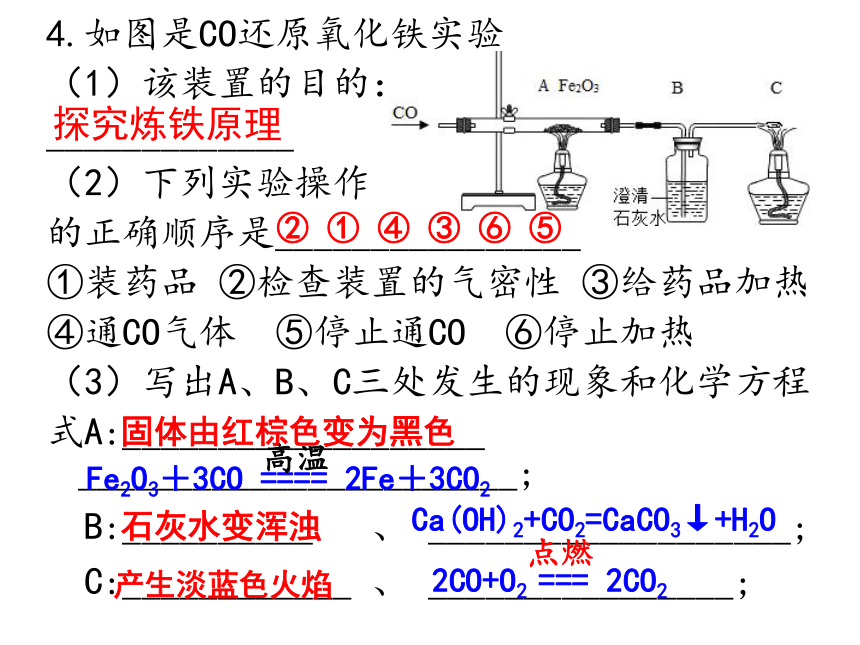
单质化合物Fe2O3Fe3O4Al2O3Cu(OH)2CO32CuO+C==2Cu+CO2↑加热CuO+H2===Cu+H2O加热Fe3O4+4CO === 3Fe+4CO2高温【自主复习】4.如图是CO还原氧化铁实验
(1)该装置的目的:
_____________
(2)下列实验操作
的正确顺序是________________
①装药品 ②检查装置的气密性 ③给药品加热
④通CO气体 ⑤停止通CO ⑥停止加热
(3)写出A、B、C三处发生的现象和化学方程
式A:___________________ _______________________;
B:__________ 、 ___________________;
C:____________ 、 ________________;
Fe2O3+3CO ==== 2Fe+3CO2高温② ① ④ ③ ⑥ ⑤ 固体由红棕色变为黑色 探究炼铁原理石灰水变浑浊Ca(OH)2+CO2=CaCO3↓+H2O产生淡蓝色火焰2CO+O2 === 2CO2点燃5.工业炼铁(赤铁矿)
(1)设备:____
(2)原料:____________________________
(3)化学方程式:⑴_____________
⑵_____________
⑶_____________
⑷_____________
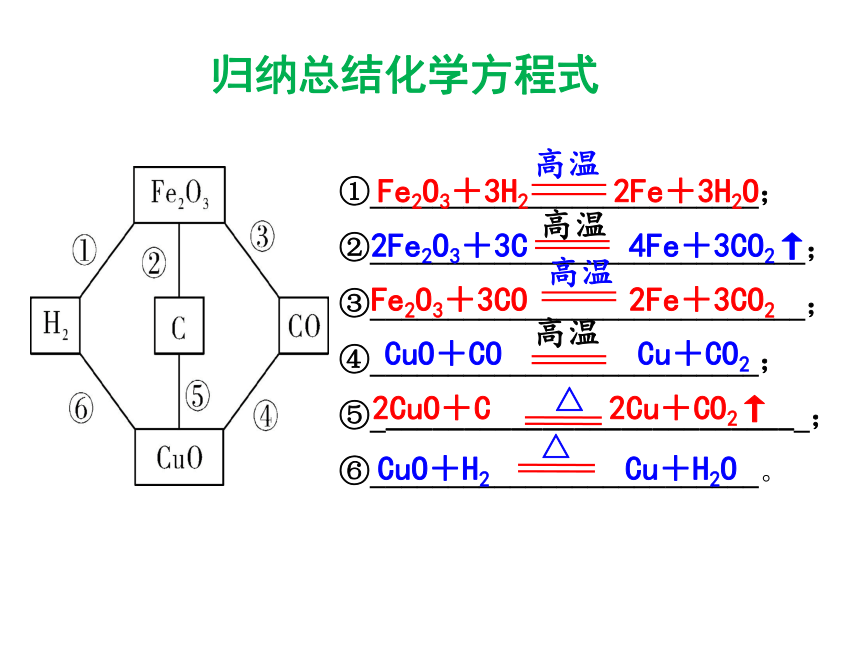
(4)产物:____高炉铁矿石、焦炭、石灰石、热空气CaCO3 === CaO+CO2↑高温C + O2 === CO2点燃CO2 + C === 2CO高温Fe2O3+3CO===2Fe+3CO2 高温生铁 归纳总结化学方程式 ①_________________________;
②____________________________;
③____________________________;
④_________________________;
⑤____________________________;
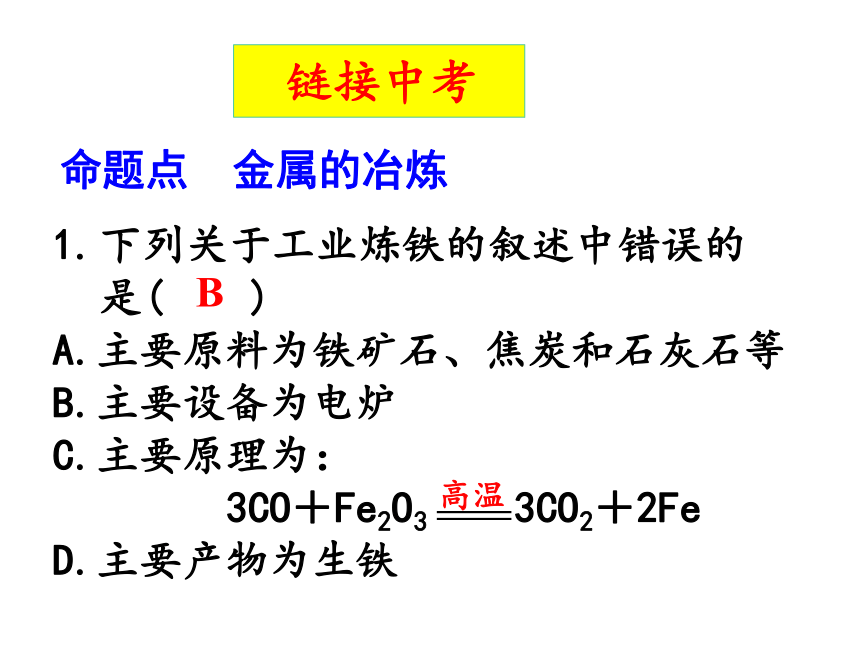
⑥_________________________。下列关于工业炼铁的叙述中错误的是( )
A.主要原料为铁矿石、焦炭和石灰石等
B.主要设备为电炉
C.主要原理为:
3CO+Fe2O3 3CO2+2Fe
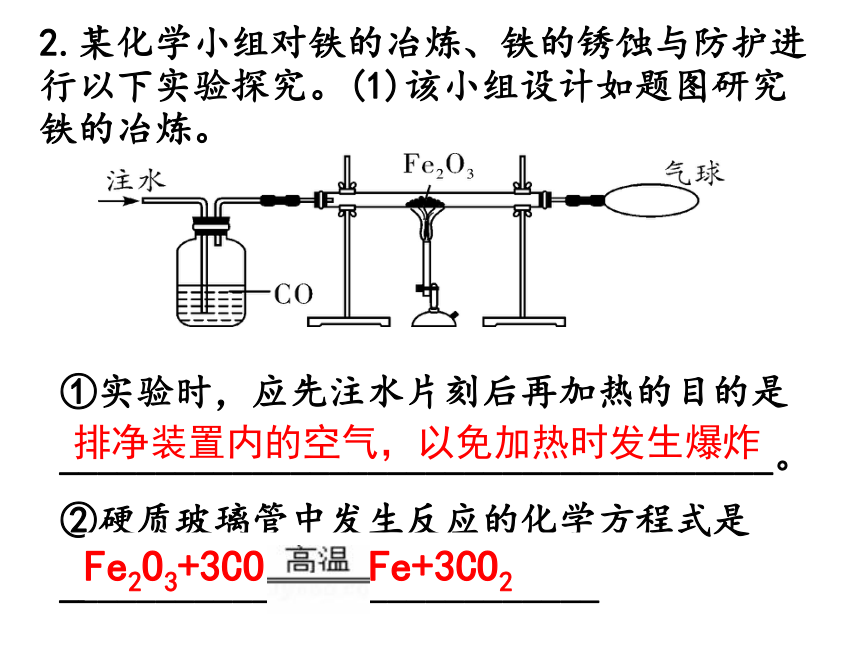
D.主要产物为生铁B 链接中考 命题点 金属的冶炼2.某化学小组对铁的冶炼、铁的锈蚀与防护进行以下实验探究。(1)该小组设计如题图研究铁的冶炼。①实验时,应先注水片刻后再加热的目的是
_____________________________________。
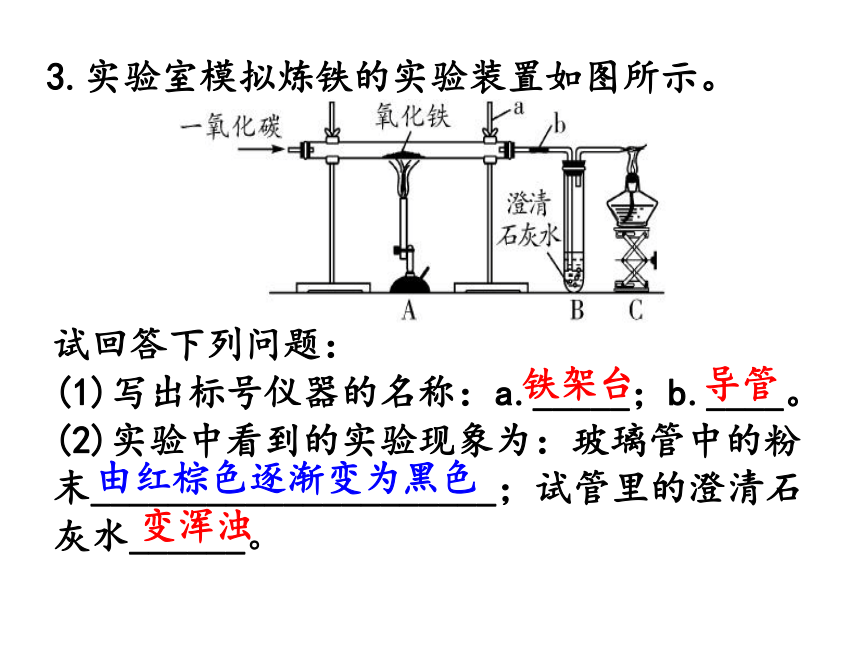
②硬质玻璃管中发生反应的化学方程式是____________________________。排净装置内的空气,以免加热时发生爆炸Fe2O3+3CO ???????2Fe+3CO2 3.实验室模拟炼铁的实验装置如图所示。试回答下列问题:
(1)写出标号仪器的名称:a._____;b.____。
(2)实验中看到的实验现象为:玻璃管中的粉末_____________________;试管里的澄清石灰水______。铁架台导管变浑浊由红棕色逐渐变为黑色(3)玻璃管中反应的化学方程式为_______________________________。
(4)加热氧化铁之前,先通一会儿一氧化碳的作用是
_________________________________。
(5)该实验设计装置C的目的是____________________________________。排尽玻璃管中的空气,防止发生爆炸燃烧未反应的一氧化碳,防止污染空气 (2)为了证明反应后的黑色物质是Fe,向黑色粉末加入稀盐酸看到现象: 产生气泡,溶液由无色变成浅绿色。补充设问:
(1)实验结束后的操作:先熄灭酒精灯,并且继续通入一氧化碳直至玻璃管冷却至室温。【质疑拓展】我国是一个钢铁大国,钢铁产量为世界第一。
某化学实验小组的同学用下面的装置在实验室
中模拟炼铁。请你和他们一起完成相关探究。
(1)操作顺序是实验成败的关键,对于该实
验,应_____________(填“先通一氧化碳”
或“先点燃酒精灯”)。
先通一氧化碳(2)反应 中可看到粗玻璃管内的固体逐渐由____色变成___色,写出反应的化学方程式________________
(3)产物的检验
①初步检验:甲同学
想对反应的产物进行
初步检验,请帮他想
出一个物理方法___________
②进一步验证:乙同学想用化学方法对产物进
一步验证,他将反应后的黑色粉末加入足量的
硫酸铜溶液中,发现只有部分变红。请写出生
成红色物质的化学方程式__________________红棕黑3CO+Fe2O3==2Fe+3CO2高温用磁铁吸引Fe+CuSO4=Cu+FeSO4①乙同学对产物的成分产生质疑,查阅相关资
料后得知,一氧化碳还原氧化铁是一个逐渐过
程。首先是Fe203在400℃~500℃被还原为
Fe304,在500℃~600℃被还原为FeO,在600℃
以上被还原为Fe.
②通过以上分析,甲乙两位同学对反应后黑色
固体的成分进行猜想:已知FeO、Fe3O4均为黑
色,且Fe3O4有磁性。 FeO、 Fe3O4都不与硫酸
铜溶液反应。猜想一:Fe与Fe3O4; 猜想二: Fe与 FeO;猜想三:Fe 、Fe3O4和FeO。
(4)质疑与探究③为了对产物固体的成分进行更客观的分析,
甲乙同学将所做的实验整理如下:
④实验反思:为了提高铁的产率,应当_____
(填“降低”或“提高”)反应温度。
猜想一
成 立黑色粉末全部被吸引黑色固体部分变红提高【联系生产实际】 我国矿产资源比较丰富,某钢铁厂用
1000吨含氧化铁80%的赤铁矿石炼铁,
理论上可以炼出杂质4%的生铁多少吨? 解:设可以炼出杂质4%的生铁质量为XFe2O3 + 3CO == 2Fe + 3CO2高温 112
1000tX80% Xx(1- 4%)160:(1000tX80%)=112:[Xx(1- 4%)]X = 583.3t答:可炼出含杂质4%的生铁583.3t方法二:
赤铁矿石→ 氧化铁→铁→生铁
m(Fe)=1000t X 80% X------X100%
=560 t
m(生铁)=560t÷(1- 4%)
=583.3 t
答:可炼出含杂质4%的生铁583.3t.112160【综合运用】 某钢铁厂为分析赤铁矿中Fe2O3的质量
分数:准确称取20g样品,在高温条件下
用足量的CO气体还原,充分反应(假设
其它杂质不与CO反应)后冷却称重,质
量为15.2g.计算该赤铁矿样品中Fe2O3的
质量分数。解:m(O)= 20-15.2=4.8(g)
m(F2O3)=4.8÷----X100%=16(g)
Fe2O3%=16÷20X100%=80%
答:赤铁样品中Fe2O3质量分数为80%。48160同学们,本节课你有什
么收获?作业:复习指导P25--26
金属矿物及金属的冶炼复习目标1 知道金属资源在自然界的存在。
2.掌握实验室炼铁的原理、操作步骤、现象和注意事项。
3.了解工业炼铁的原料、原理、设备及产物。
4.掌握有关不纯物质的计算。 1.自然界中极少数不活泼的金属如金、银
____形式存在外,其余都以______形式存在。
2.常见的金属矿石的主要成分,如赤铁矿
_____;磁铁矿_____; 铝土矿_____; 孔雀石
__________.
3.C、CO和 H2 都具有还原性,可以还原
金属氧化物,C、H2 还原氧化铜的化学方程
式分别为________________,_____________
一 氧化碳还原四氧化三铁的化学方程式为
:___________________
单质化合物Fe2O3Fe3O4Al2O3Cu(OH)2CO32CuO+C==2Cu+CO2↑加热CuO+H2===Cu+H2O加热Fe3O4+4CO === 3Fe+4CO2高温【自主复习】4.如图是CO还原氧化铁实验
(1)该装置的目的:
_____________
(2)下列实验操作
的正确顺序是________________
①装药品 ②检查装置的气密性 ③给药品加热
④通CO气体 ⑤停止通CO ⑥停止加热
(3)写出A、B、C三处发生的现象和化学方程
式A:___________________ _______________________;
B:__________ 、 ___________________;
C:____________ 、 ________________;
Fe2O3+3CO ==== 2Fe+3CO2高温② ① ④ ③ ⑥ ⑤ 固体由红棕色变为黑色 探究炼铁原理石灰水变浑浊Ca(OH)2+CO2=CaCO3↓+H2O产生淡蓝色火焰2CO+O2 === 2CO2点燃5.工业炼铁(赤铁矿)
(1)设备:____
(2)原料:____________________________
(3)化学方程式:⑴_____________
⑵_____________
⑶_____________
⑷_____________
(4)产物:____高炉铁矿石、焦炭、石灰石、热空气CaCO3 === CaO+CO2↑高温C + O2 === CO2点燃CO2 + C === 2CO高温Fe2O3+3CO===2Fe+3CO2 高温生铁 归纳总结化学方程式 ①_________________________;
②____________________________;
③____________________________;
④_________________________;
⑤____________________________;
⑥_________________________。下列关于工业炼铁的叙述中错误的是( )
A.主要原料为铁矿石、焦炭和石灰石等
B.主要设备为电炉
C.主要原理为:
3CO+Fe2O3 3CO2+2Fe
D.主要产物为生铁B 链接中考 命题点 金属的冶炼2.某化学小组对铁的冶炼、铁的锈蚀与防护进行以下实验探究。(1)该小组设计如题图研究铁的冶炼。①实验时,应先注水片刻后再加热的目的是
_____________________________________。
②硬质玻璃管中发生反应的化学方程式是____________________________。排净装置内的空气,以免加热时发生爆炸Fe2O3+3CO ???????2Fe+3CO2 3.实验室模拟炼铁的实验装置如图所示。试回答下列问题:
(1)写出标号仪器的名称:a._____;b.____。
(2)实验中看到的实验现象为:玻璃管中的粉末_____________________;试管里的澄清石灰水______。铁架台导管变浑浊由红棕色逐渐变为黑色(3)玻璃管中反应的化学方程式为_______________________________。
(4)加热氧化铁之前,先通一会儿一氧化碳的作用是
_________________________________。
(5)该实验设计装置C的目的是____________________________________。排尽玻璃管中的空气,防止发生爆炸燃烧未反应的一氧化碳,防止污染空气 (2)为了证明反应后的黑色物质是Fe,向黑色粉末加入稀盐酸看到现象: 产生气泡,溶液由无色变成浅绿色。补充设问:
(1)实验结束后的操作:先熄灭酒精灯,并且继续通入一氧化碳直至玻璃管冷却至室温。【质疑拓展】我国是一个钢铁大国,钢铁产量为世界第一。
某化学实验小组的同学用下面的装置在实验室
中模拟炼铁。请你和他们一起完成相关探究。
(1)操作顺序是实验成败的关键,对于该实
验,应_____________(填“先通一氧化碳”
或“先点燃酒精灯”)。
先通一氧化碳(2)反应 中可看到粗玻璃管内的固体逐渐由____色变成___色,写出反应的化学方程式________________
(3)产物的检验
①初步检验:甲同学
想对反应的产物进行
初步检验,请帮他想
出一个物理方法___________
②进一步验证:乙同学想用化学方法对产物进
一步验证,他将反应后的黑色粉末加入足量的
硫酸铜溶液中,发现只有部分变红。请写出生
成红色物质的化学方程式__________________红棕黑3CO+Fe2O3==2Fe+3CO2高温用磁铁吸引Fe+CuSO4=Cu+FeSO4①乙同学对产物的成分产生质疑,查阅相关资
料后得知,一氧化碳还原氧化铁是一个逐渐过
程。首先是Fe203在400℃~500℃被还原为
Fe304,在500℃~600℃被还原为FeO,在600℃
以上被还原为Fe.
②通过以上分析,甲乙两位同学对反应后黑色
固体的成分进行猜想:已知FeO、Fe3O4均为黑
色,且Fe3O4有磁性。 FeO、 Fe3O4都不与硫酸
铜溶液反应。猜想一:Fe与Fe3O4; 猜想二: Fe与 FeO;猜想三:Fe 、Fe3O4和FeO。
(4)质疑与探究③为了对产物固体的成分进行更客观的分析,
甲乙同学将所做的实验整理如下:
④实验反思:为了提高铁的产率,应当_____
(填“降低”或“提高”)反应温度。
猜想一
成 立黑色粉末全部被吸引黑色固体部分变红提高【联系生产实际】 我国矿产资源比较丰富,某钢铁厂用
1000吨含氧化铁80%的赤铁矿石炼铁,
理论上可以炼出杂质4%的生铁多少吨? 解:设可以炼出杂质4%的生铁质量为XFe2O3 + 3CO == 2Fe + 3CO2高温 112
1000tX80% Xx(1- 4%)160:(1000tX80%)=112:[Xx(1- 4%)]X = 583.3t答:可炼出含杂质4%的生铁583.3t方法二:
赤铁矿石→ 氧化铁→铁→生铁
m(Fe)=1000t X 80% X------X100%
=560 t
m(生铁)=560t÷(1- 4%)
=583.3 t
答:可炼出含杂质4%的生铁583.3t.112160【综合运用】 某钢铁厂为分析赤铁矿中Fe2O3的质量
分数:准确称取20g样品,在高温条件下
用足量的CO气体还原,充分反应(假设
其它杂质不与CO反应)后冷却称重,质
量为15.2g.计算该赤铁矿样品中Fe2O3的
质量分数。解:m(O)= 20-15.2=4.8(g)
m(F2O3)=4.8÷----X100%=16(g)
Fe2O3%=16÷20X100%=80%
答:赤铁样品中Fe2O3质量分数为80%。48160同学们,本节课你有什
么收获?作业:复习指导P25--26
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
