鲁教版(五四制)八年级化学 5.2化学反应的表示 课件(23张ppt)
文档属性
| 名称 | 鲁教版(五四制)八年级化学 5.2化学反应的表示 课件(23张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-22 19:21:20 | ||
图片预览







文档简介
课件23张PPT。第二节 化学反应的表示1.认识化学方程式。
2.知道化学方程式遵循的原则。
3.掌握化学方程式表示的意义。
H2OH2O2“水在通电的条件下分解”的反应可以用以下方法表示。水氢气 + 氧气通电H2O ==== H2 ↑ + O2 ↑通电22+通电思考:你认为哪种表示方法最好?化学方程式 定义:用化学式来表示化学反应的式子。1、以科学实验事实为依据,不能凭空臆造事实上不存在的物质和化学反应。
2、以质量守恒定律为依据,等号两边各种原子的种类和数目必须相等。
化学方程式遵循的原则 自主学习:一、化学方程式及其意义
学法指导:请同学们认真阅读课本p106~p107 ,时间2分钟,并回答下列问题。
1、化学方程式中,“△”表示什么?能表示“点燃”吗?
2、化学方程式中,“↑”或“↓”标在哪里?分别表示什么?
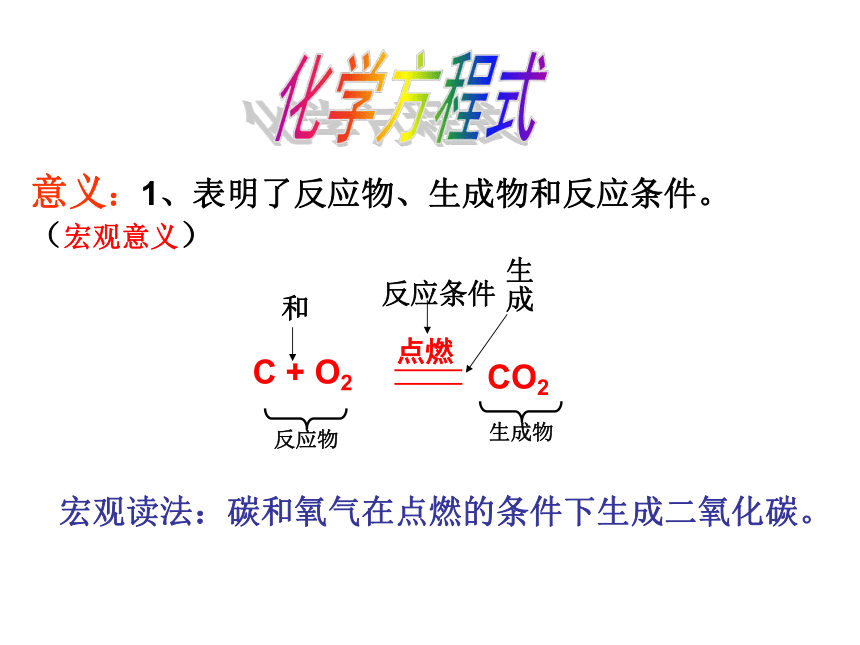
3、化学方程式能告诉我们哪些信息,即化学方程式有什么意义?化学方程式意义:1、表明了反应物、生成物和反应条件。 (宏观意义)宏观读法:碳和氧气在点燃的条件下生成二氧化碳。化学方程式宏观读法:氢气和氧气在点燃的条件下生成水。意义:1、表明了反应物、生成物和反应条件。(宏观意义)1、 2Cu+ O2 = 2CuO
2、 4P +5O2= 2P2O5
3、 2H2O2 = 2H2O+O2↑
△点燃铜和氧气在加热的条件下生成氧化铜磷和氧气在点燃的条件下生成五氧化二磷MnO2过氧化氢在二氧化锰的催化作用下生成水和氧气我会读读一读下列化学方程式(宏观读法)
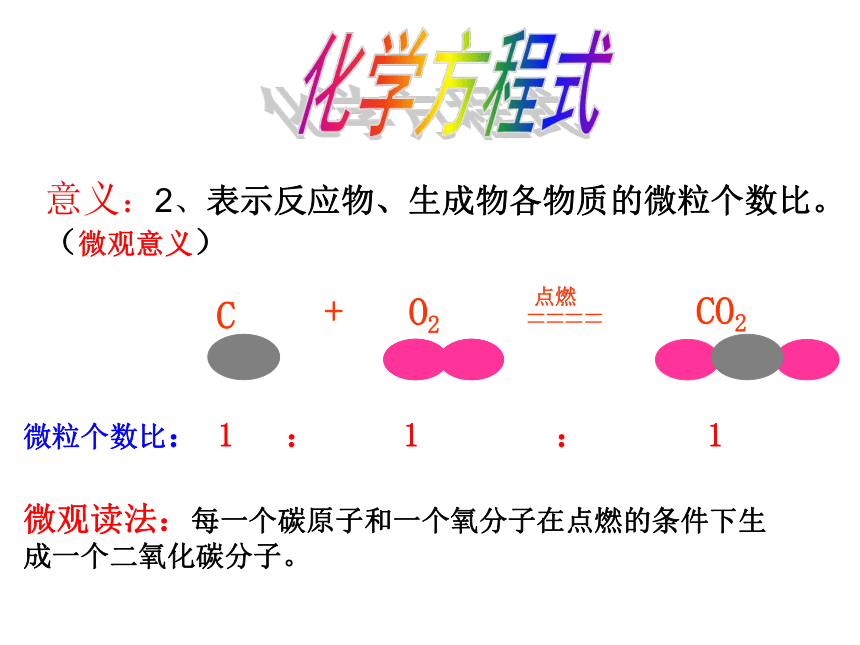
方法指导:同桌互读,相互纠正。时间1分钟。微粒个数比: 1 : 1 : 1化学方程式意义:2、表示反应物、生成物各物质的微粒个数比。(微观意义)微观读法:每一个碳原子和一个氧分子在点燃的条件下生成一个二氧化碳分子。化学方程式中化学式前面的数字表示什么意义?你知道吗微观读法:每两个氢分子和一个氧分子在点燃的条件下生成两个水分子。思考:化学方程式中化学式前面加了数字后起到了什么作用? 微粒数目比 2 : 1 : 2化学方程式是怎样体现质量守恒定律的? H原子数目:4224O原子数目:你知道吗可见:化学方程式描述了化学反应的客观事实,反应前后原子的种类、数目都不变。反应前后分子数目不变反应前后分子数目改变可见:化学反应前后分子的数目可能改变也可能不变。说出下列反应的微粒数目比,想一想化学反应前后分子的数目是否改变?微粒数目 1 1 2微粒数目 2 2 11、 2H2O = 2H2 ↑+ O2 ↑
2、 4P +5O2= 2P2O5
3、 2H2O2 = 2H2O+O2↑
通电点燃每2个水分子在通电的条件下生成2个氢分子和1个氧分子每4个磷原子和5个氧分子在点燃的条件下生成2个五氧化二磷分子MnO2每2个过氧化氢分子在二氧化锰的催化作用下生成2个水分子和1个氧分子我会读读一读下列化学方程式(微观读法)
方法指导:同桌互读,相互纠正。时间1分钟。
相对质量
物质质量之比 12 : 32 : 44
质量读法:每12份质量的碳和32份质量的氧气完全反应生成44份质量的二氧化碳。化学方程式意义:3、表示反应物、生成物的质量关系。即物质之间的质量比。(质量意义)
1216×212+16×22×1×2
=416×2
=322×(1×2+16)
=36化学方程式是怎样体现质量守恒定律的?你知道吗反应物的总质量份数:4+32 生成物的总质量份数:
=36 36可见:化学方程式体现了反应前后各物质的质量总和相等。物质质量比2H2+O2
====
2H2O点燃
质量比 4 32 36质量读法:每4份质量的氢气和32份质量的氧气完全反应生成36份质量的水。
想一想:
1、4克氢气完全燃烧,需要消耗多少克氧气?同时能生成多少克水?
2、4克氢气和33克氧气在点燃的条件下充分反应能生成多少克水?你的依据是什么?
3、4克氢气与4克氧气能恰好完全反应吗?若不能哪种物质有剩余?
挑战自我计算反应物和生成物各物质之间的质量比,并说出质量意义。
相对原子质量: H: 1 O: 16 Mg: 24
2H2O2 = 2H2O + O2↑
质量比
2Mg + O2= 2MgO
质量比MnO2点燃 68 36 32 48 32 80每68份质量的过氧化氢完全反应生成36份质量的水和32 份质量的氧气。每48份质量的镁和32份质量的氧气完全反应生成80份质量的氧化镁。⑴表明了反应物、生成物和反应条件。(宏观)⑵表示反应物、生成物各物质的微观粒子数之比(微观)⑶表示反应物、生成物各物质之间的质量关系,即物质之间的质量比。(质量)一、 化学方程式
1、定义
2、遵循原则
⑴遵循客观事实 ⑵遵循质量守恒定律
3、意义读
法:1.氢气和氧气在点燃的条件下反应生成水。(宏观)3.每4份质量的氢气和32份质量的氧气完全反应生成36份质量的水。(质量)2.每2个氢分子和1个氧分子完全反应生成2个水分子。(微观)16×2
=32
2×1×2
=42H2 + O2 = 2H2O点燃2×(1×2+16)
=364P + 5O2 ==== 2P2O5
124 160 284点燃1.表示磷和氧气在点燃条件下生成五氧化二磷。2.表示磷原子、氧分子和五氧化二磷分子的个数比为4∶5∶2。3.表示每124份质量的磷与160份质量的氧气反应生成284份质量的五氧化二磷。即磷、氧气、五氧化二磷的质量比为 124∶160∶284。请从三个方面描述下列化学方程式的意义:
1.火箭用联氨(N2H4)作燃料,一氧化氮作氧化剂。反应的化学方程式是:N2H4+2NO == 2X+2H2O,求X的化学式( )点燃A.N2 B.NO2 C.NH3 D.N2OAN原子数目: 4
H原子数目: 4 4
O原子数目: 2 2归纳方法:从化学式全部已知的一边入手。C1、下图是某个化学反应前后的微观模拟图,请根据图示判断参加反应
的 和 与反应后生成物的分子个数比是 。
用图示表示这一化学反应为: 2:1:2在一密闭容器中有甲、乙、丙、丁四种物质,测得反应前后的质量如下: 单位(g)试判断哪些是反应物,哪些是生成物,各物质的质量比为多少?根据质量守恒定律,反应前后容器内物质的总质量不变,算出反应后甲的质量416911
2.知道化学方程式遵循的原则。
3.掌握化学方程式表示的意义。
H2OH2O2“水在通电的条件下分解”的反应可以用以下方法表示。水氢气 + 氧气通电H2O ==== H2 ↑ + O2 ↑通电22+通电思考:你认为哪种表示方法最好?化学方程式 定义:用化学式来表示化学反应的式子。1、以科学实验事实为依据,不能凭空臆造事实上不存在的物质和化学反应。
2、以质量守恒定律为依据,等号两边各种原子的种类和数目必须相等。
化学方程式遵循的原则 自主学习:一、化学方程式及其意义
学法指导:请同学们认真阅读课本p106~p107 ,时间2分钟,并回答下列问题。
1、化学方程式中,“△”表示什么?能表示“点燃”吗?
2、化学方程式中,“↑”或“↓”标在哪里?分别表示什么?
3、化学方程式能告诉我们哪些信息,即化学方程式有什么意义?化学方程式意义:1、表明了反应物、生成物和反应条件。 (宏观意义)宏观读法:碳和氧气在点燃的条件下生成二氧化碳。化学方程式宏观读法:氢气和氧气在点燃的条件下生成水。意义:1、表明了反应物、生成物和反应条件。(宏观意义)1、 2Cu+ O2 = 2CuO
2、 4P +5O2= 2P2O5
3、 2H2O2 = 2H2O+O2↑
△点燃铜和氧气在加热的条件下生成氧化铜磷和氧气在点燃的条件下生成五氧化二磷MnO2过氧化氢在二氧化锰的催化作用下生成水和氧气我会读读一读下列化学方程式(宏观读法)
方法指导:同桌互读,相互纠正。时间1分钟。微粒个数比: 1 : 1 : 1化学方程式意义:2、表示反应物、生成物各物质的微粒个数比。(微观意义)微观读法:每一个碳原子和一个氧分子在点燃的条件下生成一个二氧化碳分子。化学方程式中化学式前面的数字表示什么意义?你知道吗微观读法:每两个氢分子和一个氧分子在点燃的条件下生成两个水分子。思考:化学方程式中化学式前面加了数字后起到了什么作用? 微粒数目比 2 : 1 : 2化学方程式是怎样体现质量守恒定律的? H原子数目:4224O原子数目:你知道吗可见:化学方程式描述了化学反应的客观事实,反应前后原子的种类、数目都不变。反应前后分子数目不变反应前后分子数目改变可见:化学反应前后分子的数目可能改变也可能不变。说出下列反应的微粒数目比,想一想化学反应前后分子的数目是否改变?微粒数目 1 1 2微粒数目 2 2 11、 2H2O = 2H2 ↑+ O2 ↑
2、 4P +5O2= 2P2O5
3、 2H2O2 = 2H2O+O2↑
通电点燃每2个水分子在通电的条件下生成2个氢分子和1个氧分子每4个磷原子和5个氧分子在点燃的条件下生成2个五氧化二磷分子MnO2每2个过氧化氢分子在二氧化锰的催化作用下生成2个水分子和1个氧分子我会读读一读下列化学方程式(微观读法)
方法指导:同桌互读,相互纠正。时间1分钟。
相对质量
物质质量之比 12 : 32 : 44
质量读法:每12份质量的碳和32份质量的氧气完全反应生成44份质量的二氧化碳。化学方程式意义:3、表示反应物、生成物的质量关系。即物质之间的质量比。(质量意义)
1216×212+16×22×1×2
=416×2
=322×(1×2+16)
=36化学方程式是怎样体现质量守恒定律的?你知道吗反应物的总质量份数:4+32 生成物的总质量份数:
=36 36可见:化学方程式体现了反应前后各物质的质量总和相等。物质质量比2H2+O2
====
2H2O点燃
质量比 4 32 36质量读法:每4份质量的氢气和32份质量的氧气完全反应生成36份质量的水。
想一想:
1、4克氢气完全燃烧,需要消耗多少克氧气?同时能生成多少克水?
2、4克氢气和33克氧气在点燃的条件下充分反应能生成多少克水?你的依据是什么?
3、4克氢气与4克氧气能恰好完全反应吗?若不能哪种物质有剩余?
挑战自我计算反应物和生成物各物质之间的质量比,并说出质量意义。
相对原子质量: H: 1 O: 16 Mg: 24
2H2O2 = 2H2O + O2↑
质量比
2Mg + O2= 2MgO
质量比MnO2点燃 68 36 32 48 32 80每68份质量的过氧化氢完全反应生成36份质量的水和32 份质量的氧气。每48份质量的镁和32份质量的氧气完全反应生成80份质量的氧化镁。⑴表明了反应物、生成物和反应条件。(宏观)⑵表示反应物、生成物各物质的微观粒子数之比(微观)⑶表示反应物、生成物各物质之间的质量关系,即物质之间的质量比。(质量)一、 化学方程式
1、定义
2、遵循原则
⑴遵循客观事实 ⑵遵循质量守恒定律
3、意义读
法:1.氢气和氧气在点燃的条件下反应生成水。(宏观)3.每4份质量的氢气和32份质量的氧气完全反应生成36份质量的水。(质量)2.每2个氢分子和1个氧分子完全反应生成2个水分子。(微观)16×2
=32
2×1×2
=42H2 + O2 = 2H2O点燃2×(1×2+16)
=364P + 5O2 ==== 2P2O5
124 160 284点燃1.表示磷和氧气在点燃条件下生成五氧化二磷。2.表示磷原子、氧分子和五氧化二磷分子的个数比为4∶5∶2。3.表示每124份质量的磷与160份质量的氧气反应生成284份质量的五氧化二磷。即磷、氧气、五氧化二磷的质量比为 124∶160∶284。请从三个方面描述下列化学方程式的意义:
1.火箭用联氨(N2H4)作燃料,一氧化氮作氧化剂。反应的化学方程式是:N2H4+2NO == 2X+2H2O,求X的化学式( )点燃A.N2 B.NO2 C.NH3 D.N2OAN原子数目: 4
H原子数目: 4 4
O原子数目: 2 2归纳方法:从化学式全部已知的一边入手。C1、下图是某个化学反应前后的微观模拟图,请根据图示判断参加反应
的 和 与反应后生成物的分子个数比是 。
用图示表示这一化学反应为: 2:1:2在一密闭容器中有甲、乙、丙、丁四种物质,测得反应前后的质量如下: 单位(g)试判断哪些是反应物,哪些是生成物,各物质的质量比为多少?根据质量守恒定律,反应前后容器内物质的总质量不变,算出反应后甲的质量416911
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
