人教版化学选修4第二章第二节《影响化学反应速率的因素》 课件共20张PPT
文档属性
| 名称 | 人教版化学选修4第二章第二节《影响化学反应速率的因素》 课件共20张PPT |  | |
| 格式 | zip | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-25 19:00:43 | ||
图片预览








文档简介
课件20张PPT。温馨提示请大家拿出你的热情,请相信:
你是最优秀的,你一定能做的更好!前后3桌6个同学为一组,组内先推荐一名组长。组长负责分配工作。 分组图示讲台探究
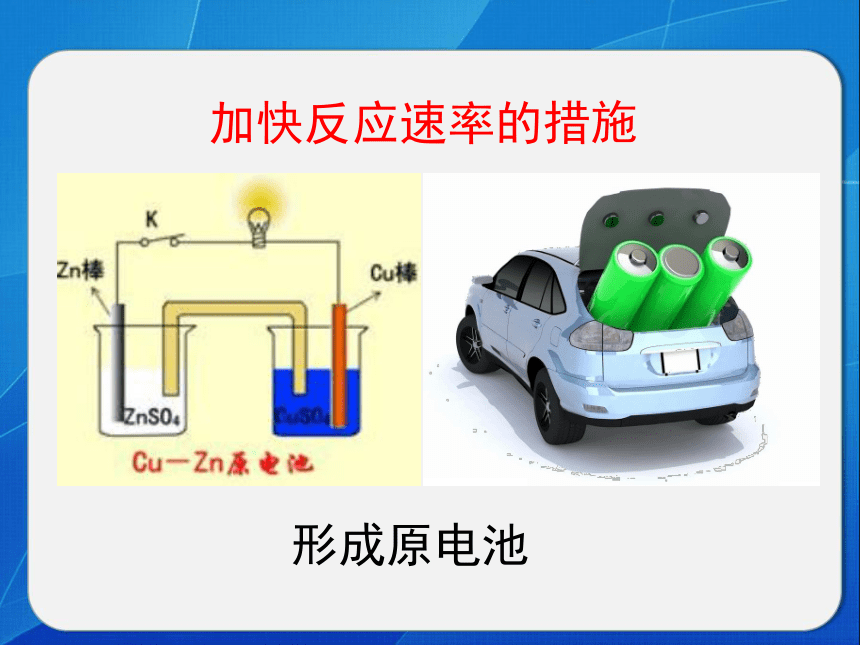
影响化学反应速率的因素给洗衣粉加酶 加快反应速率的措施 加快反应速率的措施形成原电池用煤粉代替煤块 加快反应速率的措施 加快反应速率的措施炉膛鼓风汽车加大油门 加快反应速率的措施减慢反应速率的措施把食物放进冰箱
减慢反应速率的措施食品袋中加除氧剂减慢反应速率的措施给铁栅栏涂油漆哪些外界条件对化学反应速率有影响?一、问题讨论①作出猜想:②设计方案:③实验方案:④交流分享:⑤得出结论:分析实例,提炼信息紧扣课本,根据药品分工合作,真实记录共享结果,解释现象综合归纳,验证猜想二、合作探究一组
二组三组
四组五组
六组七组
八组展示要求:
1、第一个同学在展示台上投出学案,面向同学,语言简洁、准确,声音洪亮,动作迅速;第二个同学补充。
2、下面的同学学会倾听,填好自己的学案,准备质疑和补充。实验要求:
1、请注意实验的规范操作;
2、组长进行分工合作:操作1人,
记录学案1人,其他同学观察现象。
3、4个因素均要探究,时间为12min。
4、让讨论的声音尽量不影响其他组。秀出我的风采我的课堂我做主三、拓展延伸——用有效碰撞理论解释1、浓度对化学反应速率的影响a.其他条件不变的情况下,增加反应物的浓度,_________数目增多,__________次数增多,反应速率增大。
注意: 可认为其浓度为常数,它们的量的改变
不会影响化学反应速率。活化分子有效碰撞固体和纯液体2、压强对化学反应速率的影响b.其他条件不变的情况下,增大压强,相当于增大______,所以________数目增多,________次数增多,反应速率增大。
注意:压强主要针对有 参加的化学反应。三、拓展延伸——用有效碰撞理论解释浓度活化分子有效碰撞气体
c.其他条件不变的情况下,升高温度,反应物分子能量增加,
__________数目增多,_________次数增多,反应速率增大。
d.其他条件不变的情况下,催化剂能降低反应的 ,
使更多的分子成为活化分子,从而增加了单位体积内的
,成千成万倍地增大化学反应速率。活化分子有效碰撞活化能活化分子所占的百分数三、拓展延伸——用有效碰撞理论解释小结与反思 本节课的主要收获是什么?自主学习要求:
1、先独立完成学案上【反馈练习】【直击高考】;
2、然后同学们组内统一答案;
3、接着1V1辅导,力争组员都弄明白;
4、最后展示一个小组的答案。四、自主学习——学会学习,自我提高Thank you !一组
二组三组
四组五组
六组七组
八组设计案例:
如探究浓度对反应速率的影响
方案一:秀出我的风采设计思路:
1、根据桌面给定的药品和仪器;
2、做对照实验;
3、控制1个变量;
4、设计共同因素的2个组,1个组展示设计方案,1个组补充。方案设计
你是最优秀的,你一定能做的更好!前后3桌6个同学为一组,组内先推荐一名组长。组长负责分配工作。 分组图示讲台探究
影响化学反应速率的因素给洗衣粉加酶 加快反应速率的措施 加快反应速率的措施形成原电池用煤粉代替煤块 加快反应速率的措施 加快反应速率的措施炉膛鼓风汽车加大油门 加快反应速率的措施减慢反应速率的措施把食物放进冰箱
减慢反应速率的措施食品袋中加除氧剂减慢反应速率的措施给铁栅栏涂油漆哪些外界条件对化学反应速率有影响?一、问题讨论①作出猜想:②设计方案:③实验方案:④交流分享:⑤得出结论:分析实例,提炼信息紧扣课本,根据药品分工合作,真实记录共享结果,解释现象综合归纳,验证猜想二、合作探究一组
二组三组
四组五组
六组七组
八组展示要求:
1、第一个同学在展示台上投出学案,面向同学,语言简洁、准确,声音洪亮,动作迅速;第二个同学补充。
2、下面的同学学会倾听,填好自己的学案,准备质疑和补充。实验要求:
1、请注意实验的规范操作;
2、组长进行分工合作:操作1人,
记录学案1人,其他同学观察现象。
3、4个因素均要探究,时间为12min。
4、让讨论的声音尽量不影响其他组。秀出我的风采我的课堂我做主三、拓展延伸——用有效碰撞理论解释1、浓度对化学反应速率的影响a.其他条件不变的情况下,增加反应物的浓度,_________数目增多,__________次数增多,反应速率增大。
注意: 可认为其浓度为常数,它们的量的改变
不会影响化学反应速率。活化分子有效碰撞固体和纯液体2、压强对化学反应速率的影响b.其他条件不变的情况下,增大压强,相当于增大______,所以________数目增多,________次数增多,反应速率增大。
注意:压强主要针对有 参加的化学反应。三、拓展延伸——用有效碰撞理论解释浓度活化分子有效碰撞气体
c.其他条件不变的情况下,升高温度,反应物分子能量增加,
__________数目增多,_________次数增多,反应速率增大。
d.其他条件不变的情况下,催化剂能降低反应的 ,
使更多的分子成为活化分子,从而增加了单位体积内的
,成千成万倍地增大化学反应速率。活化分子有效碰撞活化能活化分子所占的百分数三、拓展延伸——用有效碰撞理论解释小结与反思 本节课的主要收获是什么?自主学习要求:
1、先独立完成学案上【反馈练习】【直击高考】;
2、然后同学们组内统一答案;
3、接着1V1辅导,力争组员都弄明白;
4、最后展示一个小组的答案。四、自主学习——学会学习,自我提高Thank you !一组
二组三组
四组五组
六组七组
八组设计案例:
如探究浓度对反应速率的影响
方案一:秀出我的风采设计思路:
1、根据桌面给定的药品和仪器;
2、做对照实验;
3、控制1个变量;
4、设计共同因素的2个组,1个组展示设计方案,1个组补充。方案设计
