人教版九年级下册9-3 浓度课件(共26张)
文档属性
| 名称 | 人教版九年级下册9-3 浓度课件(共26张) |

|
|
| 格式 | zip | ||
| 文件大小 | 874.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-27 00:00:00 | ||
图片预览








文档简介
课件26张PPT。第九单元 溶液
课题3 溶液的浓度教学目标:
1、掌握一种溶液浓度的表示方法——溶质的质量分数,并能进行溶质质量分数的简单计算。
2、初步学会配制一定溶质质量分数的溶质。
教学重点:
1、溶质的质量分数的概念及简单计算。
2、配制溶液的操作步骤。
教学难点:
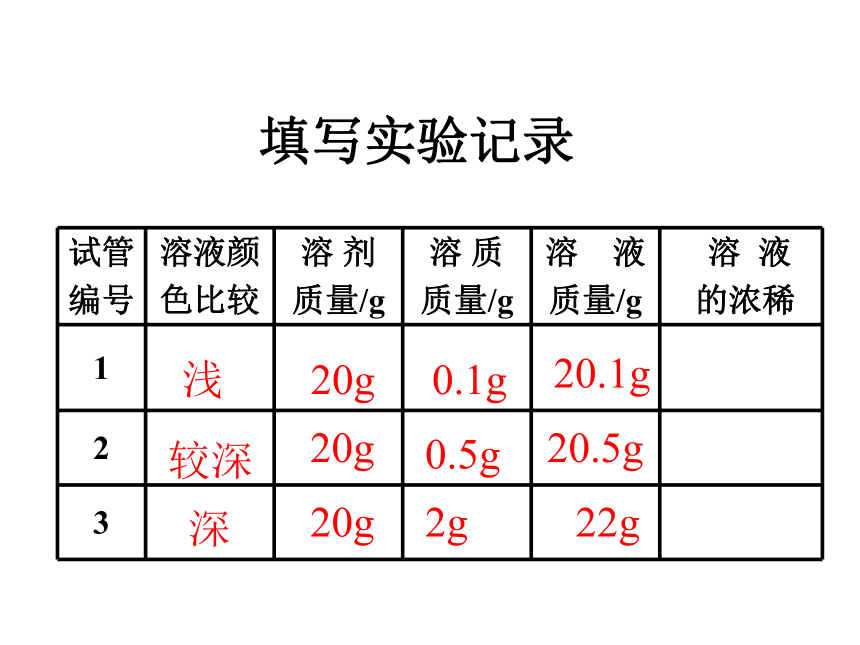
1、溶质的质量分数的有关计算。演示实验9-7颜色:淡蓝 蓝色 深蓝浅较深深20g20g20g0.1g0.5g2g20.1g20.5g 22g填写实验记录分析实验结论 ①对于有色溶液,我们可以根据颜色深浅来判断溶液是
浓还是浅;但是这种分法比较粗略,不能准确地表明一定
量溶液里究竟含有多少溶质。
②在实际应用中,常常要准确知道一定量溶液里含有多少溶质,即溶液的浓度(浓稀程度)
药液太稀不能杀死害虫和病菌,但药液太浓又会毒害农作物或树木。喷洒农药分析实验结论 ①对于有色溶液,我们可以根据颜色深浅来判断溶液是
浓还是稀;但是这种分法比较粗略,不能准确地表明一定
量溶液里究竟含有多少溶质。 ②在实际应用中,常常要准确知道一定量溶液里含有多少溶质,即溶液的浓度(浓稀程度)。 ③表示溶液浓度(浓稀程度)的方法很多,今天我们学习:溶质的质量分数公式推导
溶质的质量=溶液质量×溶质质量分数
溶液质量=溶质的质量÷溶质质量分数
浅较深深20g20g20g0.1g0.5g 2g20.1g20.5g 22g0.5%2.4%9.1% 练一练: 在实验9-7中,三种硫酸铜溶液中溶质的质量分数各是多少?把计算结果填写在下表中。 [实验9-8]10%20%全部溶解全部溶解讨论:已知20℃时,氯化钠的溶解度是36g。有人
说:“20℃时氯化钠饱和溶液中溶质的质量
分数为36%。”这种说法对吗?为什么?分析:溶解度 氯化钠(溶质) 水(溶剂)饱和溶液 溶质的质量分数36g 36g 100g 136g 26.5%饱和溶液的溶质质量分数= 溶解度100g+溶解度结论:溶质质量分数的含义: 100g 5 % 的食盐溶液
①.5g食盐溶于95g水形成的溶液。
②.食盐的质量占整个食盐溶液的5%。
③.将100g食盐溶液蒸干可以得到食盐5g。
④.组成:M(食盐):M(水):M(食盐溶液) =
5 : 95 : 100
溶质的质量分数溶液质量小结 例1在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150Kg这种溶液,需要氯化钠和水的质量各是多少?解:150Kg16%24Kg有没有其他的方法课堂练习课本第45页:练习与应用1、2;第九单元 溶液
课题3 溶液的浓度(第二课时)例2: 化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?分析: 解题关键是把握稀释前后溶质的质量不变。设稀释后溶液的质量为x50g× 98% = X × 20% X=245g
需要水的质量=245g-50g=195g 答:需要水的质量为195g。解:稀释前溶液中溶质质量稀释后溶液中溶质质量解法二:用固体配制一定溶质质量分数的溶液 主要仪器:托盘天平、烧杯、量筒、玻璃棒、药匙、胶头滴管实验步骤:①计算;②称量;
③溶解;④装瓶,贴标签。配制溶质质量分数一定的溶液如何配制50g质量分数为6%的氯化钠溶液1、计算:配制时所需NaCl质量为__________,
所需水的质量_____,2、称量用托盘天平称3gNaCl固体,倒入烧杯中用50mL量筒量取47mL水,倒入盛有NaCl
的烧杯中3、溶解:用玻璃棒搅拌,使NaCl全部溶解 4、把配好的溶液装入细口瓶瓶中,盖好瓶塞并贴上标签。
(药品名称和溶质的质量分数)3g47g相当于47mL练习:下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。当堂练习:1、配制500mL密度为1.1g/mL的10%的NaOH溶液
需要多少gNaOH和多少g水?解:所需NaOH的质量为:500mL×1.1g/mL×10% = 55g所需水的质量为:500mL×1.1g/mL – 55g = 495g答:略ρ = 1.1g/mLV液= 500mLX%=10%分析:已知:未知:M溶质 M溶剂解: M溶液 = V液× ρ M溶质 = M溶液 × X% M溶剂= M溶液 - M溶质 练习:100g某硫酸恰好和13g锌完全反应 。求该稀硫酸溶质的质量分数。H2SO4 + Zn = ZnSO4 + H2? 98 65100g 100g某硫酸(H2SO4 H2O)13gZn×13g√解:设100g某硫酸中含溶质H2SO4的质量为XXX=19.6g该某硫酸溶质的质量分数=19.6g÷100g×100%= 19.6%答:略分析:课堂练习课本第45页:练习与应用3、6、7、8;溶质质量的确定:
(1)当物质不与溶剂反应并且完全溶解时,投入溶剂中的物质溶解的质量就是溶质质量;
(2)当物质不与溶剂反应但未完全溶解时,只有溶解的物质的质量才是溶质质量;
(3)当物质与溶剂发生反应,所得溶液中的溶质为反应生成的物质,应根据《化学方程式》求出溶质质量。溶液质量的确定:
(1)反应没有气体或沉淀生成时:
溶液的质量=反应前总质量之和;
(2)反应有气体或者是沉淀生成时:
溶液的质量=反应前总质量 - 生成气体的质量 - 生成沉淀质量
课题3 溶液的浓度教学目标:
1、掌握一种溶液浓度的表示方法——溶质的质量分数,并能进行溶质质量分数的简单计算。
2、初步学会配制一定溶质质量分数的溶质。
教学重点:
1、溶质的质量分数的概念及简单计算。
2、配制溶液的操作步骤。
教学难点:
1、溶质的质量分数的有关计算。演示实验9-7颜色:淡蓝 蓝色 深蓝浅较深深20g20g20g0.1g0.5g2g20.1g20.5g 22g填写实验记录分析实验结论 ①对于有色溶液,我们可以根据颜色深浅来判断溶液是
浓还是浅;但是这种分法比较粗略,不能准确地表明一定
量溶液里究竟含有多少溶质。
②在实际应用中,常常要准确知道一定量溶液里含有多少溶质,即溶液的浓度(浓稀程度)
药液太稀不能杀死害虫和病菌,但药液太浓又会毒害农作物或树木。喷洒农药分析实验结论 ①对于有色溶液,我们可以根据颜色深浅来判断溶液是
浓还是稀;但是这种分法比较粗略,不能准确地表明一定
量溶液里究竟含有多少溶质。 ②在实际应用中,常常要准确知道一定量溶液里含有多少溶质,即溶液的浓度(浓稀程度)。 ③表示溶液浓度(浓稀程度)的方法很多,今天我们学习:溶质的质量分数公式推导
溶质的质量=溶液质量×溶质质量分数
溶液质量=溶质的质量÷溶质质量分数
浅较深深20g20g20g0.1g0.5g 2g20.1g20.5g 22g0.5%2.4%9.1% 练一练: 在实验9-7中,三种硫酸铜溶液中溶质的质量分数各是多少?把计算结果填写在下表中。 [实验9-8]10%20%全部溶解全部溶解讨论:已知20℃时,氯化钠的溶解度是36g。有人
说:“20℃时氯化钠饱和溶液中溶质的质量
分数为36%。”这种说法对吗?为什么?分析:溶解度 氯化钠(溶质) 水(溶剂)饱和溶液 溶质的质量分数36g 36g 100g 136g 26.5%饱和溶液的溶质质量分数= 溶解度100g+溶解度结论:溶质质量分数的含义: 100g 5 % 的食盐溶液
①.5g食盐溶于95g水形成的溶液。
②.食盐的质量占整个食盐溶液的5%。
③.将100g食盐溶液蒸干可以得到食盐5g。
④.组成:M(食盐):M(水):M(食盐溶液) =
5 : 95 : 100
溶质的质量分数溶液质量小结 例1在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150Kg这种溶液,需要氯化钠和水的质量各是多少?解:150Kg16%24Kg有没有其他的方法课堂练习课本第45页:练习与应用1、2;第九单元 溶液
课题3 溶液的浓度(第二课时)例2: 化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?分析: 解题关键是把握稀释前后溶质的质量不变。设稀释后溶液的质量为x50g× 98% = X × 20% X=245g
需要水的质量=245g-50g=195g 答:需要水的质量为195g。解:稀释前溶液中溶质质量稀释后溶液中溶质质量解法二:用固体配制一定溶质质量分数的溶液 主要仪器:托盘天平、烧杯、量筒、玻璃棒、药匙、胶头滴管实验步骤:①计算;②称量;
③溶解;④装瓶,贴标签。配制溶质质量分数一定的溶液如何配制50g质量分数为6%的氯化钠溶液1、计算:配制时所需NaCl质量为__________,
所需水的质量_____,2、称量用托盘天平称3gNaCl固体,倒入烧杯中用50mL量筒量取47mL水,倒入盛有NaCl
的烧杯中3、溶解:用玻璃棒搅拌,使NaCl全部溶解 4、把配好的溶液装入细口瓶瓶中,盖好瓶塞并贴上标签。
(药品名称和溶质的质量分数)3g47g相当于47mL练习:下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。当堂练习:1、配制500mL密度为1.1g/mL的10%的NaOH溶液
需要多少gNaOH和多少g水?解:所需NaOH的质量为:500mL×1.1g/mL×10% = 55g所需水的质量为:500mL×1.1g/mL – 55g = 495g答:略ρ = 1.1g/mLV液= 500mLX%=10%分析:已知:未知:M溶质 M溶剂解: M溶液 = V液× ρ M溶质 = M溶液 × X% M溶剂= M溶液 - M溶质 练习:100g某硫酸恰好和13g锌完全反应 。求该稀硫酸溶质的质量分数。H2SO4 + Zn = ZnSO4 + H2? 98 65100g 100g某硫酸(H2SO4 H2O)13gZn×13g√解:设100g某硫酸中含溶质H2SO4的质量为XXX=19.6g该某硫酸溶质的质量分数=19.6g÷100g×100%= 19.6%答:略分析:课堂练习课本第45页:练习与应用3、6、7、8;溶质质量的确定:
(1)当物质不与溶剂反应并且完全溶解时,投入溶剂中的物质溶解的质量就是溶质质量;
(2)当物质不与溶剂反应但未完全溶解时,只有溶解的物质的质量才是溶质质量;
(3)当物质与溶剂发生反应,所得溶液中的溶质为反应生成的物质,应根据《化学方程式》求出溶质质量。溶液质量的确定:
(1)反应没有气体或沉淀生成时:
溶液的质量=反应前总质量之和;
(2)反应有气体或者是沉淀生成时:
溶液的质量=反应前总质量 - 生成气体的质量 - 生成沉淀质量
同课章节目录
