人教版(五四)九年级化学 1.金属和金属材料 单元练习(含解析)
文档属性
| 名称 | 人教版(五四)九年级化学 1.金属和金属材料 单元练习(含解析) |

|
|
| 格式 | zip | ||
| 文件大小 | 152.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
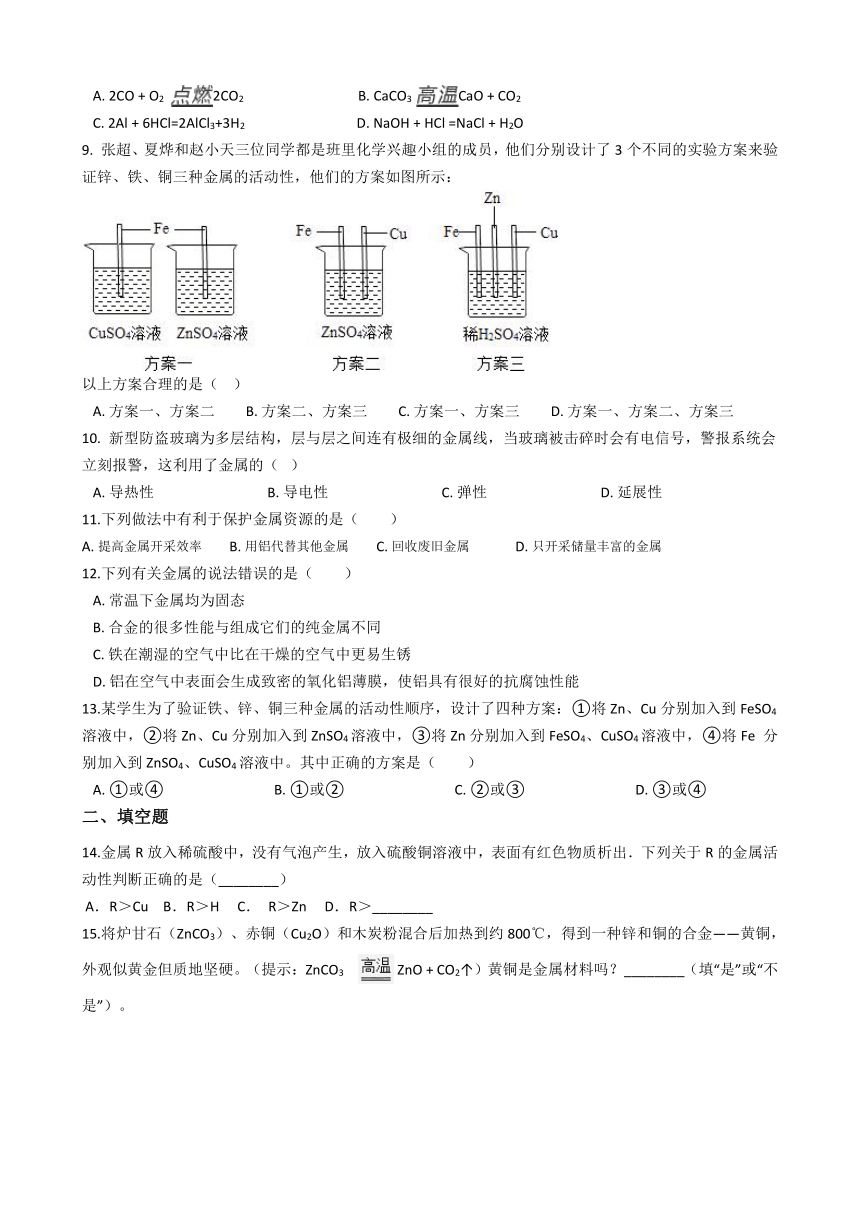
| 科目 | 化学 | ||
| 更新时间 | 2019-06-25 00:00:00 | ||
图片预览




文档简介
人教版(五四)九年级化学跟踪训练 1.金属和金属材料
一、单选题
1.地壳中含量最多的元素是(?? )
A.?Al??????????????????????????????????????????B.?Fe??????????????????????????????????????????C.?Si??????????????????????????????????????????D.?O
2. 下列说法错误的是( )
A.?C可能是铜??????????????????????????????????????????????????????????B.?将Fe放在B的盐溶液中可以置换出B C.?四种金属的活动性顺序是:A>B>Fe>C???????????D.?钢和生铁都是铁合金
3.向AgNO3和Cu(NO3)2混合溶液中加入一定量的锌粉,充分反应后再加入稀盐酸无明显现象.下列说法正确的是(?? )
A.?锌粉全部反应?????????????????????????????????????????????????????B.?所得溶液中一定有Zn2+、Cu2+ C.?一定没有银粉生成??????????????????????????????????????????????D.?所得溶液中一定有Cu2+、Ag+
4.下列与金属有关的说法正确的是(???? )
A.?生铁和钢都是铁的合金???????????????????????????????????????B.?废旧电池可以随意丢弃,不会对环境造成污染 C.?银的导电性比铜强,所以一般用银线作电线????????D.?铁矿石在地壳中含量最丰富,可以随意开采
5.下列家庭日用品中不含金属材料的是?????????????????? (???? )
A.?瓷花瓶??????????????????????????????????B.?导线??????????????????????????????????C.?电视机??????????????????????????????????D.?电池
6.下列关于金属和合金的叙述中错误的是(?? )
A.?合金的硬度一般比各成分金属大?????????????????????????B.?生铁可以完全溶解在足量的稀盐酸中 C.?金属与金属、金属与非金属都可能形成合金????????D.?长期使用铁锅烹调可以摄入铁元素从而预防缺铁性贫血
7.如图所示,弹簧秤下挂一重物,重物浸没在AgNO3溶液中,稳定时弹簧秤的读数为F1。再向烧杯中加入适量的铜粉,充分搅拌并静置足够的时间后,溶液的体积未变,此时弹簧秤的读数为F2。已知重物与前、后溶液均不发生任何反应,对于F1和F2的相对大小,下列说法正确的是(? ?)
A.?无法判断??????????????????????????????B.?F2.<F1??????????????????????????????C.?F2>F1??????????????????????????????D.?F2=F1
8.下列反应属于置换反应的是 (??? )
A.?2CO + O2 2CO2?????????? ??????????????????????????????B.?CaCO3 CaO + CO2 C.?2Al + 6HCl=2AlCl3+3H2 ??????????????????????????????????D.?NaOH + HCl =NaCl + H2O?
9. 张超、夏烨和赵小天三位同学都是班里化学兴趣小组的成员,他们分别设计了3个不同的实验方案来验证锌、铁、铜三种金属的活动性,他们的方案如图所示:
以上方案合理的是(?? )
A.?方案一、方案二?????????B.?方案二、方案三?????????C.?方案一、方案三?????????D.?方案一、方案二、方案三
10. 新型防盗玻璃为多层结构,层与层之间连有极细的金属线,当玻璃被击碎时会有电信号,警报系统会立刻报警,这利用了金属的(? )
A.?导热性?????????????????????????????????B.?导电性?????????????????????????????????C.?弹性?????????????????????????????????D.?延展性
11.下列做法中有利于保护金属资源的是( )
A.?提高金属开采效率????????B.?用铝代替其他金属????????C.?回收废旧金属??????????D.?只开采储量丰富的金属
12.下列有关金属的说法错误的是( )
A.?常温下金属均为固态 B.?合金的很多性能与组成它们的纯金属不同 C.?铁在潮湿的空气中比在干燥的空气中更易生锈 D.?铝在空气中表面会生成致密的氧化铝薄膜,使铝具有很好的抗腐蚀性能
13.某学生为了验证铁、锌、铜三种金属的活动性顺序,设计了四种方案:①将Zn、Cu分别加入到FeSO4溶液中,②将Zn、Cu分别加入到ZnSO4溶液中,③将Zn分别加入到FeSO4、CuSO4溶液中,④将Fe 分别加入到ZnSO4、CuSO4溶液中。其中正确的方案是( )
A.?①或④????????????????????????????????B.?①或②????????????????????????????????C.?②或③????????????????????????????????D.?③或④
二、填空题
14.金属R放入稀硫酸中,没有气泡产生,放入硫酸铜溶液中,表面有红色物质析出.下列关于R的金属活动性判断正确的是(________) ?A.R>Cu?? B.R>H??? C. R>Zn??? D.R>________
15.将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭粉混合后加热到约800℃,得到一种锌和铜的合金——黄铜,外观似黄金但质地坚硬。(提示:ZnCO3?? ?ZnO + CO2↑)黄铜是金属材料吗?________(填“是”或“不是”)。
16.某同学为了探究相关金属的性质,做了下列实验: ① A 中现象________;B 中反应的基本类型是________反应。 ② 通过 A 和 B 实验不能证明铁、铜、银三种金属的活动性强弱,需补充一个实验达到 实验目的,写出该反应的化学方程式为________。 ③ 实验 C 中物质充分反应后,猜想试管中溶液的溶质是 Ⅰ. Fe(NO3)2、Cu(NO3)2、AgNO3? Ⅱ. Fe (NO3)2、AgNO3? Ⅲ.Fe (NO3)2、Cu(NO3)2 Ⅳ.________。 其中只有一个不合理的猜想是________。(填编号) ④ 进行定量实验可确定猜想。 操作Ⅰ是________。根据数据分析,③中猜想________成立(填编号)。
三、解答题
17.理论上要炼出含碳4%的生铁583t,需要含四氧化三铁80%的磁铁矿石多少吨?(计算结果保留整数).
四、综合题
18. 在学习金属的性质时,老师拿来了三种外观酷似金、银、铜的样品,同学们对样品进行以下探究:
①用锤子砸“金”,样品粉碎;
②加入稀盐酸:“金”和“铜”没有现象,“银”有大量气泡产生;
③测定密度:“金”4.9g/cm3 , “银”7.1g/cm3 , “铜”7.5g/cm3 .
④查阅几种常见金属的密度,如下表:
金属
金
银
铜
铁
锌
? 密度(g/cm3)
?19.3
10.5
8.9
7.9
7.1
(1)根据以上探究,确定“金”是假的理由有哪些?推测“银”可能是什么金属,依据是什么?
(2)已知“铜”只有表面镀了一薄层致密的铜,内部是锌.若不粉碎“铜”,选用稀硫酸和锌粉,测定一定质量“铜”样品中铜的质量,设计实验方案.
19.据最新消息,鲁南高铁临沂段将于2019年底建成开通,不久的将来我们就可以坐上高铁出行了。结合所学的化学知识,回答下列有关问题:
(1)修建高铁所需大量钢铁是以铁矿石为主要原料冶炼而得,写出用一氧化碳和赤铁矿炼铁的化学方程式________;
(2)雨后的铁轨表面易产生少量的锈迹,实际上是铁与空气中的________、________等发生了化学反应;
(3)高铁钢轨采用无缝焊接,其反应原理是铝在高温条件下与氧化铁反应得到熔融的铁与另一种氧化物,该反应基本类型是________;
(4)在实验室中探究铁、铜的金属活动性顺序,除铁、铜外,还需要一种试剂,你选择的试剂是________(填序号)。①AgNO3溶液??? ②CuSO4溶液??? ③Al2(SO4)3溶液
答案解析部分
一、单选题
1.【答案】 D
【解析】【解答】地壳中元素的含量由多到少的顺序是:氧、硅、铝、铁、钙…….; 故答案为:D
【分析】根据地壳中含量最多的元素的氧元素解答
2.【答案】 B
【解析】【解答】A、由图示可知,C不与稀盐酸反应,C的位置排在氢的后面,可能是铜,故选项说法正确;
B、图中B物质与稀盐酸反应比铁更剧烈,说明了金属活动性B>铁;将Fe放在B的盐溶液中,不能发生置换反应,不能置换出B,故选项说法错误;
C、由图中金属与酸反应的剧烈程度,A反应最剧烈,B其次,C再次,C不与稀盐酸反应,则四种金属的活动性顺序是:A>B>Fe>C,故选项说法正确;
D、钢和生铁都是铁的合金,生铁是含碳量为2%~4.3%的铁合金,钢是含碳量为0.03%~2%的铁合金,故选项说法正确;
故选:B.
【分析】A、根据图示可知,C不与稀盐酸反应,据此进行分析判断;
B、根据图中B物质与稀盐酸反应比铁更剧烈,进行分析判断;
C、由图中金属与酸反应的剧烈程度,进行分析判断;
D、根据常见的铁合金的种类,进行分析判断.
3.【答案】A
【解析】【解答】解:由题意可知,向AgNO3和Cu(NO3)2混合溶液中加入一定量的锌粉,发生的反应有锌可置换硝酸银中的银、锌可置换硝酸铜中的铜,生成的铜还可以置换硝酸银中的银.充分反应后再加入稀盐酸无明显现象,说明了溶液中锌没有剩余,铜不能确定.由此可知:
A、锌全部参加了反应,没有剩余,故A正确;
B、所得溶液中一定有Zn2+ , Cu2+不能确定,故B错误;
C、溶液中一定有银粉生成,故C错误;
D、所得溶液中Ag+ , Cu2+不能确定,故D错误.
故答案为:A
【分析】根据金属活动性由强到弱的关系(Zn>Cu>Ag),锌可置换硝酸银中的银、锌可置换硝酸铜中的铜,生成的铜还可以置换硝酸银中的银.充分反应后再加入稀盐酸无明显现象,说明锌全部参加了反应,根据以上反应及现象,分析反应的发生情况,推断所得固体及溶液中的离子.
4.【答案】 A
【解析】【解答】生铁和钢都是铁和碳的合金,故A项正确;废旧电池中含有会污染环境的重金属,故B项错误;银的导电性虽然强但由于价格昂贵一般不用银做电线,故C项错误;为保护铁资源,应合理开采铁矿石,故D项错误。
【分析】该题考查了金属材料及其应用
5.【答案】 A
【解析】【解答】A.瓷花瓶由陶瓷制成,属于无机非金属材料,A错误
B.导线中含有金属,B正确
C.电视机中含有金属材料,C正确
D.电池中含有金属材料,D正确
【分析】根据已有知识分析瓷花瓶由陶瓷制成,属于无机非金属材料,导线中含有金属,电视机中含有金属材料,电池中含有金属材料
6.【答案】 B
【解析】【解答】A、合金的硬度一般比各组成成分的金属大,A不符合题意;
B、生铁不能完全溶解在足量的稀盐酸中,因为生铁中的碳不能和稀盐酸反应,也不溶于水,B符合题意;
C、金属与金属、金属与非金属都可能形成合金,C不符合题意;
D、长期使用铁锅烹调可以摄入铁元素从而预防缺铁性贫血,D不符合题意.
故答案为:B. 【分析】一种金属和其它物质熔合而成的具有金属特性的物质是合金;生铁的主要成分是铁,还含有碳等物质;人体缺乏铁元素时,易患缺铁性贫血.
7.【答案】 C
【解析】【解答】根据“弹簧称下挂一重物,重物浸没在AgNO3溶液中,稳定时弹簧称读数F1 . 再向烧杯中加入适量的铜粉,充分搅拌并配制足够的时间后,溶液体积未变,此时弹簧秤的读数为F2”,可知铜与硝酸银反应生成硝酸铜和银,反应的化学方程式为:
Cu+2AgNO2═Cu(NO3)2+
2Ag
64
216
则可推测溶液质量减小,溶液体积不变而质量减小,则溶液密度减小,溶液密度的减小使重物所受浮力减小,浮力的减小而使弹簧秤的读数增大,C符合题意。 故答案为:C。 【分析】本题主要考查金属的活泼性,活泼金属能够置换出不活泼金属。
8.【答案】 C
【解析】【解答】A.反应物两种,生成物一种,为化合反应,不符合题意; B.反应物一种,生成物两种,为分解反应,不符合题意; C.反应物和生成物都是一种单质和一种化合物,为置换反应,符合题意; D.反应物和生成物都是化合物,为复分解反应,不符合题意; 故答案为:C。
【分析】根据置换反应定义进行分析,置换反应要求反应物和生成物中都是一种单质和一种化合物。
9.【答案】C
【解析】【解答】解:方案一:铁能与硫酸铜溶液反应,说明铁在铜的前面,铁不能与硫酸锌溶液反应,说明铁在锌的后面,能证明锌>铁>铜,故方案一可行;
方案二:铁、铜与硫酸锌溶液都不反应,说明铜、铁在锌的后面,但是不能说明铁和铜的顺序,故方案二不可行;
方案三、铁片和锌粒都能与稀硫酸反应生成氢气,且锌与盐酸的反应速率大于铁与盐酸反应的速率,说明锌在铁的前面,且都在氢前,铜不与盐酸反应,说明铜在氢后,能证明锌>铁>铜,故方案三可行.
综合以上分析可知,C正确.
故选C.
【分析】在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,氢前的金属能与酸反应生成氢气.
10.【答案】 B
【解析】【解答】解:A、当玻璃被击碎时,与金属线相连的警报系统就会立刻报警,是利用了金属的导电性,与金属的导热性无关,故选项错误.
B、当玻璃被击碎时,与金属线相连的警报系统就会立刻报警,与导电性有关,是利用了金属的导电性,故选项正确.
C、当玻璃当玻璃被击碎时,与金属线相连的警报系统就会立刻报警,是利用了金属的导电性,与金属的弹性无关,故选项错误.
D、当玻璃当玻璃被击碎时,与金属线相连的警报系统就会立刻报警,是利用了金属的导电性,与金属的延展性无关,故选项错误.
故选B.
【分析】金属具有良好的导电性、导热性和延展性等,根据题干信息,当玻璃被击碎时会有电信号,警报系统会立刻报警,是利用了金属的导电性.
11.【答案】 C
【解析】【解答】A、要合理有序的开采金属矿产资源,而不能大量开采金属资源,因为金属资源属于不可再生能源,故A错误;
B、铝也属于金属资源,所以用铝代替其他金属不利于保护金属资源,故B错误;
C、回收废旧金属,可以节约金属资源,利于保护金属资源,故C正确;
D、只开采储量丰富的金属会造成金属资源的浪费,不利于保护金属资源,故D错误;
故选:C.
【分析】A、根据要合理有序的开采金属矿产资源进行解答;
B、根据铝也属于金属资源进行解答;
C、根据回收废旧金属,可以节约金属资源进行解答;
D、根据只开采储量丰富的金属会造成金属资源的浪费进行解答.
12.【答案】 A
【解析】【分析】A、在常温下下汞是液体; B、合金是具有金属特性的物质; C、铁在与氧气和水充分接触时容易生锈; D、铝具有自我保护作用,铝表面易形成致密的氧化膜
【解答】A、金属具有金属光泽,常温下大部分金属都是固体,但常温下汞是液体.故选项正确; B、合金是具有金属特性的物质;性能与组成它的金属的性能有差别;故选项错误; C、铁生锈的条件是铁同时与水和空气接触,所以铁在潮湿的空气中比在干燥的空气中更易生锈;故选项错误; D、铝具有自我保护作用,铝表面易形成致密的氧化膜可阻止铝进一步被氧化,故选项错误 故选A
【点评】解答本题要掌握各种物质的性质方面的知识,只有这样才能对相关方面的问题做出正确的判断.
13.【答案】 A
【解析】【解答】 ①锌的活动性比铁强,可以置换出铁,而铜不能置换出铁,所以可以区分出活动性强弱;
②难以比较铁的活动性和铜、锌的活动性孰强孰弱,所以该方案不可行; ③锌可以把铁和铜置换出来,但是不能比较铁和铜的活动性,所以该方案不可行; ④铁不能置换出锌,但是可以置换出铜,所以可以区分出这三种活动性顺序; 所以能够区分出锌铁铜三种金属活动性的方案是①④,这与选项A相吻合. 故选A.
【分析】①锌的活动性比铁强,可以置换出铁,而铜不能; ②难以比较铁的活动性和铜、锌的活动性孰强孰弱; ③锌可以把铁和铜置换出来,但是不能比较铁和铜的活动性; ④铁不能置换出锌,但是可以置换出铜.本题考查学生对于金属活动性顺序的探究,我们可以把这类题目归结为“明知故问”型的题目,我们在解答该类题目时就是根据已经掌握的金属活动性顺序,然后选择合适的酸或者是盐的溶液来进行解答.
二、填空题
14.【答案】A;Ag等
【解析】【解答】在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,据此判断能否发生反应,进而可确定金属活动性强弱的顺序。 解:金属R放入稀硫酸中,没有气泡产生,说明R的金属活动性比氢弱,即H>R;R放入硫酸铜溶液中,表面有红色物质析出,说明R的金属活动性比铜强弱,即H>R>Cu。由此而可知,R>Zn,R>H不正确,故B、C不正确,选A。 D.在金属活动顺序表中位于铜后面的金属均符合要求,故填Ag等。 【分析】金属活动性应用,掌握金属活动性应用“反应则活泼、不反应则不活泼”是正确解答此类题的关键。
15.【答案】是
【解析】【解答】黄铜是铜和锌的合金,是金属材料。 【分析】该题考查了金属材料及其应用。
16.【答案】铁片表面有红色固体析出;置换;Cu+2AgNO3=2Ag+Cu(NO3)2;Fe (NO3)2;Ⅱ;过滤;Ⅰ或Ⅲ
【解析】【解答】①A中铁与硝酸铜反应生成硝酸亚铁和铜,所以铁片表面有红色固体析出,溶液由蓝色变为浅绿色;B 中铁与硝酸银反应生成硝酸亚铁和银,反应的基本类型是置换反应;②A中铁与硝酸铜反应生成硝酸亚铁和铜,证明金属活动性铁大于铜;B 中铁与硝酸银反应生成硝酸亚铁和银,证明金属活动性铁大于银;所以还需要比较铜、银的活动性,可以将铜片加入硝酸银溶液中,化学方程式为:Cu+2AgNO3 =2Ag+Cu(NO3)2;③由于金属活动性铁>铜>银,根据金属活动性,铁首先与硝酸银反应,硝酸银被完全置换后,铁开始与硝酸铜进行置换反应;所以反应后溶液的溶质可能为:Fe(NO3)2、Cu(NO3)2、AgNO3; Fe (NO3)2、Cu(NO3)2;Fe (NO3)2;其中猜想Ⅱ不合理,因为在置换完银之前,铁不会与硝酸铜反应;④操作Ⅰ将固体和液体分开,是过滤操作;根据方程式的质量关系,Fe+2AgNO3=2Ag+Fe(NO3)2;56份质量的铁恰好置换216份质量的银,根据数据分析,铁只与硝酸银反应,可能铁不足,也可能恰好与硝酸银反应,所以试管中溶液的溶质是Fe(NO3)2、Cu(NO3)2、AgNO3; Fe (NO3)2、Cu(NO3)2。【分析】根据金属活动性顺序的应用分析,在金属活动性顺序表中,排在氢前的金属能与酸发生反应,排在前面的金属能与排在后面的金属的盐溶液反应,根据反应是否发生也可证明金属的活动性的强弱。
三、解答题
17.【答案】解:设理论上需要四氧化三铁80%的磁铁矿的质量为y.
Fe3O4+4CO
3Fe+4CO2
232
168
80%x
583t×(1﹣4%)
x≈966.1t 答:需要含80%的四氧化三铁的磁铁矿石的质量为966.1t
【解析】【分析】由赤铁矿石中氧化铁的质量分数、生铁中质量及杂质的质量分数,根据赤铁矿炼铁的化学方程式可以列式计算出需要含80%的四氧化三铁的磁铁矿石的质量.
四、综合题
18.【答案】(1)真金延展性好,不易碎,真金密度大;“银”可能是锌,依据是:“银”的密度与锌的密度一致,且锌能与酸反应
(2)将“铜”在空气中反复灼烧,变黑后放入过量的稀硫酸中浸泡,重复以上操作直到表面红色金属全部消失,取出剩余的锌,再向溶液中加入过量的锌粉,过滤,再将滤渣加入过量稀硫酸,过滤,洗涤,干燥,称重即为铜的质量
【解析】【解答】解:(1)金的密度是19.3g/cm3 , 而所测金属的密度是4.9g/cm3 , 故是假金;据所测“银”的密度7.1g/cm3 , 加入稀盐酸,“银”有大量气泡产生这些信息和事实:锌的密度是7.1g/cm3 , 锌能与酸反应产生氢气可推测“银”可能是锌;
(2)将“铜”在空气中反复灼烧后会生成氧化铜,加入过量的稀硫酸,将氧化铜溶解,生成硫酸铜,再加入过量的锌粉过滤,此时的滤渣为铜和锌的混合物,再将滤渣加入过量稀硫酸,过滤,洗涤,干燥,称重,即得铜的质量.
故答案为:(1)真金延展性好,不易碎,真金密度大;“银”可能是锌,依据是:“银”的密度与锌的密度一致,且锌能与酸反应;
(2)将“铜”在空气中反复灼烧,变黑后放入过量的稀硫酸中浸泡,重复以上操作直到表面红色金属全部消失,取出剩余的锌,再向溶液中加入过量的锌粉,过滤,再将滤渣加入过量稀硫酸,过滤,洗涤,干燥,称重即为铜的质量.
【分析】(1)依据金的密度分析;根据金属锌的密度及化学性质分析;
(2)依据铜灼烧会产生氧化铜,氧化铜与稀硫酸反应产生硫酸铜,锌可以置换出硫酸铜中的铜.
19.【答案】(1)3CO+Fe2O3 2Fe+3CO2 (2)水;氧气 (3)置换反应 (4)②
【解析】【解答】(1)一氧化碳和赤铁矿炼铁的化学方程式:3CO+Fe2O3 2Fe+3CO2;(2) 铁在潮湿的空气中与水和氧气并存,容易生锈;(3)铝在高温条件下与氧化铁反应得到熔融的铁与另一种氧化物,此反应符合置换反应的特点;(4)在金属活动性顺序中,铁在铜的前面,能将铜从铜盐溶液中置换出来,①铁和铜都能与AgNO3溶液反应,无法确定铁和铜的活动性强弱,②铁能与CuSO4溶液反应,说明铁在铜的前面,③铁和铜都不与Al2(SO4)3溶液反应,无法证明铁和铜的活动性强弱。
【分析】根据铁生锈实际上是铁与氧气和水共同作用的结果分析;根据金属活动性顺序的应用分析,在金属活动性顺序表中,排在氢前的金属能与酸发生反应,排在前面的金属能与排在后面的金属的盐溶液反应,根据反应是否发生也可证明金属的活动性的强弱。
一、单选题
1.地壳中含量最多的元素是(?? )
A.?Al??????????????????????????????????????????B.?Fe??????????????????????????????????????????C.?Si??????????????????????????????????????????D.?O
2. 下列说法错误的是( )
A.?C可能是铜??????????????????????????????????????????????????????????B.?将Fe放在B的盐溶液中可以置换出B C.?四种金属的活动性顺序是:A>B>Fe>C???????????D.?钢和生铁都是铁合金
3.向AgNO3和Cu(NO3)2混合溶液中加入一定量的锌粉,充分反应后再加入稀盐酸无明显现象.下列说法正确的是(?? )
A.?锌粉全部反应?????????????????????????????????????????????????????B.?所得溶液中一定有Zn2+、Cu2+ C.?一定没有银粉生成??????????????????????????????????????????????D.?所得溶液中一定有Cu2+、Ag+
4.下列与金属有关的说法正确的是(???? )
A.?生铁和钢都是铁的合金???????????????????????????????????????B.?废旧电池可以随意丢弃,不会对环境造成污染 C.?银的导电性比铜强,所以一般用银线作电线????????D.?铁矿石在地壳中含量最丰富,可以随意开采
5.下列家庭日用品中不含金属材料的是?????????????????? (???? )
A.?瓷花瓶??????????????????????????????????B.?导线??????????????????????????????????C.?电视机??????????????????????????????????D.?电池
6.下列关于金属和合金的叙述中错误的是(?? )
A.?合金的硬度一般比各成分金属大?????????????????????????B.?生铁可以完全溶解在足量的稀盐酸中 C.?金属与金属、金属与非金属都可能形成合金????????D.?长期使用铁锅烹调可以摄入铁元素从而预防缺铁性贫血
7.如图所示,弹簧秤下挂一重物,重物浸没在AgNO3溶液中,稳定时弹簧秤的读数为F1。再向烧杯中加入适量的铜粉,充分搅拌并静置足够的时间后,溶液的体积未变,此时弹簧秤的读数为F2。已知重物与前、后溶液均不发生任何反应,对于F1和F2的相对大小,下列说法正确的是(? ?)
A.?无法判断??????????????????????????????B.?F2.<F1??????????????????????????????C.?F2>F1??????????????????????????????D.?F2=F1
8.下列反应属于置换反应的是 (??? )
A.?2CO + O2 2CO2?????????? ??????????????????????????????B.?CaCO3 CaO + CO2 C.?2Al + 6HCl=2AlCl3+3H2 ??????????????????????????????????D.?NaOH + HCl =NaCl + H2O?
9. 张超、夏烨和赵小天三位同学都是班里化学兴趣小组的成员,他们分别设计了3个不同的实验方案来验证锌、铁、铜三种金属的活动性,他们的方案如图所示:
以上方案合理的是(?? )
A.?方案一、方案二?????????B.?方案二、方案三?????????C.?方案一、方案三?????????D.?方案一、方案二、方案三
10. 新型防盗玻璃为多层结构,层与层之间连有极细的金属线,当玻璃被击碎时会有电信号,警报系统会立刻报警,这利用了金属的(? )
A.?导热性?????????????????????????????????B.?导电性?????????????????????????????????C.?弹性?????????????????????????????????D.?延展性
11.下列做法中有利于保护金属资源的是( )
A.?提高金属开采效率????????B.?用铝代替其他金属????????C.?回收废旧金属??????????D.?只开采储量丰富的金属
12.下列有关金属的说法错误的是( )
A.?常温下金属均为固态 B.?合金的很多性能与组成它们的纯金属不同 C.?铁在潮湿的空气中比在干燥的空气中更易生锈 D.?铝在空气中表面会生成致密的氧化铝薄膜,使铝具有很好的抗腐蚀性能
13.某学生为了验证铁、锌、铜三种金属的活动性顺序,设计了四种方案:①将Zn、Cu分别加入到FeSO4溶液中,②将Zn、Cu分别加入到ZnSO4溶液中,③将Zn分别加入到FeSO4、CuSO4溶液中,④将Fe 分别加入到ZnSO4、CuSO4溶液中。其中正确的方案是( )
A.?①或④????????????????????????????????B.?①或②????????????????????????????????C.?②或③????????????????????????????????D.?③或④
二、填空题
14.金属R放入稀硫酸中,没有气泡产生,放入硫酸铜溶液中,表面有红色物质析出.下列关于R的金属活动性判断正确的是(________) ?A.R>Cu?? B.R>H??? C. R>Zn??? D.R>________
15.将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭粉混合后加热到约800℃,得到一种锌和铜的合金——黄铜,外观似黄金但质地坚硬。(提示:ZnCO3?? ?ZnO + CO2↑)黄铜是金属材料吗?________(填“是”或“不是”)。
16.某同学为了探究相关金属的性质,做了下列实验: ① A 中现象________;B 中反应的基本类型是________反应。 ② 通过 A 和 B 实验不能证明铁、铜、银三种金属的活动性强弱,需补充一个实验达到 实验目的,写出该反应的化学方程式为________。 ③ 实验 C 中物质充分反应后,猜想试管中溶液的溶质是 Ⅰ. Fe(NO3)2、Cu(NO3)2、AgNO3? Ⅱ. Fe (NO3)2、AgNO3? Ⅲ.Fe (NO3)2、Cu(NO3)2 Ⅳ.________。 其中只有一个不合理的猜想是________。(填编号) ④ 进行定量实验可确定猜想。 操作Ⅰ是________。根据数据分析,③中猜想________成立(填编号)。
三、解答题
17.理论上要炼出含碳4%的生铁583t,需要含四氧化三铁80%的磁铁矿石多少吨?(计算结果保留整数).
四、综合题
18. 在学习金属的性质时,老师拿来了三种外观酷似金、银、铜的样品,同学们对样品进行以下探究:
①用锤子砸“金”,样品粉碎;
②加入稀盐酸:“金”和“铜”没有现象,“银”有大量气泡产生;
③测定密度:“金”4.9g/cm3 , “银”7.1g/cm3 , “铜”7.5g/cm3 .
④查阅几种常见金属的密度,如下表:
金属
金
银
铜
铁
锌
? 密度(g/cm3)
?19.3
10.5
8.9
7.9
7.1
(1)根据以上探究,确定“金”是假的理由有哪些?推测“银”可能是什么金属,依据是什么?
(2)已知“铜”只有表面镀了一薄层致密的铜,内部是锌.若不粉碎“铜”,选用稀硫酸和锌粉,测定一定质量“铜”样品中铜的质量,设计实验方案.
19.据最新消息,鲁南高铁临沂段将于2019年底建成开通,不久的将来我们就可以坐上高铁出行了。结合所学的化学知识,回答下列有关问题:
(1)修建高铁所需大量钢铁是以铁矿石为主要原料冶炼而得,写出用一氧化碳和赤铁矿炼铁的化学方程式________;
(2)雨后的铁轨表面易产生少量的锈迹,实际上是铁与空气中的________、________等发生了化学反应;
(3)高铁钢轨采用无缝焊接,其反应原理是铝在高温条件下与氧化铁反应得到熔融的铁与另一种氧化物,该反应基本类型是________;
(4)在实验室中探究铁、铜的金属活动性顺序,除铁、铜外,还需要一种试剂,你选择的试剂是________(填序号)。①AgNO3溶液??? ②CuSO4溶液??? ③Al2(SO4)3溶液
答案解析部分
一、单选题
1.【答案】 D
【解析】【解答】地壳中元素的含量由多到少的顺序是:氧、硅、铝、铁、钙…….; 故答案为:D
【分析】根据地壳中含量最多的元素的氧元素解答
2.【答案】 B
【解析】【解答】A、由图示可知,C不与稀盐酸反应,C的位置排在氢的后面,可能是铜,故选项说法正确;
B、图中B物质与稀盐酸反应比铁更剧烈,说明了金属活动性B>铁;将Fe放在B的盐溶液中,不能发生置换反应,不能置换出B,故选项说法错误;
C、由图中金属与酸反应的剧烈程度,A反应最剧烈,B其次,C再次,C不与稀盐酸反应,则四种金属的活动性顺序是:A>B>Fe>C,故选项说法正确;
D、钢和生铁都是铁的合金,生铁是含碳量为2%~4.3%的铁合金,钢是含碳量为0.03%~2%的铁合金,故选项说法正确;
故选:B.
【分析】A、根据图示可知,C不与稀盐酸反应,据此进行分析判断;
B、根据图中B物质与稀盐酸反应比铁更剧烈,进行分析判断;
C、由图中金属与酸反应的剧烈程度,进行分析判断;
D、根据常见的铁合金的种类,进行分析判断.
3.【答案】A
【解析】【解答】解:由题意可知,向AgNO3和Cu(NO3)2混合溶液中加入一定量的锌粉,发生的反应有锌可置换硝酸银中的银、锌可置换硝酸铜中的铜,生成的铜还可以置换硝酸银中的银.充分反应后再加入稀盐酸无明显现象,说明了溶液中锌没有剩余,铜不能确定.由此可知:
A、锌全部参加了反应,没有剩余,故A正确;
B、所得溶液中一定有Zn2+ , Cu2+不能确定,故B错误;
C、溶液中一定有银粉生成,故C错误;
D、所得溶液中Ag+ , Cu2+不能确定,故D错误.
故答案为:A
【分析】根据金属活动性由强到弱的关系(Zn>Cu>Ag),锌可置换硝酸银中的银、锌可置换硝酸铜中的铜,生成的铜还可以置换硝酸银中的银.充分反应后再加入稀盐酸无明显现象,说明锌全部参加了反应,根据以上反应及现象,分析反应的发生情况,推断所得固体及溶液中的离子.
4.【答案】 A
【解析】【解答】生铁和钢都是铁和碳的合金,故A项正确;废旧电池中含有会污染环境的重金属,故B项错误;银的导电性虽然强但由于价格昂贵一般不用银做电线,故C项错误;为保护铁资源,应合理开采铁矿石,故D项错误。
【分析】该题考查了金属材料及其应用
5.【答案】 A
【解析】【解答】A.瓷花瓶由陶瓷制成,属于无机非金属材料,A错误
B.导线中含有金属,B正确
C.电视机中含有金属材料,C正确
D.电池中含有金属材料,D正确
【分析】根据已有知识分析瓷花瓶由陶瓷制成,属于无机非金属材料,导线中含有金属,电视机中含有金属材料,电池中含有金属材料
6.【答案】 B
【解析】【解答】A、合金的硬度一般比各组成成分的金属大,A不符合题意;
B、生铁不能完全溶解在足量的稀盐酸中,因为生铁中的碳不能和稀盐酸反应,也不溶于水,B符合题意;
C、金属与金属、金属与非金属都可能形成合金,C不符合题意;
D、长期使用铁锅烹调可以摄入铁元素从而预防缺铁性贫血,D不符合题意.
故答案为:B. 【分析】一种金属和其它物质熔合而成的具有金属特性的物质是合金;生铁的主要成分是铁,还含有碳等物质;人体缺乏铁元素时,易患缺铁性贫血.
7.【答案】 C
【解析】【解答】根据“弹簧称下挂一重物,重物浸没在AgNO3溶液中,稳定时弹簧称读数F1 . 再向烧杯中加入适量的铜粉,充分搅拌并配制足够的时间后,溶液体积未变,此时弹簧秤的读数为F2”,可知铜与硝酸银反应生成硝酸铜和银,反应的化学方程式为:
Cu+2AgNO2═Cu(NO3)2+
2Ag
64
216
则可推测溶液质量减小,溶液体积不变而质量减小,则溶液密度减小,溶液密度的减小使重物所受浮力减小,浮力的减小而使弹簧秤的读数增大,C符合题意。 故答案为:C。 【分析】本题主要考查金属的活泼性,活泼金属能够置换出不活泼金属。
8.【答案】 C
【解析】【解答】A.反应物两种,生成物一种,为化合反应,不符合题意; B.反应物一种,生成物两种,为分解反应,不符合题意; C.反应物和生成物都是一种单质和一种化合物,为置换反应,符合题意; D.反应物和生成物都是化合物,为复分解反应,不符合题意; 故答案为:C。
【分析】根据置换反应定义进行分析,置换反应要求反应物和生成物中都是一种单质和一种化合物。
9.【答案】C
【解析】【解答】解:方案一:铁能与硫酸铜溶液反应,说明铁在铜的前面,铁不能与硫酸锌溶液反应,说明铁在锌的后面,能证明锌>铁>铜,故方案一可行;
方案二:铁、铜与硫酸锌溶液都不反应,说明铜、铁在锌的后面,但是不能说明铁和铜的顺序,故方案二不可行;
方案三、铁片和锌粒都能与稀硫酸反应生成氢气,且锌与盐酸的反应速率大于铁与盐酸反应的速率,说明锌在铁的前面,且都在氢前,铜不与盐酸反应,说明铜在氢后,能证明锌>铁>铜,故方案三可行.
综合以上分析可知,C正确.
故选C.
【分析】在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,氢前的金属能与酸反应生成氢气.
10.【答案】 B
【解析】【解答】解:A、当玻璃被击碎时,与金属线相连的警报系统就会立刻报警,是利用了金属的导电性,与金属的导热性无关,故选项错误.
B、当玻璃被击碎时,与金属线相连的警报系统就会立刻报警,与导电性有关,是利用了金属的导电性,故选项正确.
C、当玻璃当玻璃被击碎时,与金属线相连的警报系统就会立刻报警,是利用了金属的导电性,与金属的弹性无关,故选项错误.
D、当玻璃当玻璃被击碎时,与金属线相连的警报系统就会立刻报警,是利用了金属的导电性,与金属的延展性无关,故选项错误.
故选B.
【分析】金属具有良好的导电性、导热性和延展性等,根据题干信息,当玻璃被击碎时会有电信号,警报系统会立刻报警,是利用了金属的导电性.
11.【答案】 C
【解析】【解答】A、要合理有序的开采金属矿产资源,而不能大量开采金属资源,因为金属资源属于不可再生能源,故A错误;
B、铝也属于金属资源,所以用铝代替其他金属不利于保护金属资源,故B错误;
C、回收废旧金属,可以节约金属资源,利于保护金属资源,故C正确;
D、只开采储量丰富的金属会造成金属资源的浪费,不利于保护金属资源,故D错误;
故选:C.
【分析】A、根据要合理有序的开采金属矿产资源进行解答;
B、根据铝也属于金属资源进行解答;
C、根据回收废旧金属,可以节约金属资源进行解答;
D、根据只开采储量丰富的金属会造成金属资源的浪费进行解答.
12.【答案】 A
【解析】【分析】A、在常温下下汞是液体; B、合金是具有金属特性的物质; C、铁在与氧气和水充分接触时容易生锈; D、铝具有自我保护作用,铝表面易形成致密的氧化膜
【解答】A、金属具有金属光泽,常温下大部分金属都是固体,但常温下汞是液体.故选项正确; B、合金是具有金属特性的物质;性能与组成它的金属的性能有差别;故选项错误; C、铁生锈的条件是铁同时与水和空气接触,所以铁在潮湿的空气中比在干燥的空气中更易生锈;故选项错误; D、铝具有自我保护作用,铝表面易形成致密的氧化膜可阻止铝进一步被氧化,故选项错误 故选A
【点评】解答本题要掌握各种物质的性质方面的知识,只有这样才能对相关方面的问题做出正确的判断.
13.【答案】 A
【解析】【解答】 ①锌的活动性比铁强,可以置换出铁,而铜不能置换出铁,所以可以区分出活动性强弱;
②难以比较铁的活动性和铜、锌的活动性孰强孰弱,所以该方案不可行; ③锌可以把铁和铜置换出来,但是不能比较铁和铜的活动性,所以该方案不可行; ④铁不能置换出锌,但是可以置换出铜,所以可以区分出这三种活动性顺序; 所以能够区分出锌铁铜三种金属活动性的方案是①④,这与选项A相吻合. 故选A.
【分析】①锌的活动性比铁强,可以置换出铁,而铜不能; ②难以比较铁的活动性和铜、锌的活动性孰强孰弱; ③锌可以把铁和铜置换出来,但是不能比较铁和铜的活动性; ④铁不能置换出锌,但是可以置换出铜.本题考查学生对于金属活动性顺序的探究,我们可以把这类题目归结为“明知故问”型的题目,我们在解答该类题目时就是根据已经掌握的金属活动性顺序,然后选择合适的酸或者是盐的溶液来进行解答.
二、填空题
14.【答案】A;Ag等
【解析】【解答】在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,据此判断能否发生反应,进而可确定金属活动性强弱的顺序。 解:金属R放入稀硫酸中,没有气泡产生,说明R的金属活动性比氢弱,即H>R;R放入硫酸铜溶液中,表面有红色物质析出,说明R的金属活动性比铜强弱,即H>R>Cu。由此而可知,R>Zn,R>H不正确,故B、C不正确,选A。 D.在金属活动顺序表中位于铜后面的金属均符合要求,故填Ag等。 【分析】金属活动性应用,掌握金属活动性应用“反应则活泼、不反应则不活泼”是正确解答此类题的关键。
15.【答案】是
【解析】【解答】黄铜是铜和锌的合金,是金属材料。 【分析】该题考查了金属材料及其应用。
16.【答案】铁片表面有红色固体析出;置换;Cu+2AgNO3=2Ag+Cu(NO3)2;Fe (NO3)2;Ⅱ;过滤;Ⅰ或Ⅲ
【解析】【解答】①A中铁与硝酸铜反应生成硝酸亚铁和铜,所以铁片表面有红色固体析出,溶液由蓝色变为浅绿色;B 中铁与硝酸银反应生成硝酸亚铁和银,反应的基本类型是置换反应;②A中铁与硝酸铜反应生成硝酸亚铁和铜,证明金属活动性铁大于铜;B 中铁与硝酸银反应生成硝酸亚铁和银,证明金属活动性铁大于银;所以还需要比较铜、银的活动性,可以将铜片加入硝酸银溶液中,化学方程式为:Cu+2AgNO3 =2Ag+Cu(NO3)2;③由于金属活动性铁>铜>银,根据金属活动性,铁首先与硝酸银反应,硝酸银被完全置换后,铁开始与硝酸铜进行置换反应;所以反应后溶液的溶质可能为:Fe(NO3)2、Cu(NO3)2、AgNO3; Fe (NO3)2、Cu(NO3)2;Fe (NO3)2;其中猜想Ⅱ不合理,因为在置换完银之前,铁不会与硝酸铜反应;④操作Ⅰ将固体和液体分开,是过滤操作;根据方程式的质量关系,Fe+2AgNO3=2Ag+Fe(NO3)2;56份质量的铁恰好置换216份质量的银,根据数据分析,铁只与硝酸银反应,可能铁不足,也可能恰好与硝酸银反应,所以试管中溶液的溶质是Fe(NO3)2、Cu(NO3)2、AgNO3; Fe (NO3)2、Cu(NO3)2。【分析】根据金属活动性顺序的应用分析,在金属活动性顺序表中,排在氢前的金属能与酸发生反应,排在前面的金属能与排在后面的金属的盐溶液反应,根据反应是否发生也可证明金属的活动性的强弱。
三、解答题
17.【答案】解:设理论上需要四氧化三铁80%的磁铁矿的质量为y.
Fe3O4+4CO
3Fe+4CO2
232
168
80%x
583t×(1﹣4%)
x≈966.1t 答:需要含80%的四氧化三铁的磁铁矿石的质量为966.1t
【解析】【分析】由赤铁矿石中氧化铁的质量分数、生铁中质量及杂质的质量分数,根据赤铁矿炼铁的化学方程式可以列式计算出需要含80%的四氧化三铁的磁铁矿石的质量.
四、综合题
18.【答案】(1)真金延展性好,不易碎,真金密度大;“银”可能是锌,依据是:“银”的密度与锌的密度一致,且锌能与酸反应
(2)将“铜”在空气中反复灼烧,变黑后放入过量的稀硫酸中浸泡,重复以上操作直到表面红色金属全部消失,取出剩余的锌,再向溶液中加入过量的锌粉,过滤,再将滤渣加入过量稀硫酸,过滤,洗涤,干燥,称重即为铜的质量
【解析】【解答】解:(1)金的密度是19.3g/cm3 , 而所测金属的密度是4.9g/cm3 , 故是假金;据所测“银”的密度7.1g/cm3 , 加入稀盐酸,“银”有大量气泡产生这些信息和事实:锌的密度是7.1g/cm3 , 锌能与酸反应产生氢气可推测“银”可能是锌;
(2)将“铜”在空气中反复灼烧后会生成氧化铜,加入过量的稀硫酸,将氧化铜溶解,生成硫酸铜,再加入过量的锌粉过滤,此时的滤渣为铜和锌的混合物,再将滤渣加入过量稀硫酸,过滤,洗涤,干燥,称重,即得铜的质量.
故答案为:(1)真金延展性好,不易碎,真金密度大;“银”可能是锌,依据是:“银”的密度与锌的密度一致,且锌能与酸反应;
(2)将“铜”在空气中反复灼烧,变黑后放入过量的稀硫酸中浸泡,重复以上操作直到表面红色金属全部消失,取出剩余的锌,再向溶液中加入过量的锌粉,过滤,再将滤渣加入过量稀硫酸,过滤,洗涤,干燥,称重即为铜的质量.
【分析】(1)依据金的密度分析;根据金属锌的密度及化学性质分析;
(2)依据铜灼烧会产生氧化铜,氧化铜与稀硫酸反应产生硫酸铜,锌可以置换出硫酸铜中的铜.
19.【答案】(1)3CO+Fe2O3 2Fe+3CO2 (2)水;氧气 (3)置换反应 (4)②
【解析】【解答】(1)一氧化碳和赤铁矿炼铁的化学方程式:3CO+Fe2O3 2Fe+3CO2;(2) 铁在潮湿的空气中与水和氧气并存,容易生锈;(3)铝在高温条件下与氧化铁反应得到熔融的铁与另一种氧化物,此反应符合置换反应的特点;(4)在金属活动性顺序中,铁在铜的前面,能将铜从铜盐溶液中置换出来,①铁和铜都能与AgNO3溶液反应,无法确定铁和铜的活动性强弱,②铁能与CuSO4溶液反应,说明铁在铜的前面,③铁和铜都不与Al2(SO4)3溶液反应,无法证明铁和铜的活动性强弱。
【分析】根据铁生锈实际上是铁与氧气和水共同作用的结果分析;根据金属活动性顺序的应用分析,在金属活动性顺序表中,排在氢前的金属能与酸发生反应,排在前面的金属能与排在后面的金属的盐溶液反应,根据反应是否发生也可证明金属的活动性的强弱。
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
