人教版(五四制)九年级化学 2.4 实验活动2 一定溶质质量分数的氯化钠溶液的配制 课件(21张PPT)
文档属性
| 名称 | 人教版(五四制)九年级化学 2.4 实验活动2 一定溶质质量分数的氯化钠溶液的配制 课件(21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 6.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-28 06:58:19 | ||
图片预览








文档简介
课件21张PPT。实验活动5 一定溶质质量分数的氯化钠溶液的配制
在生产生活中,人们是如何配制农药的呢?新课导入【实验目的】
1.练习配制一定溶质质量分数的溶液。
2.加深对溶质的质量分数概念的理解。新课推进【仪器】托盘天平、药匙、量筒、玻璃棒、烧杯、胶头滴管。活动与探究【实验步骤】
1.配制质量分数为6%的氯化钠溶液。
2.计算:
(1)配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:氯化钠____g,水____g。
(2)称量:用托盘天平称量所需的氯化钠,放入烧杯中。
(3)量取:用量筒量取所需的水(水的密度可近似看做1g/cm3)倒入盛有氯化钠的烧杯中。
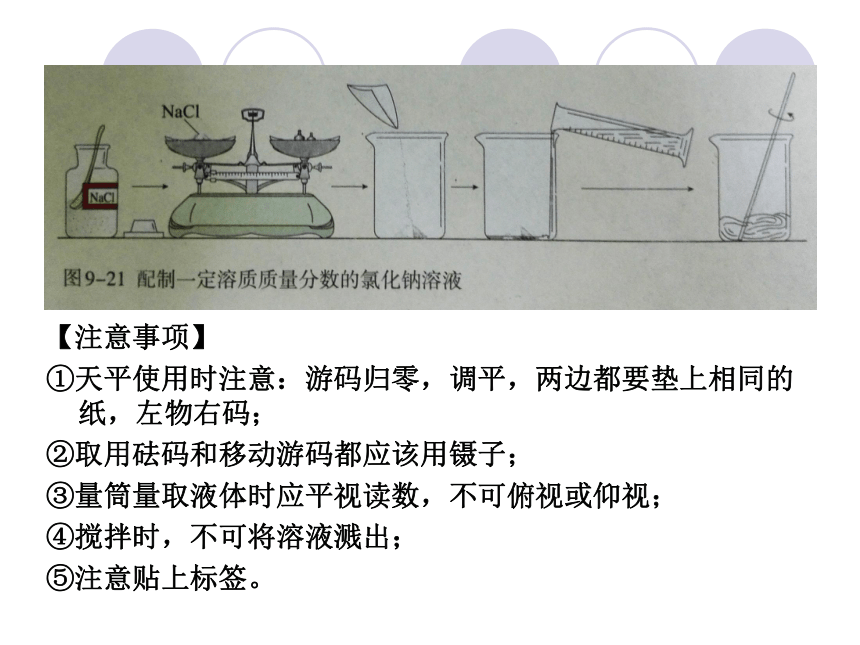
(4)溶解用玻璃杯搅拌,使氯化钠溶解。347【注意事项】
①天平使用时注意:游码归零,调平,两边都要垫上相同的纸,左物右码;
②取用砝码和移动游码都应该用镊子;
③量筒量取液体时应平视读数,不可俯视或仰视;
④搅拌时,不可将溶液溅出;
⑤注意贴上标签。请同学们讨论分析:有哪些因素造成配制溶液的质量分数偏低或偏高?提出问题1.所配的溶液中溶质的质量分数偏大的因素:
①溶质的质量偏大:
称取固体溶质质量时偏大;
量取浓溶液时仰视读数。归纳总结②溶剂的质量偏小:
用量筒取水时俯视液面读数;
量好的水向烧杯中倾倒时有些洒落。2.所配的溶液中溶质的质量分数偏小的因素:
①溶质的质量偏小:
称量固体溶质的质量时偏小;
所用的固体不纯或不干燥等;
称量时“左码右物”并使用了游码;
量取浓溶液时俯视读数。②溶剂的质量偏大:
量取水时仰视读数;
烧杯内有残留的水。3.装瓶时将溶液洒落不影响溶液中溶质的质量分数,因为只是溶液质量减少,溶液中的溶质和溶剂同时减少,比值不变。上面我们学习了配制一定溶质质量分数的溶液的步骤和方法。现在,我们学习如何将浓溶液配制成稀溶液。
2.“配制质量分数为3%的氯化钠溶液”
用已配好的质量分数为6%的氯化钠溶液(密度约为1.04g/cm3),配制50g质量分数为3%的氯化钠溶液。
(1)计算:配制50g质量分数为3%的氯化钠溶液所需质量分数为6%的氯化钠溶液和水的质量分别为:6%的氯化钠溶液____g(体积____mL);水____g。
(2)量取:用量筒量取所需的氯化钠溶液和水,倒入烧杯中。
(3)把配置好的上述两种氯化钠溶液分别装入试剂瓶中,盖好瓶塞并贴上标签(标签应包括药品名称和溶液中溶质的质量分数),放到试剂柜中。252425请同学们讨论分析:由浓溶液配制稀溶液时计算的依据是什么?提出问题计算的依据是:溶液稀释前后,溶液中溶质的质量不变。交流回答例1 小红在实验室欲配制一定质量分数的食盐溶液。
(1)B仪器的名称是______,上面的仪器中除B、E外,她必须选用的仪器还有_______(填字母编号);
(2)E的作用是_______,配制的步骤可以概括为计算、称量和量取、_______、装瓶。基本题型一 仪器选用、操作步骤课堂演练解析 (1)图中B的名称是烧杯;配制步骤为计算、称量、量取、溶解。称量时用到天平、药匙,量取时用到量筒,溶解时用到烧杯、玻璃棒,所以用到的仪器有天平、药匙、量筒、烧杯、玻璃棒,所以她必须选用的仪器还有D、G。(2)玻璃棒在溶液的配置中的作用是搅拌;配制的步骤有:计算、称量、量取、溶解、装瓶。例1 小红在实验室欲配制一定质量分数的食盐溶液。
(1)B仪器的名称是______,上面的仪器中除B、E外,她必须选用的仪器还有_______(填字母编号);
(2)E的作用是_______,配制的步骤可以概括为计算、称量和量取、_______、装瓶。基本题型一 仪器选用、操作步骤课堂演练烧杯D、G搅拌溶解例2 小刚同学用固体氯化钠配制50g质量分数为10%的氯化钠溶液。他利用实验室提供的下列仪器进行实验:
①托盘天平 ②量筒 ③烧杯 ④玻璃棒 ⑤酒精灯 ⑥药匙 ⑦胶头滴管等仪器
(1)他在称量氯化钠过程中发现指针向右偏转,下一步操作是__________________。
(2)上述仪器中,不需要的仪器是______,溶解步骤中要用到的仪器是_______(均填写序号)。
(3)配制过程中,引起溶质质量分数减小的因素_______。
①称量前指针偏左时就开始称量 ②用量筒量水时仰视读数
③用量筒量水时俯视读数 ④装瓶时有部分溶液洒落瓶外基本题型二 操作要领、误差分析解析 (1)在称量氯化钠过程中发现指针向右偏转,根据天平的使用“左物右码”规则,说明左侧氯化钠质量不足,应继续在左盘增加氯化钠。(2)配制溶液过程中不需要加热,因此⑤酒精灯是配制该氯化钠溶液时不需要的仪器;溶解需要放在③烧杯内进行,为加快溶解还需要使用④玻璃棒不断搅拌。(3)①称量前指针偏左时就开始称量,会使所称量的氯化钠质量偏小,导致溶质质量分数减小;②用量筒量水时仰视读数,读数小于实际体积,使配制实际用水量大于所需水量,会导致溶质质量分数减小;③用量筒量水时俯视读数,读数大于实际体积,使配制实际用水量小于所需水量,会导致溶质质量分数增大;④装瓶时有部分溶液洒落瓶外,溶液已经形成,溶液的溶质质量分数不会再改变,不会导致溶质质量分数减小。例2 小刚同学用固体氯化钠配制50g质量分数为10%的氯化钠溶液。他利用实验室提供的下列仪器进行实验:
①托盘天平 ②量筒 ③烧杯 ④玻璃棒 ⑤酒精灯 ⑥药匙 ⑦胶头滴管等仪器
(1)他在称量氯化钠过程中发现指针向右偏转,下一步操作是__________________。
(2)上述仪器中,不需要的仪器是______,溶解步骤中要用到的仪器是_______(均填写序号)。
(3)配制过程中,引起溶质质量分数减小的因素_______。
①称量前指针偏左时就开始称量 ②用量筒量水时仰视读数
③用量筒量水时俯视读数 ④装瓶时有部分溶液洒落瓶外基本题型二 操作要领、误差分析在左盘中增加食盐⑤③④①②本节课我们练习了配制一定溶质质量分数的溶液及怎样将浓溶液稀释成稀溶液,了解了配制溶液的步骤及所需仪器,进一步加深了对溶质质量分数的认识。新课小结实验活动5 一定溶质质量分数的氯化钠溶液的配制
一、配制一定质量分数的溶液
【仪器】托盘天平、药匙、量筒、玻璃棒、烧杯、胶头滴管。
【步骤】①计算;②称量;③量取;④溶解;⑤装瓶贴标签。
二、浓溶液的稀释
计算依据:稀释前后溶液中溶质的质量不变。板书设计
在生产生活中,人们是如何配制农药的呢?新课导入【实验目的】
1.练习配制一定溶质质量分数的溶液。
2.加深对溶质的质量分数概念的理解。新课推进【仪器】托盘天平、药匙、量筒、玻璃棒、烧杯、胶头滴管。活动与探究【实验步骤】
1.配制质量分数为6%的氯化钠溶液。
2.计算:
(1)配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:氯化钠____g,水____g。
(2)称量:用托盘天平称量所需的氯化钠,放入烧杯中。
(3)量取:用量筒量取所需的水(水的密度可近似看做1g/cm3)倒入盛有氯化钠的烧杯中。
(4)溶解用玻璃杯搅拌,使氯化钠溶解。347【注意事项】
①天平使用时注意:游码归零,调平,两边都要垫上相同的纸,左物右码;
②取用砝码和移动游码都应该用镊子;
③量筒量取液体时应平视读数,不可俯视或仰视;
④搅拌时,不可将溶液溅出;
⑤注意贴上标签。请同学们讨论分析:有哪些因素造成配制溶液的质量分数偏低或偏高?提出问题1.所配的溶液中溶质的质量分数偏大的因素:
①溶质的质量偏大:
称取固体溶质质量时偏大;
量取浓溶液时仰视读数。归纳总结②溶剂的质量偏小:
用量筒取水时俯视液面读数;
量好的水向烧杯中倾倒时有些洒落。2.所配的溶液中溶质的质量分数偏小的因素:
①溶质的质量偏小:
称量固体溶质的质量时偏小;
所用的固体不纯或不干燥等;
称量时“左码右物”并使用了游码;
量取浓溶液时俯视读数。②溶剂的质量偏大:
量取水时仰视读数;
烧杯内有残留的水。3.装瓶时将溶液洒落不影响溶液中溶质的质量分数,因为只是溶液质量减少,溶液中的溶质和溶剂同时减少,比值不变。上面我们学习了配制一定溶质质量分数的溶液的步骤和方法。现在,我们学习如何将浓溶液配制成稀溶液。
2.“配制质量分数为3%的氯化钠溶液”
用已配好的质量分数为6%的氯化钠溶液(密度约为1.04g/cm3),配制50g质量分数为3%的氯化钠溶液。
(1)计算:配制50g质量分数为3%的氯化钠溶液所需质量分数为6%的氯化钠溶液和水的质量分别为:6%的氯化钠溶液____g(体积____mL);水____g。
(2)量取:用量筒量取所需的氯化钠溶液和水,倒入烧杯中。
(3)把配置好的上述两种氯化钠溶液分别装入试剂瓶中,盖好瓶塞并贴上标签(标签应包括药品名称和溶液中溶质的质量分数),放到试剂柜中。252425请同学们讨论分析:由浓溶液配制稀溶液时计算的依据是什么?提出问题计算的依据是:溶液稀释前后,溶液中溶质的质量不变。交流回答例1 小红在实验室欲配制一定质量分数的食盐溶液。
(1)B仪器的名称是______,上面的仪器中除B、E外,她必须选用的仪器还有_______(填字母编号);
(2)E的作用是_______,配制的步骤可以概括为计算、称量和量取、_______、装瓶。基本题型一 仪器选用、操作步骤课堂演练解析 (1)图中B的名称是烧杯;配制步骤为计算、称量、量取、溶解。称量时用到天平、药匙,量取时用到量筒,溶解时用到烧杯、玻璃棒,所以用到的仪器有天平、药匙、量筒、烧杯、玻璃棒,所以她必须选用的仪器还有D、G。(2)玻璃棒在溶液的配置中的作用是搅拌;配制的步骤有:计算、称量、量取、溶解、装瓶。例1 小红在实验室欲配制一定质量分数的食盐溶液。
(1)B仪器的名称是______,上面的仪器中除B、E外,她必须选用的仪器还有_______(填字母编号);
(2)E的作用是_______,配制的步骤可以概括为计算、称量和量取、_______、装瓶。基本题型一 仪器选用、操作步骤课堂演练烧杯D、G搅拌溶解例2 小刚同学用固体氯化钠配制50g质量分数为10%的氯化钠溶液。他利用实验室提供的下列仪器进行实验:
①托盘天平 ②量筒 ③烧杯 ④玻璃棒 ⑤酒精灯 ⑥药匙 ⑦胶头滴管等仪器
(1)他在称量氯化钠过程中发现指针向右偏转,下一步操作是__________________。
(2)上述仪器中,不需要的仪器是______,溶解步骤中要用到的仪器是_______(均填写序号)。
(3)配制过程中,引起溶质质量分数减小的因素_______。
①称量前指针偏左时就开始称量 ②用量筒量水时仰视读数
③用量筒量水时俯视读数 ④装瓶时有部分溶液洒落瓶外基本题型二 操作要领、误差分析解析 (1)在称量氯化钠过程中发现指针向右偏转,根据天平的使用“左物右码”规则,说明左侧氯化钠质量不足,应继续在左盘增加氯化钠。(2)配制溶液过程中不需要加热,因此⑤酒精灯是配制该氯化钠溶液时不需要的仪器;溶解需要放在③烧杯内进行,为加快溶解还需要使用④玻璃棒不断搅拌。(3)①称量前指针偏左时就开始称量,会使所称量的氯化钠质量偏小,导致溶质质量分数减小;②用量筒量水时仰视读数,读数小于实际体积,使配制实际用水量大于所需水量,会导致溶质质量分数减小;③用量筒量水时俯视读数,读数大于实际体积,使配制实际用水量小于所需水量,会导致溶质质量分数增大;④装瓶时有部分溶液洒落瓶外,溶液已经形成,溶液的溶质质量分数不会再改变,不会导致溶质质量分数减小。例2 小刚同学用固体氯化钠配制50g质量分数为10%的氯化钠溶液。他利用实验室提供的下列仪器进行实验:
①托盘天平 ②量筒 ③烧杯 ④玻璃棒 ⑤酒精灯 ⑥药匙 ⑦胶头滴管等仪器
(1)他在称量氯化钠过程中发现指针向右偏转,下一步操作是__________________。
(2)上述仪器中,不需要的仪器是______,溶解步骤中要用到的仪器是_______(均填写序号)。
(3)配制过程中,引起溶质质量分数减小的因素_______。
①称量前指针偏左时就开始称量 ②用量筒量水时仰视读数
③用量筒量水时俯视读数 ④装瓶时有部分溶液洒落瓶外基本题型二 操作要领、误差分析在左盘中增加食盐⑤③④①②本节课我们练习了配制一定溶质质量分数的溶液及怎样将浓溶液稀释成稀溶液,了解了配制溶液的步骤及所需仪器,进一步加深了对溶质质量分数的认识。新课小结实验活动5 一定溶质质量分数的氯化钠溶液的配制
一、配制一定质量分数的溶液
【仪器】托盘天平、药匙、量筒、玻璃棒、烧杯、胶头滴管。
【步骤】①计算;②称量;③量取;④溶解;⑤装瓶贴标签。
二、浓溶液的稀释
计算依据:稀释前后溶液中溶质的质量不变。板书设计
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
