人教版(五四制)九年级化学 2.5 单元复习 课件(21张PPT)
文档属性
| 名称 | 人教版(五四制)九年级化学 2.5 单元复习 课件(21张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 535.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-28 00:00:00 | ||
图片预览





文档简介
课件21张PPT。考点一:溶液
1.定义:一种或几种物质分散到另一种物质里,形成均一、稳定的混合物。2.特征:均一性、稳定性 3.组成: 溶液 溶质:溶剂:被溶解的物质。能溶解其他物质的物质。(≥1种)(1种)4.溶液、溶质与溶剂之间的量的关系:溶液质量= 溶质质量+溶剂质量 (一般)溶液体积<溶质体积+溶剂体积 5.水是常用的溶剂,还有哪些物质也是常用的溶剂?酒精、汽油等是常用的溶剂。 6.溶液的名称: 某溶质的某溶剂溶液,在不指明溶剂的情况下,溶剂一般为水,如氯化钠溶液。7.溶液的颜色:有些物质溶解后,会使溶液呈现一定的颜色,如:
CuSO4溶液是蓝色的;
FeCl3溶液是黄色的;
FeSO4溶液是浅绿色的;
KMnO4溶液是紫红色的;
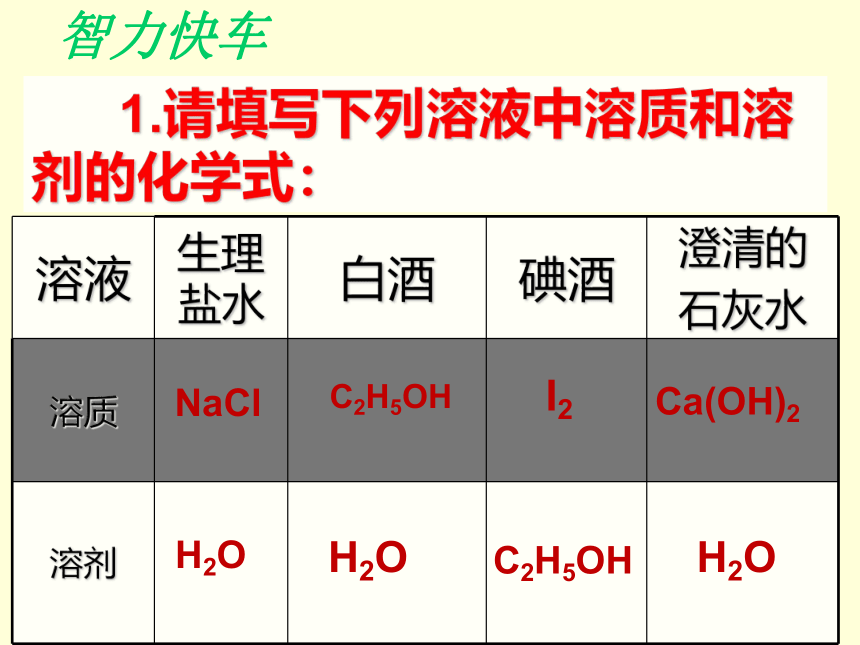
NaCl溶液等大多溶液则呈无色。Ca(OH)2H2OC2H5OHH2OI2C2H5OHH2ONaCl 1.请填写下列溶液中溶质和溶剂的化学式:智力快车2. 将家庭中常用的四种调味品分别放
入水中,不能形成溶液的是( )
A.醋 B.蔗糖
C.花生油 D.食盐
3. 配制溶液时,下列溶剂中最常用
的是( )
A.酒精 B.水
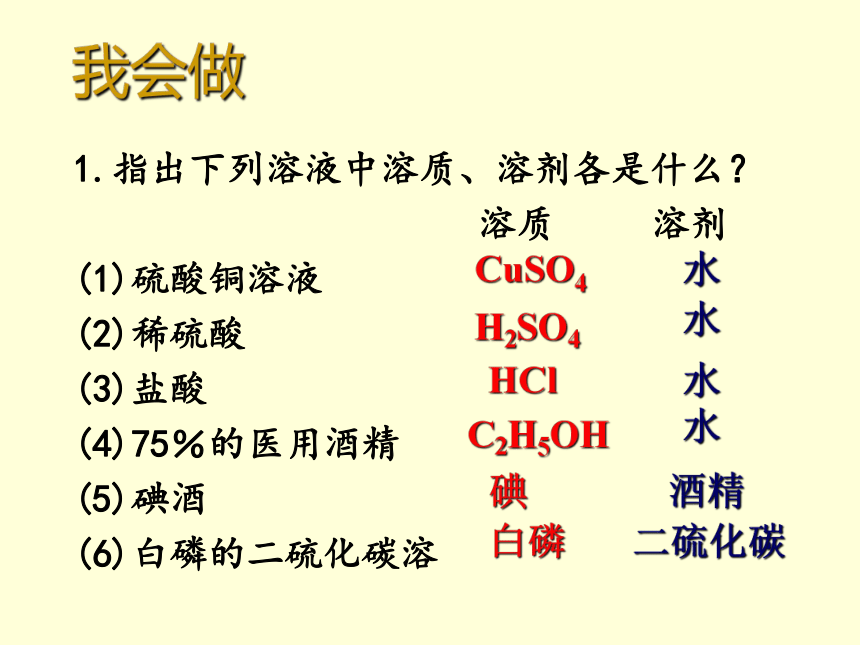
C.汽油 D.植物油CB我会做1.指出下列溶液中溶质、溶剂各是什么?
溶质 溶剂
(1)硫酸铜溶液
(2)稀硫酸
(3)盐酸
(4)75%的医用酒精
(5)碘酒
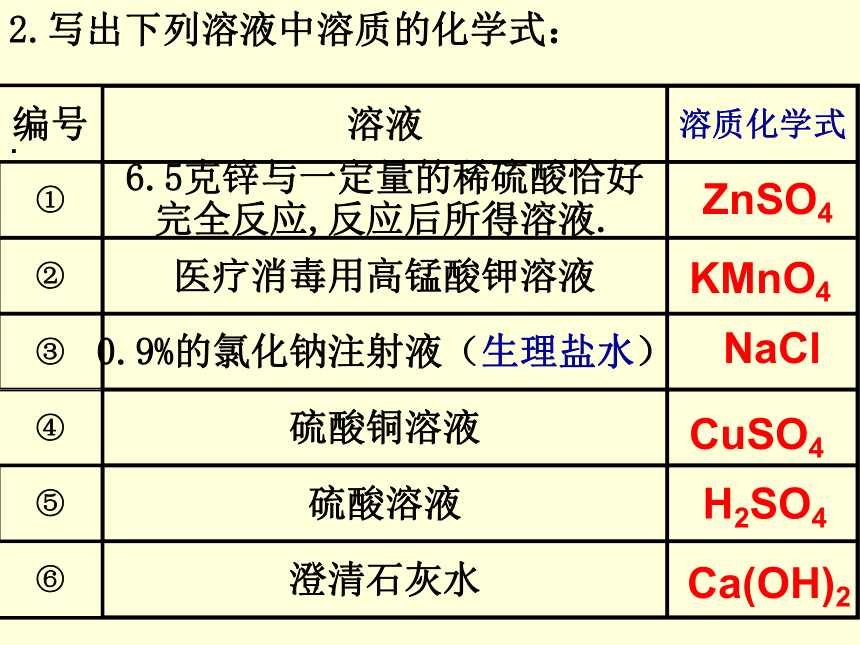
(6)白磷的二硫化碳溶液 CuSO4 水H2SO4 水C2H5OH 水碘酒精白磷二硫化碳HCl 水2.写出下列溶液中溶质的化学式:.KMnO4CuSO4H2SO4ZnSO4NaClCa(OH)2 例题 病人在医院接受静脉注射
或滴注时,常用到生理盐水即氯化
钠注射液。如图是某药业公司生产
的氯化钠注射液标签上的部分文
字。请分析标签后回答:
(1)该注射液里的溶质是 ,溶剂是 。
(2)常温下,一瓶合格的氯化钠注射液密封
放置一段时间后,是否会出现浑浊?为什么?氯化钠注射液
[规格] 100ml 0.9g。
[注意]使用前发现溶液中有絮状物、瓶身细微破裂等均不可使用。
[贮藏]密封保存
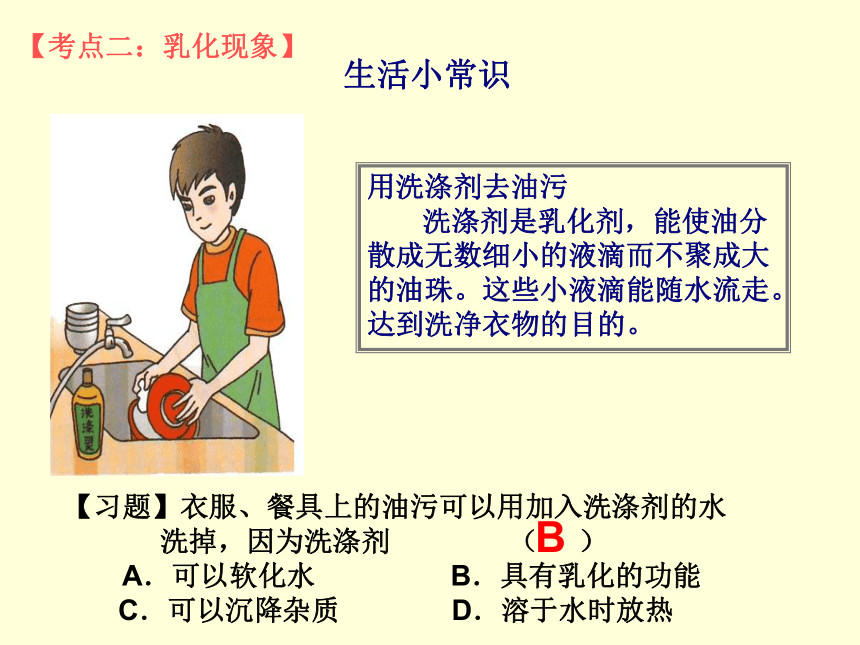
氯化钠不会,因为它是溶液,在密封条件下是稳定的.水用洗涤剂去油污
洗涤剂是乳化剂,能使油分散成无数细小的液滴而不聚成大的油珠。这些小液滴能随水流走。达到洗净衣物的目的。生活小常识【考点二:乳化现象】【习题】衣服、餐具上的油污可以用加入洗涤剂的水洗掉,因为洗涤剂 ( )
A.可以软化水 B.具有乳化的功能
C.可以沉降杂质 D.溶于水时放热B 1.洗涤剂有什么功能? 它的去污原理是什么?答:洗涤剂有乳化功能;洗涤剂的去污原理是:将油污分散成无数小液滴,然后随水流走。(这种现象称为洗涤剂的乳化作用。)【问题】2.修汽车的工人,当他的手上沾满油污时,他常用汽油洗去手上的油污.这说明汽油与洗涤剂一样能去油污,那么二者去油污的原理是否相同?若不同,汽油去油污的原理是什么?答:汽油去油污的原理是将油污溶解在汽油中,形成溶液,从而除去油污。【考点三:溶解时的吸热或放热现象】【联系生活】阳阳同学按教材中的家庭小实验自制汽水,可是家里没有冰箱,为了使自制的汽水变得冰凉可口,他想到可以从集镇上购买一种商品来产生制冷效果,他应该买的是 ( )
A.硝酸铵 B.小苏打 C.生石灰 D.食盐A物质溶于水时温度变化的实质【拓展分析】
扩散过程:发生物理变化
水合过程:发生化学变化
溶质被 溶 解
的 物 质一种或几种
物质分 散 到 另一种 物 质 溶剂 均一、稳 定
的 混 合 物 溶液乳浊液 乳化现象 乳化剂 能溶解其他
物质的物质溶液二、溶解时的吸热和放热现象物质在溶解过程中有的吸收热量,有的放出热量。 小英在做饭时,发现很多因素都能影响食盐在水中溶解的速度。 (1)从你能想到的可能影响食盐在水中溶解速度的因素中,写出其中三项,并预测此因素对食盐溶液速度的影响。因素有: ① ,你的预测 ; ② ,你的预测 ; ③ ,你的预测 。温度温度越高,食盐溶解越快颗粒越小,食盐溶解越快食盐颗粒大小 是否搅拌搅拌能加快食盐的溶解探究实验
溶质溶解的快慢(即速率)与什么有关?溶解度一、饱和溶液与不饱和溶液1.饱和溶液:在一定的温度下,在一定量的溶剂里,不能再溶解某种物质的溶液叫做这种溶质的饱和溶液。2.不饱和溶液:在一定的温度下,在一定量的溶剂里,还能继续溶解某种物质的溶液叫做这种溶质的不饱和溶液。 做一做 向饱和的硝酸钾溶液里加入少量的高锰酸钾,观察现象。注:饱和溶液必须注明是哪种溶质的饱和溶液。 饱和溶液与不饱和溶液的转化饱和溶液 不饱和溶液
升高温度 、增加溶剂降低温度、增加溶质、蒸发溶剂 对于大多数固体: 【练习】
1. 在其他条件不变的情况下,要使接近饱和溶液的硝酸钾溶液达到饱和溶液,下列措施达不到目的的是( )
(A)降低溶液温度; (B)加入溶质硝酸钾;
(C)升高溶液的温度;(D)蒸发溶液中的溶剂。
C例外(熟石灰则用降低温度)例外(熟石灰则用升高温度) 饱和溶液、不饱和溶液 与浓溶液、稀溶液之间的关系(浓度大)(浓度小) 食盐溶解
食盐的不饱和溶液10mL水10mL水熟石灰不完全溶解
熟石灰的饱和溶液0.2g熟石灰2g食盐1.对于不同溶质来说, 浓溶液不一定是饱和溶液, 稀溶液也不一定是不饱和溶液。2.对于同种溶质来说,在一定温度时饱和溶液比不饱和溶液要浓。二、结晶 结晶:从溶液里得到有一定几何形状的晶体的过程结晶方法①蒸发溶剂结晶
适用:溶解度受温度影响小的固体,如NaCl。
应用:从盐水中得NaCl固体可采用蒸发溶剂的方法。②降温结晶即冷却热饱和溶液
适用:溶解度受温度影响大的固体,如硝酸钾。
应用:可分离硝酸钾和氯化钠的混合物,
采用降温结晶法克得较纯的硝酸钾晶体。 NaCl KNO3三、溶解度1.固体物质溶解度(通常用S表示)
在一定温度下,某固体物质在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。 四要素 条件:一定温度标准:100克溶剂(水)状态:饱和状态(最大值)单位:溶质克数(实质)
1.定义:一种或几种物质分散到另一种物质里,形成均一、稳定的混合物。2.特征:均一性、稳定性 3.组成: 溶液 溶质:溶剂:被溶解的物质。能溶解其他物质的物质。(≥1种)(1种)4.溶液、溶质与溶剂之间的量的关系:溶液质量= 溶质质量+溶剂质量 (一般)溶液体积<溶质体积+溶剂体积 5.水是常用的溶剂,还有哪些物质也是常用的溶剂?酒精、汽油等是常用的溶剂。 6.溶液的名称: 某溶质的某溶剂溶液,在不指明溶剂的情况下,溶剂一般为水,如氯化钠溶液。7.溶液的颜色:有些物质溶解后,会使溶液呈现一定的颜色,如:
CuSO4溶液是蓝色的;
FeCl3溶液是黄色的;
FeSO4溶液是浅绿色的;
KMnO4溶液是紫红色的;
NaCl溶液等大多溶液则呈无色。Ca(OH)2H2OC2H5OHH2OI2C2H5OHH2ONaCl 1.请填写下列溶液中溶质和溶剂的化学式:智力快车2. 将家庭中常用的四种调味品分别放
入水中,不能形成溶液的是( )
A.醋 B.蔗糖
C.花生油 D.食盐
3. 配制溶液时,下列溶剂中最常用
的是( )
A.酒精 B.水
C.汽油 D.植物油CB我会做1.指出下列溶液中溶质、溶剂各是什么?
溶质 溶剂
(1)硫酸铜溶液
(2)稀硫酸
(3)盐酸
(4)75%的医用酒精
(5)碘酒
(6)白磷的二硫化碳溶液 CuSO4 水H2SO4 水C2H5OH 水碘酒精白磷二硫化碳HCl 水2.写出下列溶液中溶质的化学式:.KMnO4CuSO4H2SO4ZnSO4NaClCa(OH)2 例题 病人在医院接受静脉注射
或滴注时,常用到生理盐水即氯化
钠注射液。如图是某药业公司生产
的氯化钠注射液标签上的部分文
字。请分析标签后回答:
(1)该注射液里的溶质是 ,溶剂是 。
(2)常温下,一瓶合格的氯化钠注射液密封
放置一段时间后,是否会出现浑浊?为什么?氯化钠注射液
[规格] 100ml 0.9g。
[注意]使用前发现溶液中有絮状物、瓶身细微破裂等均不可使用。
[贮藏]密封保存
氯化钠不会,因为它是溶液,在密封条件下是稳定的.水用洗涤剂去油污
洗涤剂是乳化剂,能使油分散成无数细小的液滴而不聚成大的油珠。这些小液滴能随水流走。达到洗净衣物的目的。生活小常识【考点二:乳化现象】【习题】衣服、餐具上的油污可以用加入洗涤剂的水洗掉,因为洗涤剂 ( )
A.可以软化水 B.具有乳化的功能
C.可以沉降杂质 D.溶于水时放热B 1.洗涤剂有什么功能? 它的去污原理是什么?答:洗涤剂有乳化功能;洗涤剂的去污原理是:将油污分散成无数小液滴,然后随水流走。(这种现象称为洗涤剂的乳化作用。)【问题】2.修汽车的工人,当他的手上沾满油污时,他常用汽油洗去手上的油污.这说明汽油与洗涤剂一样能去油污,那么二者去油污的原理是否相同?若不同,汽油去油污的原理是什么?答:汽油去油污的原理是将油污溶解在汽油中,形成溶液,从而除去油污。【考点三:溶解时的吸热或放热现象】【联系生活】阳阳同学按教材中的家庭小实验自制汽水,可是家里没有冰箱,为了使自制的汽水变得冰凉可口,他想到可以从集镇上购买一种商品来产生制冷效果,他应该买的是 ( )
A.硝酸铵 B.小苏打 C.生石灰 D.食盐A物质溶于水时温度变化的实质【拓展分析】
扩散过程:发生物理变化
水合过程:发生化学变化
溶质被 溶 解
的 物 质一种或几种
物质分 散 到 另一种 物 质 溶剂 均一、稳 定
的 混 合 物 溶液乳浊液 乳化现象 乳化剂 能溶解其他
物质的物质溶液二、溶解时的吸热和放热现象物质在溶解过程中有的吸收热量,有的放出热量。 小英在做饭时,发现很多因素都能影响食盐在水中溶解的速度。 (1)从你能想到的可能影响食盐在水中溶解速度的因素中,写出其中三项,并预测此因素对食盐溶液速度的影响。因素有: ① ,你的预测 ; ② ,你的预测 ; ③ ,你的预测 。温度温度越高,食盐溶解越快颗粒越小,食盐溶解越快食盐颗粒大小 是否搅拌搅拌能加快食盐的溶解探究实验
溶质溶解的快慢(即速率)与什么有关?溶解度一、饱和溶液与不饱和溶液1.饱和溶液:在一定的温度下,在一定量的溶剂里,不能再溶解某种物质的溶液叫做这种溶质的饱和溶液。2.不饱和溶液:在一定的温度下,在一定量的溶剂里,还能继续溶解某种物质的溶液叫做这种溶质的不饱和溶液。 做一做 向饱和的硝酸钾溶液里加入少量的高锰酸钾,观察现象。注:饱和溶液必须注明是哪种溶质的饱和溶液。 饱和溶液与不饱和溶液的转化饱和溶液 不饱和溶液
升高温度 、增加溶剂降低温度、增加溶质、蒸发溶剂 对于大多数固体: 【练习】
1. 在其他条件不变的情况下,要使接近饱和溶液的硝酸钾溶液达到饱和溶液,下列措施达不到目的的是( )
(A)降低溶液温度; (B)加入溶质硝酸钾;
(C)升高溶液的温度;(D)蒸发溶液中的溶剂。
C例外(熟石灰则用降低温度)例外(熟石灰则用升高温度) 饱和溶液、不饱和溶液 与浓溶液、稀溶液之间的关系(浓度大)(浓度小) 食盐溶解
食盐的不饱和溶液10mL水10mL水熟石灰不完全溶解
熟石灰的饱和溶液0.2g熟石灰2g食盐1.对于不同溶质来说, 浓溶液不一定是饱和溶液, 稀溶液也不一定是不饱和溶液。2.对于同种溶质来说,在一定温度时饱和溶液比不饱和溶液要浓。二、结晶 结晶:从溶液里得到有一定几何形状的晶体的过程结晶方法①蒸发溶剂结晶
适用:溶解度受温度影响小的固体,如NaCl。
应用:从盐水中得NaCl固体可采用蒸发溶剂的方法。②降温结晶即冷却热饱和溶液
适用:溶解度受温度影响大的固体,如硝酸钾。
应用:可分离硝酸钾和氯化钠的混合物,
采用降温结晶法克得较纯的硝酸钾晶体。 NaCl KNO3三、溶解度1.固体物质溶解度(通常用S表示)
在一定温度下,某固体物质在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。 四要素 条件:一定温度标准:100克溶剂(水)状态:饱和状态(最大值)单位:溶质克数(实质)
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
