人教版(五四制)九年级化学 3.3 实验活动3 酸、碱的化学性质 课件(15张PPT)
文档属性
| 名称 | 人教版(五四制)九年级化学 3.3 实验活动3 酸、碱的化学性质 课件(15张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 403.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-28 00:00:00 | ||
图片预览






文档简介
课件15张PPT。酸的化学性质活动探究一盐酸中的什么成分使石蕊试液变色?H+?Cl- ?H2O ?探究过程提出问题
或假设验证假设
实验步骤实验现象结论 1、有两瓶未贴标签的稀盐酸和NaCl溶液(中性溶液),请同学们想想有哪些方法可以鉴别出来? 2、你提出的这些方案的依据什么? 你的方案一:用紫色石蕊溶液酸的溶液能使紫色石蕊变成红色
中性盐溶液不能使紫色的石蕊试液变色,故溶液仍为紫色。酸的溶液不能使无色酚酞溶液变色
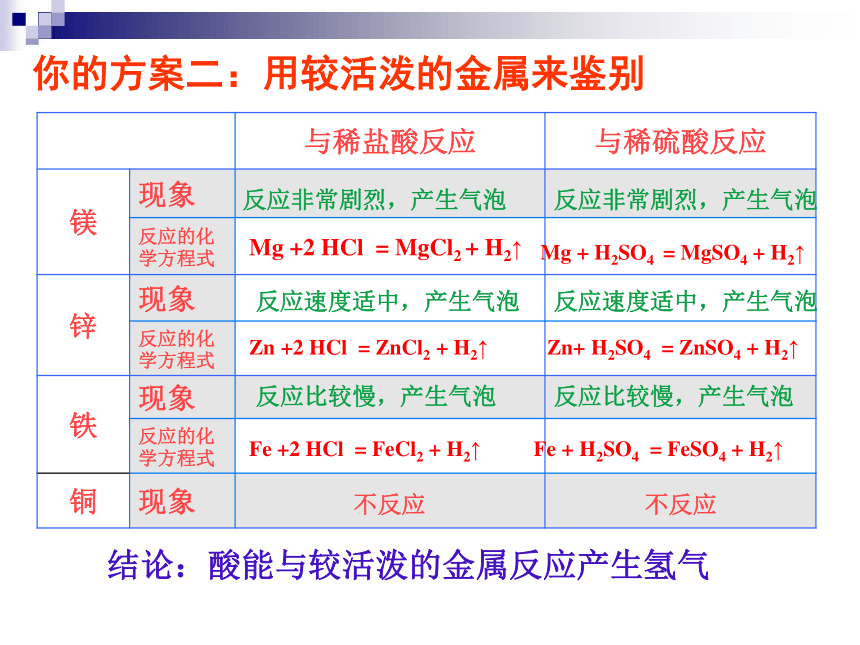
中性盐溶液同样不能使无色的酚酞试液变色紫色石蕊变成溶液紫色紫色石蕊变成溶液红色无色酚酞溶液不变色无色酚酞溶液不变色依据:紫色石蕊遇酸溶液变成红色结论:酸能与指示剂反应你的方案二:用较活泼的金属来鉴别结论:酸能与较活泼的金属反应产生氢气反应非常剧烈,产生气泡反应非常剧烈,产生气泡反应速度适中,产生气泡反应速度适中,产生气泡反应比较慢,产生气泡反应比较慢,产生气泡写出铝与盐酸和稀硫酸反应的方程式 我能写 你还想知道方案三吗?2Al + 6HCl = 2AlCl3 + 3H2 ↑
2Al + 3H2SO4 = Al2(SO4 )3+ 3H2↑酸也是除锈专家 !问题:
同学们在日常生活中见到过或用到过哪些除铁锈的方法?分别属于哪些方法?(物理变化还是化学变化)小贴士:铁锈的主要成分是Fe2O3 实验:将一根生锈的铁钉分别用细线系好放入盛有稀盐酸和稀硫酸的试管里,仔细观察一会儿,取出,用水洗净铁钉,铁钉表面和溶液颜色有什么变化? 铁锈逐渐溶解,溶液变为黄色讨论:
①上面几个反应中的生成物有什么共同之处?
②利用上面的反应可以清除金属制品表面的锈,除锈时能否将金属制品长时间浸在酸中?为什么? 刚才同学们在实验中观察到实验现象归纳起来有两种:
1、开始时观察到铁锈逐渐消失,溶液由无色慢慢变成黄色 。
2、开始时观察到铁锈逐渐消失,溶液由无色慢慢变成黄色,当铁锈消失以后,铁钉表面会冒出气泡。这是为什么呢?加入的酸过少时铁锈无法除尽,过量时会导致酸进一步腐蚀金属! 根据上面的化学方程式特点,请你写出氧化铜与盐酸或硫酸反应的化学方程式,并回答方案三的内容及酸的性质。CuO+2HCl=CuCl2+H2O
CuO+H2SO4=CuSO4+H2O结论:酸能与金属氧化物反应有水生成一、酸能使酸碱指示剂显示不同的颜色;二、酸能与多种活泼金属反应,生成氢气;三、酸能与某些金属氧化物反应,生成水。酸有一些相似的化学性质:盘点一下我们的收获吧!你还有什么收获?方法从个别推导到一般
从具体到抽象我来试一试1、请判断下列化学方程式是否正确
A、2Fe+6HCl=2FeCl3+3H2 ↑
B 、Fe + H2SO4 = FeSO4 + H2↑
C、 2Al + 3H2SO4 = Al2(SO4 )3+ 3H2↑
D 、Cu +2 HCl = Cu Cl2 + H2↑
E、Fe2O3+ 6 HCl =2FeCl2 +3H2O 1、 如何用图像表示等质量的镁、铁、锌三种金属分别与溶质质量分数相同的足量的稀硫酸反应所需时间与产生氢气的关系图?如何解释?拓展:2、已知:
H2SO4+Na2CO3=Na2SO4+H2O+CO2↑、
2HCl+Na2CO3=2NaCl+H2O+CO2↑
请根据所给信息推理出合理的结论。 谢谢大家! 请同学们将桌上的实验
器材收整齐,依次离开!
或假设验证假设
实验步骤实验现象结论 1、有两瓶未贴标签的稀盐酸和NaCl溶液(中性溶液),请同学们想想有哪些方法可以鉴别出来? 2、你提出的这些方案的依据什么? 你的方案一:用紫色石蕊溶液酸的溶液能使紫色石蕊变成红色
中性盐溶液不能使紫色的石蕊试液变色,故溶液仍为紫色。酸的溶液不能使无色酚酞溶液变色
中性盐溶液同样不能使无色的酚酞试液变色紫色石蕊变成溶液紫色紫色石蕊变成溶液红色无色酚酞溶液不变色无色酚酞溶液不变色依据:紫色石蕊遇酸溶液变成红色结论:酸能与指示剂反应你的方案二:用较活泼的金属来鉴别结论:酸能与较活泼的金属反应产生氢气反应非常剧烈,产生气泡反应非常剧烈,产生气泡反应速度适中,产生气泡反应速度适中,产生气泡反应比较慢,产生气泡反应比较慢,产生气泡写出铝与盐酸和稀硫酸反应的方程式 我能写 你还想知道方案三吗?2Al + 6HCl = 2AlCl3 + 3H2 ↑
2Al + 3H2SO4 = Al2(SO4 )3+ 3H2↑酸也是除锈专家 !问题:
同学们在日常生活中见到过或用到过哪些除铁锈的方法?分别属于哪些方法?(物理变化还是化学变化)小贴士:铁锈的主要成分是Fe2O3 实验:将一根生锈的铁钉分别用细线系好放入盛有稀盐酸和稀硫酸的试管里,仔细观察一会儿,取出,用水洗净铁钉,铁钉表面和溶液颜色有什么变化? 铁锈逐渐溶解,溶液变为黄色讨论:
①上面几个反应中的生成物有什么共同之处?
②利用上面的反应可以清除金属制品表面的锈,除锈时能否将金属制品长时间浸在酸中?为什么? 刚才同学们在实验中观察到实验现象归纳起来有两种:
1、开始时观察到铁锈逐渐消失,溶液由无色慢慢变成黄色 。
2、开始时观察到铁锈逐渐消失,溶液由无色慢慢变成黄色,当铁锈消失以后,铁钉表面会冒出气泡。这是为什么呢?加入的酸过少时铁锈无法除尽,过量时会导致酸进一步腐蚀金属! 根据上面的化学方程式特点,请你写出氧化铜与盐酸或硫酸反应的化学方程式,并回答方案三的内容及酸的性质。CuO+2HCl=CuCl2+H2O
CuO+H2SO4=CuSO4+H2O结论:酸能与金属氧化物反应有水生成一、酸能使酸碱指示剂显示不同的颜色;二、酸能与多种活泼金属反应,生成氢气;三、酸能与某些金属氧化物反应,生成水。酸有一些相似的化学性质:盘点一下我们的收获吧!你还有什么收获?方法从个别推导到一般
从具体到抽象我来试一试1、请判断下列化学方程式是否正确
A、2Fe+6HCl=2FeCl3+3H2 ↑
B 、Fe + H2SO4 = FeSO4 + H2↑
C、 2Al + 3H2SO4 = Al2(SO4 )3+ 3H2↑
D 、Cu +2 HCl = Cu Cl2 + H2↑
E、Fe2O3+ 6 HCl =2FeCl2 +3H2O 1、 如何用图像表示等质量的镁、铁、锌三种金属分别与溶质质量分数相同的足量的稀硫酸反应所需时间与产生氢气的关系图?如何解释?拓展:2、已知:
H2SO4+Na2CO3=Na2SO4+H2O+CO2↑、
2HCl+Na2CO3=2NaCl+H2O+CO2↑
请根据所给信息推理出合理的结论。 谢谢大家! 请同学们将桌上的实验
器材收整齐,依次离开!
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
