第1节 金属的性质和利用 第二课时 金属的化学性质 课件 (18张PPT)
文档属性
| 名称 | 第1节 金属的性质和利用 第二课时 金属的化学性质 课件 (18张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 231.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-28 00:00:00 | ||
图片预览






文档简介
课件18张PPT。第五章 金属的冶炼与利用
第1节 金属的性质和利用
第二课时 金属的化学性质
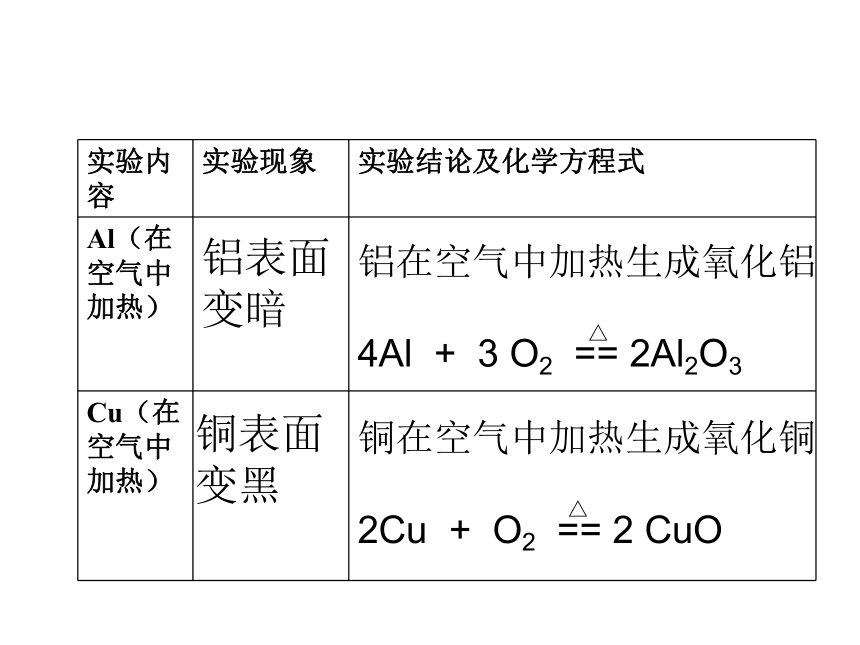
回顾旧知金属与氧气反应: 剧烈燃烧,火星四射,放出大量的热,生成黑色固体剧烈燃烧,发出耀眼的白光,放热,生成白色固体铁在纯氧中燃烧生成四氧化三铁镁在空气中燃烧生成氧化镁二.金属的化学性质金属 + 氧气 → 金属氧化物1.金属与氧气反应 Al + O2 === ?
Cu + O2 === ?铝表面变暗铜表面变黑铝在空气中加热生成氧化铝
4Al + 3 O2 == 2Al2O3 铜在空气中加热生成氧化铜
2Cu + O2 == 2 CuO △△ 铝是银白色的金属,具有金属光泽,而生活中的铝制品却往往是暗淡无色,知道为什么吗? 原因:常温下,铝就能和氧气发生反应,在其表面生成一层致密的氧化铝保护膜(Al2O3)。4Al + 3O2 = 2Al2O3致密金属的自我保护思考:铁在常温下能与O2反应吗?活动与探究提出问题:金属与酸溶液能否发生反应?设计实验:铁、镁、锌、铜与稀盐酸反应实验仪器
和药品:试管、镊子、
铁丝、镁条、锌粒、铜丝、稀盐酸实验操作:分别取一小段铁丝、镁条、
锌粒、铜丝于四支试管中,
分别滴加稀盐酸。2.金属与稀盐酸反应金属与盐酸的反应镁、锌、铁、铜的金属活动性由强到弱MgZnFeCu铁表面有少量气泡缓慢
冒出,放热,无色溶液
变成浅绿色。镁表面有大量气泡迅速冒
出,放热,固体逐渐消失。锌表面有气泡较快
冒出,放热。无明显现象铁,镁,锌能与稀盐酸反应,而铜不能。
金属活动性:镁>锌>铁>铜。金属与酸溶液反应的化学方程式FeHClFeFeHCl222↑练习:请写出锌、镁分别与稀盐酸反应的化学方程式ZnZnZn↑练习:请写出铁、镁分别与稀硫酸反应的化学方程式金属与酸溶液反应的剧烈程度、反应速率
与 有关。金属活动性、温度、酸的浓度、金属表面积常见金属的活动性顺序表:
钾钙钠镁铝;锌铁锡铅氢;铜汞银铂金。Mg + 2HCl = H2↑ + MgCl2 下面是我们刚才探究时发生的一些反应。请从反应物和生成物的物质类别的角度分析,这些反应有什么特点?单质化合物单质化合物Fe + H2SO4 = H2↑ + FeSO4Zn + H2SO4 = H2↑ + ZnSO4特点:ABCAAB 由一种单质跟一种化合物作用生成另一种单质和另一种化合物的反应叫置换反应。化合反应:A + B = AB
分解反应:AB = A + B3.置换反应:C金属+酸→化合物+氢气化合价一定改变种类分类下列反应都是置换反应吗?
3CO + Fe2O3 ==== 2Fe + 3CO2高温点燃Cl2 + 2KI ==== I2 + 2KClCH4 + 2O2 ==== CO2 + 2H2O2Na + 2H2O = 2NaOH + H2↑ Fe+CuSO4=4.铁与硫酸铜溶液反应FeSO4+Cu1.铁片表面覆盖一层红色物质,
2.溶液由蓝色变为浅绿色为什么铁可以把铜从硫酸铜溶液中置换出来思考金属的活动性推测铜与硝酸银溶液能否反应Cu + AgNO3 =Cu(NO3)2 + Ag2 2金属的化学性质金属与O2反应金属与酸溶液反应燃烧分类Mg + 2HCl = H2↑+ MgCl2Zn+H2SO4 =H2↑+ZnSO4金属与化合物溶液反应Fe+CuSO4=FeSO4+Cu化合反应置换反应1.经研究发现,长期使用铁锅炒菜做饭,可有效地减少缺铁性贫血的发生,如果在炒菜时加入适量的食用醋,效果会更好,原因是_____________________。
应用2.日前,国家开始研究在我国南方部分地区集中供暖。暖气片一般是用铁做的,为何要涂上银粉(铝粉)?
第1节 金属的性质和利用
第二课时 金属的化学性质
回顾旧知金属与氧气反应: 剧烈燃烧,火星四射,放出大量的热,生成黑色固体剧烈燃烧,发出耀眼的白光,放热,生成白色固体铁在纯氧中燃烧生成四氧化三铁镁在空气中燃烧生成氧化镁二.金属的化学性质金属 + 氧气 → 金属氧化物1.金属与氧气反应 Al + O2 === ?
Cu + O2 === ?铝表面变暗铜表面变黑铝在空气中加热生成氧化铝
4Al + 3 O2 == 2Al2O3 铜在空气中加热生成氧化铜
2Cu + O2 == 2 CuO △△ 铝是银白色的金属,具有金属光泽,而生活中的铝制品却往往是暗淡无色,知道为什么吗? 原因:常温下,铝就能和氧气发生反应,在其表面生成一层致密的氧化铝保护膜(Al2O3)。4Al + 3O2 = 2Al2O3致密金属的自我保护思考:铁在常温下能与O2反应吗?活动与探究提出问题:金属与酸溶液能否发生反应?设计实验:铁、镁、锌、铜与稀盐酸反应实验仪器
和药品:试管、镊子、
铁丝、镁条、锌粒、铜丝、稀盐酸实验操作:分别取一小段铁丝、镁条、
锌粒、铜丝于四支试管中,
分别滴加稀盐酸。2.金属与稀盐酸反应金属与盐酸的反应镁、锌、铁、铜的金属活动性由强到弱MgZnFeCu铁表面有少量气泡缓慢
冒出,放热,无色溶液
变成浅绿色。镁表面有大量气泡迅速冒
出,放热,固体逐渐消失。锌表面有气泡较快
冒出,放热。无明显现象铁,镁,锌能与稀盐酸反应,而铜不能。
金属活动性:镁>锌>铁>铜。金属与酸溶液反应的化学方程式FeHClFeFeHCl222↑练习:请写出锌、镁分别与稀盐酸反应的化学方程式ZnZnZn↑练习:请写出铁、镁分别与稀硫酸反应的化学方程式金属与酸溶液反应的剧烈程度、反应速率
与 有关。金属活动性、温度、酸的浓度、金属表面积常见金属的活动性顺序表:
钾钙钠镁铝;锌铁锡铅氢;铜汞银铂金。Mg + 2HCl = H2↑ + MgCl2 下面是我们刚才探究时发生的一些反应。请从反应物和生成物的物质类别的角度分析,这些反应有什么特点?单质化合物单质化合物Fe + H2SO4 = H2↑ + FeSO4Zn + H2SO4 = H2↑ + ZnSO4特点:ABCAAB 由一种单质跟一种化合物作用生成另一种单质和另一种化合物的反应叫置换反应。化合反应:A + B = AB
分解反应:AB = A + B3.置换反应:C金属+酸→化合物+氢气化合价一定改变种类分类下列反应都是置换反应吗?
3CO + Fe2O3 ==== 2Fe + 3CO2高温点燃Cl2 + 2KI ==== I2 + 2KClCH4 + 2O2 ==== CO2 + 2H2O2Na + 2H2O = 2NaOH + H2↑ Fe+CuSO4=4.铁与硫酸铜溶液反应FeSO4+Cu1.铁片表面覆盖一层红色物质,
2.溶液由蓝色变为浅绿色为什么铁可以把铜从硫酸铜溶液中置换出来思考金属的活动性推测铜与硝酸银溶液能否反应Cu + AgNO3 =Cu(NO3)2 + Ag2 2金属的化学性质金属与O2反应金属与酸溶液反应燃烧分类Mg + 2HCl = H2↑+ MgCl2Zn+H2SO4 =H2↑+ZnSO4金属与化合物溶液反应Fe+CuSO4=FeSO4+Cu化合反应置换反应1.经研究发现,长期使用铁锅炒菜做饭,可有效地减少缺铁性贫血的发生,如果在炒菜时加入适量的食用醋,效果会更好,原因是_____________________。
应用2.日前,国家开始研究在我国南方部分地区集中供暖。暖气片一般是用铁做的,为何要涂上银粉(铝粉)?
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
