第2节 金属矿物 铁的冶炼教学课件 (23张PPT)
文档属性
| 名称 | 第2节 金属矿物 铁的冶炼教学课件 (23张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-28 09:22:37 | ||
图片预览





文档简介
课件23张PPT。§ 5-2 铁的冶炼
一、常见金属矿物1、分布和存在金属在自然界中主要以单质存在,还是以化合物存在?极少数不活泼的金属以单质(游离态)存在 自然界中以单质存在的银自然界中以单质存在的金磁铁矿的主要成分为Fe3O4 黄铁矿的主要成分是FeS2 常见的矿石赤铁矿(主要成分为Fe2O3) 褐铁矿(Fe2O3·nH2O)孔雀石Cu2(OH)2CO3赤铜矿Cu2OAl2O3铝土矿怎样从金属矿物中提取金属呢?
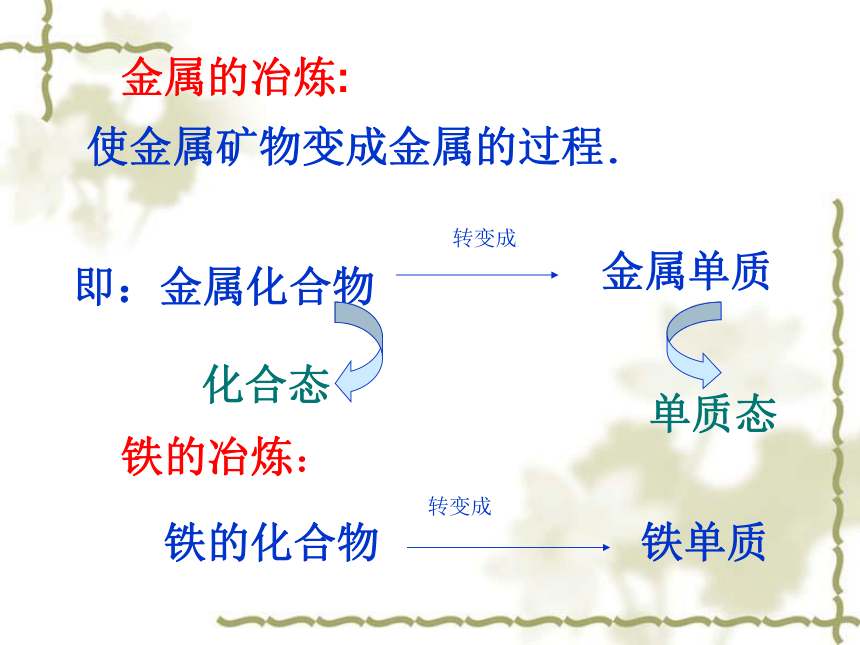
金属的冶炼:即:金属化合物金属单质化合态单质态转变成使金属矿物变成金属的过程.铁的冶炼:铁的化合物转变成铁单质
选择赤铁矿,因为赤铁矿在自然界中含量大,
含硫量少对环境污染少.成本比较低。
现在以铁的冶炼为例:有赤铁矿(Fe2O3)、磁铁矿(Fe3O4)、黄铁矿(FeS2).你会选择以哪种矿石为原料冶炼铁,为什么?我反思 我提高(从环保,含量来考虑)
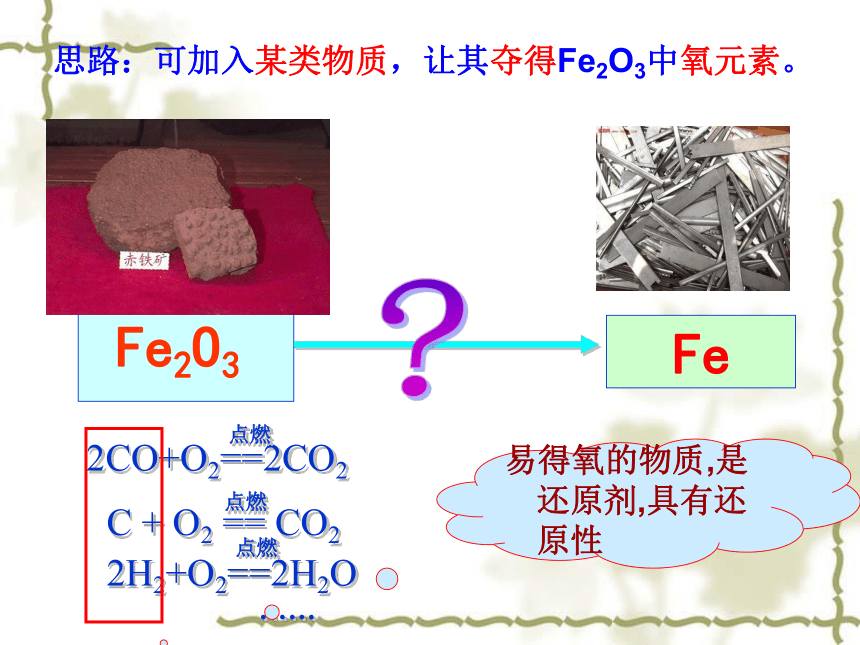
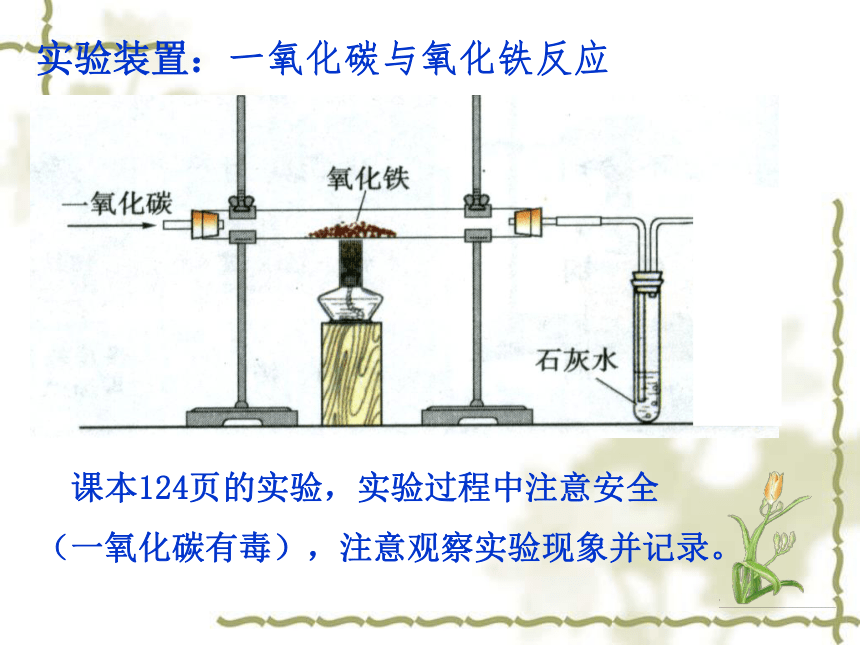
Fe2O3 Fe思路:可加入某类物质,让其夺得Fe2O3中氧元素。易得氧的物质,是还原剂,具有还原性 课本124页的实验,实验过程中注意安全
(一氧化碳有毒),注意观察实验现象并记录。实验装置:一氧化碳与氧化铁反应
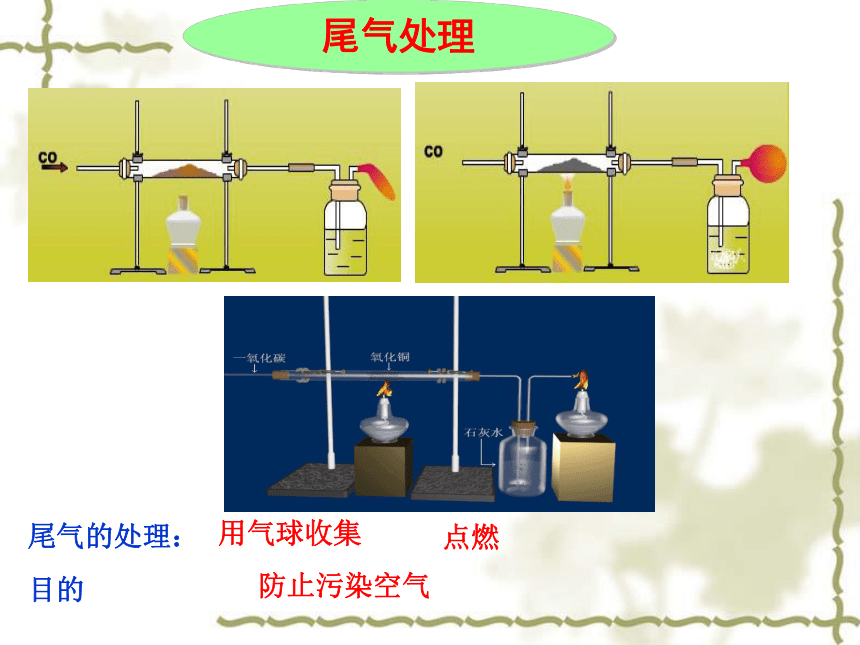
尾气的处理:
目的点燃用气球收集防止污染空气尾气处理 1.红棕色粉未变成黑色粉未实验现象 2.澄清石灰水变浑浊产物的检验黑色物质可能是什么?如何检验?查阅资料:(1)铁粉以及铁的氧化物(除氧化铁外)都是黑色,
且都溶于盐酸,只有铁反应时有气泡冒出。
(2)铁和四氧化三铁都有磁性,均能被磁铁吸引。
给氧化铁加热
通入CO停止通入CO
停止加热①通入CO
②给氧化铁加热③停止加热
④停止通入CO实验注意事项 排出装置内的空气,以免加热时CO与空气混合,发生爆炸。(1)、防止铁在高温下重新被氧化
(2)、防止石灰水倒吸,使试管炸裂CO早出晚归,酒精灯迟到早退你能写出化学方程式吗?
如果选用磁铁矿(Fe3O4)来炼铁呢? 1、某同学改进一氧化碳还原氧化铁的实验装置如图所示:
(1)若先给氧化铁加热,再通入一氧化碳可能产生的后果是 。
(2)写出A中发生反应的化学式 。
(3)B装置中产生的现象可判断反应是否开始发生,B试剂 是 。
(4)C装置的作用是 。
(5)C装置收集气体的方法叫 。
练习与实践Fe2O3COABC发生爆炸高温3CO+Fe2O3==2Fe+3CO2澄清石灰水收集未反应的CO,防止污染空气排水法1、炼铁的原料:(1)铁矿石:
(2)焦 炭:
(3)石灰石:
(4)空 气:提供铁 元素a、提供热源、维持炉温
b、制一氧化碳造渣除杂 提供氧气2、炼铁的主要设备是:主要反应C+O2===CO2C+CO2===2CO3CO+Fe2O3===2Fe+3CO2
高温高温点燃高炉
炼铁的原料是( )
A、铁矿石、一氧化碳、空气
B、铁矿石、烟煤、生石灰
C、铁矿石、焦炭、空气
D、铁矿石、焦炭、石灰石、空气D练习与实践我今天知道了: 1、炼铁选用的铁矿石通常不仅要求含铁量高,而且要“有害元素”少,下列铁矿石你认为不适宜炼铁的是:
( )
A.磁铁矿(Fe3O4)72.4%
B.赤铁矿(Fe2O3)70%
C.菱铁矿(FeCO3)48.3%
D.黄铁矿(FeS2)46.7%D 2、如图是用一氧化碳
还原氧化铜的实验装置,
回答下列问题:
(1)有下列实验步骤:
①加热;②通入一氧化碳。请用上述实验步骤的标号填空,实验开始时,应先_____,然后______。
(2)实验进行一段时间后,A装置中出现的现象为_______ ___,说明有____ _生成,B装置中出现的现象为______________,说明有_________生成。①②粉末由黑变红Cu石灰水变浑CO2(3)装置A中的反应化学方程式为_________________,
装置B中的反应化学方程式为_______________________,
装置C中的目的是_________________。
(4)反应结束,应先__________,待冷却后__________。 CO2+Ca(OH)2=CaCO3↓+H2O除尾气,防污染停止加热停止通气 由于不同的金属的化学活动性不同,因此,常采用不同的冶炼方法。热还原法、电解法、热分解法等。
利用还原剂在高温下将金属从化合物中还原出来。Fe2O3 + 3CO === 2Fe + 3CO2
2CuO + C === 2Cu + CO2
高温 高温 高温热还原法通常把金属(如铁)跟氧气结合生成金属氧化物(如氧化铁)的过程称为金属的氧化 金属氧化物跟焦碳、氢气、一氧化碳等物质反应,失去氧转化为金属的过程称为金属氧化物的还原高炉炼铁金属的常用冶炼方法热分解法2HgO === 2Hg + O2↑ 2Ag2O === 4Ag + O2↑常用于不活泼金属(Hg、Ag等)的冶炼。Au、Pt可通过金沙淘洗获得。电解法 在金属活动性顺序中,K、Na、Ca、Al等活泼金属的还原性很强,都很容易失去电子,因此不能用一般的方法和还原剂使其从化合物中还原出来,只能用通电分解其熔融盐或氧化物的方法来冶炼。2Al2O3====4Al + 3O2↑ 2NaCl====2Na + Cl2↑通电通电△△金属的常用冶炼方法
一、常见金属矿物1、分布和存在金属在自然界中主要以单质存在,还是以化合物存在?极少数不活泼的金属以单质(游离态)存在 自然界中以单质存在的银自然界中以单质存在的金磁铁矿的主要成分为Fe3O4 黄铁矿的主要成分是FeS2 常见的矿石赤铁矿(主要成分为Fe2O3) 褐铁矿(Fe2O3·nH2O)孔雀石Cu2(OH)2CO3赤铜矿Cu2OAl2O3铝土矿怎样从金属矿物中提取金属呢?
金属的冶炼:即:金属化合物金属单质化合态单质态转变成使金属矿物变成金属的过程.铁的冶炼:铁的化合物转变成铁单质
选择赤铁矿,因为赤铁矿在自然界中含量大,
含硫量少对环境污染少.成本比较低。
现在以铁的冶炼为例:有赤铁矿(Fe2O3)、磁铁矿(Fe3O4)、黄铁矿(FeS2).你会选择以哪种矿石为原料冶炼铁,为什么?我反思 我提高(从环保,含量来考虑)
Fe2O3 Fe思路:可加入某类物质,让其夺得Fe2O3中氧元素。易得氧的物质,是还原剂,具有还原性 课本124页的实验,实验过程中注意安全
(一氧化碳有毒),注意观察实验现象并记录。实验装置:一氧化碳与氧化铁反应
尾气的处理:
目的点燃用气球收集防止污染空气尾气处理 1.红棕色粉未变成黑色粉未实验现象 2.澄清石灰水变浑浊产物的检验黑色物质可能是什么?如何检验?查阅资料:(1)铁粉以及铁的氧化物(除氧化铁外)都是黑色,
且都溶于盐酸,只有铁反应时有气泡冒出。
(2)铁和四氧化三铁都有磁性,均能被磁铁吸引。
给氧化铁加热
通入CO停止通入CO
停止加热①通入CO
②给氧化铁加热③停止加热
④停止通入CO实验注意事项 排出装置内的空气,以免加热时CO与空气混合,发生爆炸。(1)、防止铁在高温下重新被氧化
(2)、防止石灰水倒吸,使试管炸裂CO早出晚归,酒精灯迟到早退你能写出化学方程式吗?
如果选用磁铁矿(Fe3O4)来炼铁呢? 1、某同学改进一氧化碳还原氧化铁的实验装置如图所示:
(1)若先给氧化铁加热,再通入一氧化碳可能产生的后果是 。
(2)写出A中发生反应的化学式 。
(3)B装置中产生的现象可判断反应是否开始发生,B试剂 是 。
(4)C装置的作用是 。
(5)C装置收集气体的方法叫 。
练习与实践Fe2O3COABC发生爆炸高温3CO+Fe2O3==2Fe+3CO2澄清石灰水收集未反应的CO,防止污染空气排水法1、炼铁的原料:(1)铁矿石:
(2)焦 炭:
(3)石灰石:
(4)空 气:提供铁 元素a、提供热源、维持炉温
b、制一氧化碳造渣除杂 提供氧气2、炼铁的主要设备是:主要反应C+O2===CO2C+CO2===2CO3CO+Fe2O3===2Fe+3CO2
高温高温点燃高炉
炼铁的原料是( )
A、铁矿石、一氧化碳、空气
B、铁矿石、烟煤、生石灰
C、铁矿石、焦炭、空气
D、铁矿石、焦炭、石灰石、空气D练习与实践我今天知道了: 1、炼铁选用的铁矿石通常不仅要求含铁量高,而且要“有害元素”少,下列铁矿石你认为不适宜炼铁的是:
( )
A.磁铁矿(Fe3O4)72.4%
B.赤铁矿(Fe2O3)70%
C.菱铁矿(FeCO3)48.3%
D.黄铁矿(FeS2)46.7%D 2、如图是用一氧化碳
还原氧化铜的实验装置,
回答下列问题:
(1)有下列实验步骤:
①加热;②通入一氧化碳。请用上述实验步骤的标号填空,实验开始时,应先_____,然后______。
(2)实验进行一段时间后,A装置中出现的现象为_______ ___,说明有____ _生成,B装置中出现的现象为______________,说明有_________生成。①②粉末由黑变红Cu石灰水变浑CO2(3)装置A中的反应化学方程式为_________________,
装置B中的反应化学方程式为_______________________,
装置C中的目的是_________________。
(4)反应结束,应先__________,待冷却后__________。 CO2+Ca(OH)2=CaCO3↓+H2O除尾气,防污染停止加热停止通气 由于不同的金属的化学活动性不同,因此,常采用不同的冶炼方法。热还原法、电解法、热分解法等。
利用还原剂在高温下将金属从化合物中还原出来。Fe2O3 + 3CO === 2Fe + 3CO2
2CuO + C === 2Cu + CO2
高温 高温 高温热还原法通常把金属(如铁)跟氧气结合生成金属氧化物(如氧化铁)的过程称为金属的氧化 金属氧化物跟焦碳、氢气、一氧化碳等物质反应,失去氧转化为金属的过程称为金属氧化物的还原高炉炼铁金属的常用冶炼方法热分解法2HgO === 2Hg + O2↑ 2Ag2O === 4Ag + O2↑常用于不活泼金属(Hg、Ag等)的冶炼。Au、Pt可通过金沙淘洗获得。电解法 在金属活动性顺序中,K、Na、Ca、Al等活泼金属的还原性很强,都很容易失去电子,因此不能用一般的方法和还原剂使其从化合物中还原出来,只能用通电分解其熔融盐或氧化物的方法来冶炼。2Al2O3====4Al + 3O2↑ 2NaCl====2Na + Cl2↑通电通电△△金属的常用冶炼方法
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
