人教版(五四制)九年级化学 4.3 实验活动5 粗盐中难溶性杂志的去除 课件(20张PPT)
文档属性
| 名称 | 人教版(五四制)九年级化学 4.3 实验活动5 粗盐中难溶性杂志的去除 课件(20张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-28 10:21:08 | ||
图片预览






文档简介
(共20张PPT)
粗盐提纯
精盐
粗盐
粗盐提纯
一.杂质:可溶、不可溶
二.实验室提纯
1)溶解
烧杯、玻璃棒
仪器:
2)过滤
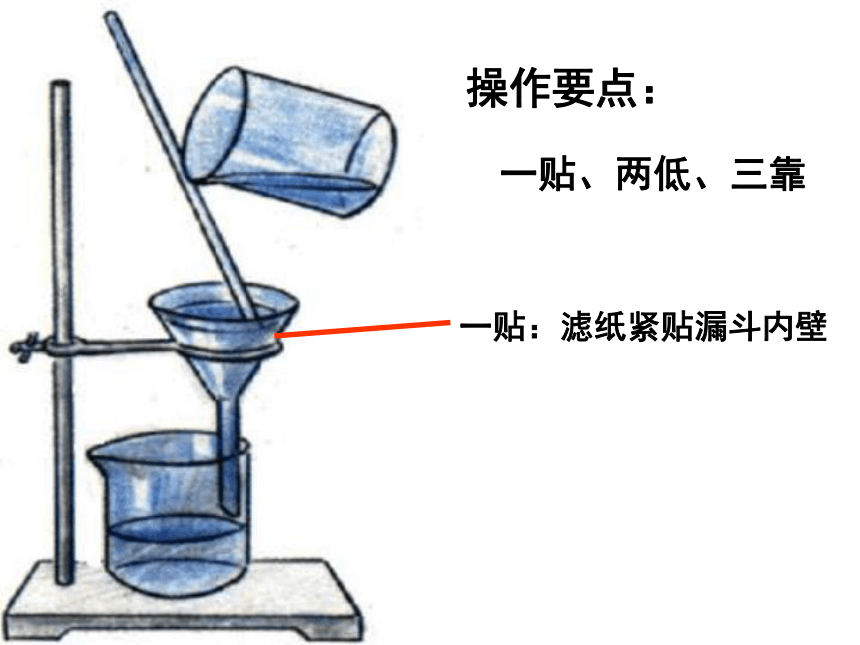
操作要点:
一贴、二低、三靠
将粗盐水转移入过滤皿中,用烧杯承接滤液。
操作要点:
一贴、两低、三靠
一贴:滤纸紧贴漏斗内壁
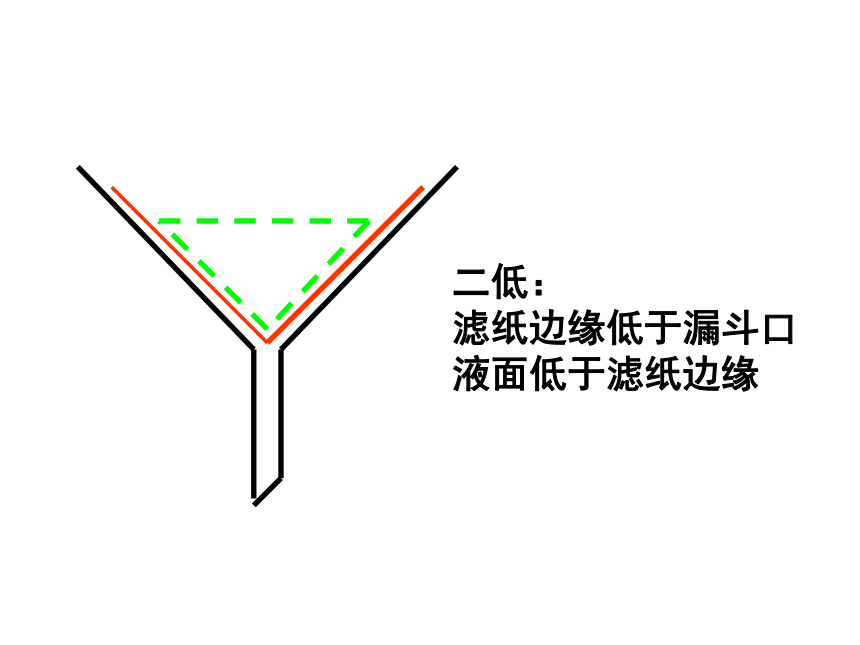
二低:
滤纸边缘低于漏斗口
液面低于滤纸边缘
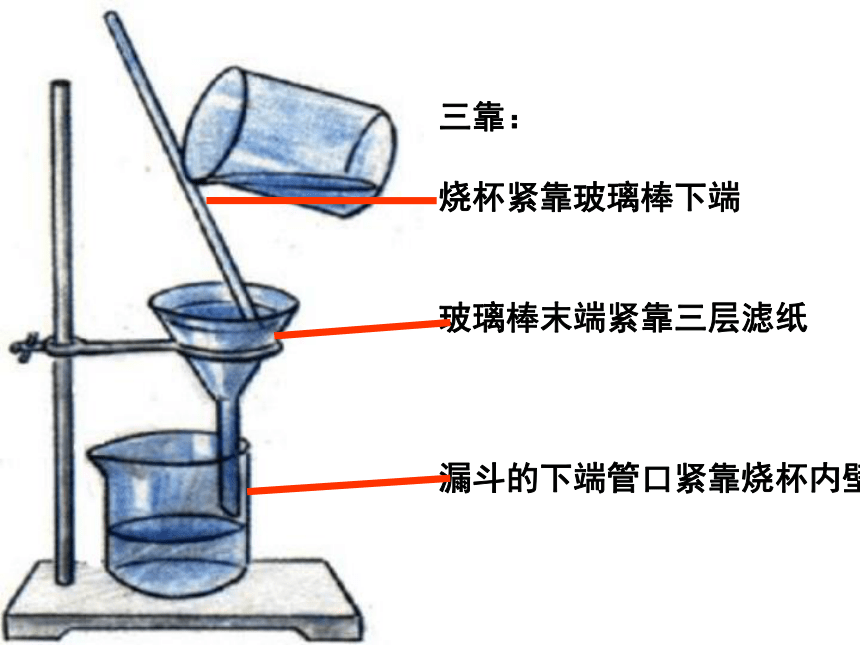
三靠:
烧杯紧靠玻璃棒下端
玻璃棒末端紧靠三层滤纸
漏斗的下端管口紧靠烧杯内壁
3)蒸发
将滤液转入蒸发皿中,加热并不断搅拌,当有大量固体出现时,停止加热。
粗盐提纯
1、除去不溶性杂质(如泥沙)的方法:
①溶解 ② 过滤 ③ 蒸发
溶解时玻璃棒的作用是
过滤时玻璃棒的作用是
蒸发时玻璃棒的作用是
加快溶解速率
引流(控制液体的流量和流向)
使液体受热均匀,防止液体飞溅
思考:
粗盐中的可溶性杂质主要是CaCl2
MgCl2 、Na2SO4等,如何除去
温馨提示:
首先要选试剂,若试剂不只一种,要考虑试剂的加入顺序。
提纯和分离遵循三个原则:
不增(不增加新杂质)、
不减(不减少主要成分)、
易分离(反应后物质状态不同,便于分离)
可溶性杂质的除法:
(1)原则:
除去杂质的同时不引入新的杂质
(2)方法:
加入化学试剂,让杂质离子转化成气体、沉淀或水除去
(3)步骤:
①溶解②加入试剂③过滤④蒸发
Ca2+ → 碳酸钠溶液
Mg2+ → 氢氧化钠溶液
SO42— → 氯化钡溶液
化学方法
Na2CO3 盐酸
BaCl2 NaOH
Na+ Cl-SO42- Ca2+ Mg2+
方案
1、BaCl2,NaOH,Na2CO3 过滤 盐酸
2、BaCl2 , Na2CO3, NaOH,过滤 , 盐酸
3、 NaOH , BaCl2 , Na2CO3, 过滤 ,盐酸
Na+ Cl-
H2O
SO42- Ca2+ Mg2+
⑤适量 HCI
Na+ Cl- H2O
Ca2+ Mg2+ 、 Ba2+ BaSO4
Na+ Cl-H2O Mg2+ CO32-BaSO4 CaCO3
BaCO3
Na+ Cl- H2O CO32- OH- BaSO4
CaCO3
Mg(OH)2
BaCO3
①过量BaCl2溶液
Na+ Cl-H2O
②过量Na2CO3溶液
④ 过滤
③过量NaOH溶液
Na+ Cl- CO32-
OH-H2O
Na+ Cl-
⑥蒸发
PH试纸
红色物质都要去掉
依次加入氯化钡、氢氧化钠、碳酸钠。去除杂志——过滤——得到沉淀和滤液——加入稀盐酸溶液——蒸发结晶——得到纯净盐(氯化钠)
粗盐提纯
2、除去可溶性杂质(SO42- 、 Ca2+ 、Mg2+ )的方法
(1)加入过量的氯化钡(除去硫酸根离子)
(2)加入过量的碳酸钠(除去钡离子和钙离子)
(3)加入过量的氢氧化钠(除去镁离子)
(4)过滤(除去硫酸钡、碳酸钡、碳酸钙、氢氧化镁沉淀)
(5)向滤液中加入适量的稀盐酸(除去过量的碳酸钠和氢氧化钠)
(6)蒸发结晶
硫酸钡
碳酸钡和碳酸钙
氢氧化镁
粗盐提纯
精盐
粗盐
粗盐提纯
一.杂质:可溶、不可溶
二.实验室提纯
1)溶解
烧杯、玻璃棒
仪器:
2)过滤
操作要点:
一贴、二低、三靠
将粗盐水转移入过滤皿中,用烧杯承接滤液。
操作要点:
一贴、两低、三靠
一贴:滤纸紧贴漏斗内壁
二低:
滤纸边缘低于漏斗口
液面低于滤纸边缘
三靠:
烧杯紧靠玻璃棒下端
玻璃棒末端紧靠三层滤纸
漏斗的下端管口紧靠烧杯内壁
3)蒸发
将滤液转入蒸发皿中,加热并不断搅拌,当有大量固体出现时,停止加热。
粗盐提纯
1、除去不溶性杂质(如泥沙)的方法:
①溶解 ② 过滤 ③ 蒸发
溶解时玻璃棒的作用是
过滤时玻璃棒的作用是
蒸发时玻璃棒的作用是
加快溶解速率
引流(控制液体的流量和流向)
使液体受热均匀,防止液体飞溅
思考:
粗盐中的可溶性杂质主要是CaCl2
MgCl2 、Na2SO4等,如何除去
温馨提示:
首先要选试剂,若试剂不只一种,要考虑试剂的加入顺序。
提纯和分离遵循三个原则:
不增(不增加新杂质)、
不减(不减少主要成分)、
易分离(反应后物质状态不同,便于分离)
可溶性杂质的除法:
(1)原则:
除去杂质的同时不引入新的杂质
(2)方法:
加入化学试剂,让杂质离子转化成气体、沉淀或水除去
(3)步骤:
①溶解②加入试剂③过滤④蒸发
Ca2+ → 碳酸钠溶液
Mg2+ → 氢氧化钠溶液
SO42— → 氯化钡溶液
化学方法
Na2CO3 盐酸
BaCl2 NaOH
Na+ Cl-SO42- Ca2+ Mg2+
方案
1、BaCl2,NaOH,Na2CO3 过滤 盐酸
2、BaCl2 , Na2CO3, NaOH,过滤 , 盐酸
3、 NaOH , BaCl2 , Na2CO3, 过滤 ,盐酸
Na+ Cl-
H2O
SO42- Ca2+ Mg2+
⑤适量 HCI
Na+ Cl- H2O
Ca2+ Mg2+ 、 Ba2+ BaSO4
Na+ Cl-H2O Mg2+ CO32-BaSO4 CaCO3
BaCO3
Na+ Cl- H2O CO32- OH- BaSO4
CaCO3
Mg(OH)2
BaCO3
①过量BaCl2溶液
Na+ Cl-H2O
②过量Na2CO3溶液
④ 过滤
③过量NaOH溶液
Na+ Cl- CO32-
OH-H2O
Na+ Cl-
⑥蒸发
PH试纸
红色物质都要去掉
依次加入氯化钡、氢氧化钠、碳酸钠。去除杂志——过滤——得到沉淀和滤液——加入稀盐酸溶液——蒸发结晶——得到纯净盐(氯化钠)
粗盐提纯
2、除去可溶性杂质(SO42- 、 Ca2+ 、Mg2+ )的方法
(1)加入过量的氯化钡(除去硫酸根离子)
(2)加入过量的碳酸钠(除去钡离子和钙离子)
(3)加入过量的氢氧化钠(除去镁离子)
(4)过滤(除去硫酸钡、碳酸钡、碳酸钙、氢氧化镁沉淀)
(5)向滤液中加入适量的稀盐酸(除去过量的碳酸钠和氢氧化钠)
(6)蒸发结晶
硫酸钡
碳酸钡和碳酸钙
氢氧化镁
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
