人教版(五四制)九年级化学 第二单元 溶液 单元复习 课件(30张PPT)
文档属性
| 名称 | 人教版(五四制)九年级化学 第二单元 溶液 单元复习 课件(30张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-30 08:45:49 | ||
图片预览







文档简介
课件30张PPT。复习目标1、理解溶液的概念、特征及组成。
2、理解饱和溶液、不饱和溶液的概念,知道饱和溶液与不饱和溶液相互转化的条件。
3、理解溶解度的概念,认识溶解度曲线并会正确使用。定义:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物,叫做溶夜。均一性:指溶液任一部分的组成和性质相同
稳定性:在外界条件不变时,溶液稳定存在
混合物:凡是溶液都属于混合物溶液的宏观特征 :(1)均一性 (2)稳定性
(3) 混合物一、溶液的概念关于溶液的认识
(2)溶液一定是无色透明的吗?(3)均一、稳定的液体一定是溶液吗?(1)溶液的特征是什么?均一性、稳定性。不一定。如CuSO4溶液是蓝色的。不一定。如水就不是溶液、
酒精也不是溶液。问题与思考均一、透明、稳定的液体不一定是溶液,如水.溶液不一定是无色的:
硫酸铜溶液(蓝色)—— Cu2+
氯化铁溶液(黄色)——Fe3+
氯化亚铁、硫酸亚铁溶液(浅绿色)——Fe2+
高锰酸钾溶液(紫红色)—— MnO4-注意:A、均一、稳定的液体都是溶液
B、溶液是均一、稳定的纯净物
C、溶液是无色透明的液体
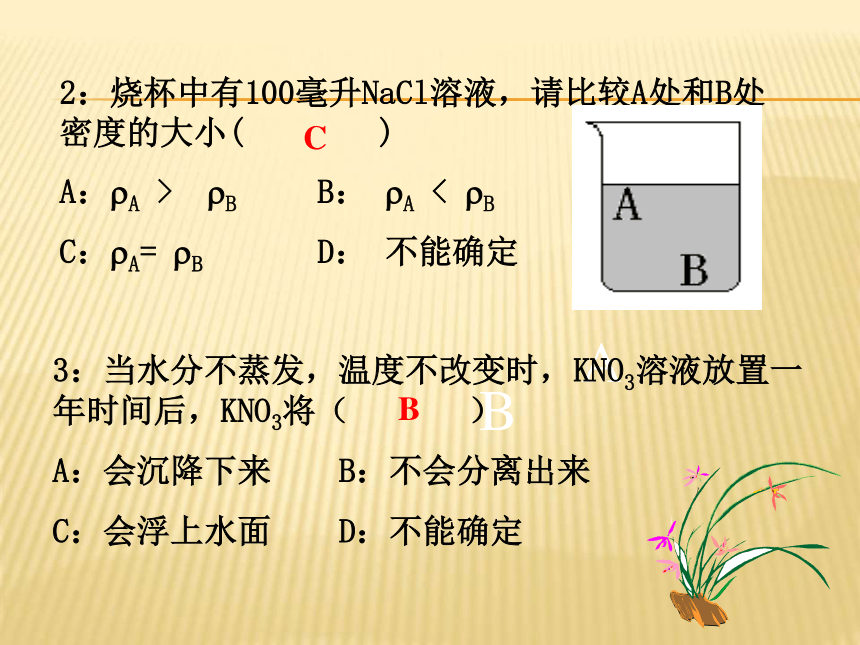
D、溶液是均一、稳定的混合物D练习2:烧杯中有100毫升NaCl溶液,请比较A处和B处密度的大小( )
A:?A > ?B B: ?A < ?B
C:?A= ?B D: 不能确定ABC3:当水分不蒸发,温度不改变时,KNO3溶液放置一年时间后,KNO3将( )
A:会沉降下来 B:不会分离出来
C:会浮上水面 D:不能确定B(1)溶剂:能溶解其它物质的物质
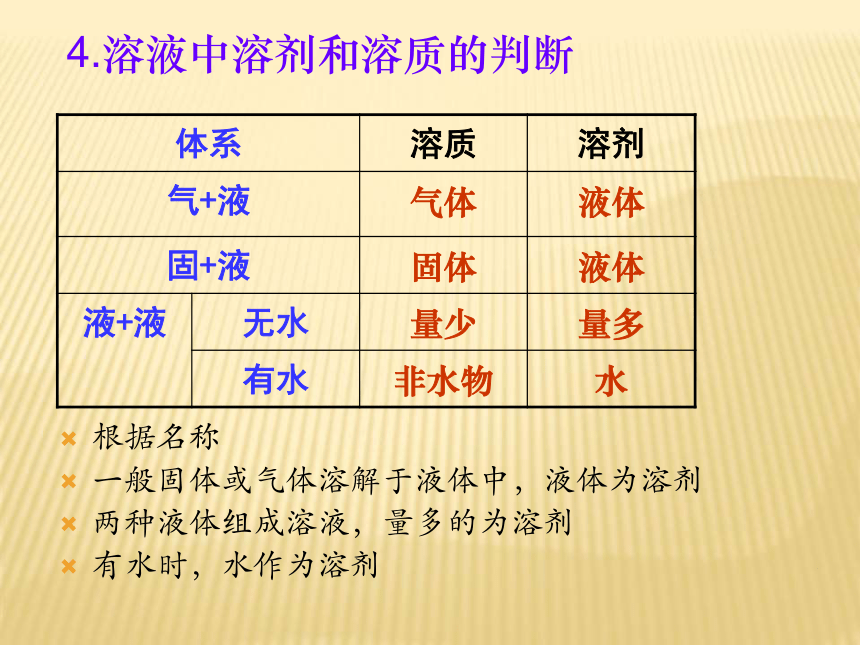
(2)溶质:能被其它物质溶解的物质2、溶液的组成:m溶液 = m溶剂+m溶质3、质量关系提问:是不是 V溶液== V溶质+ V溶剂?不是,因为分子间由间隔,所以,V溶液 < V溶质+ V溶剂根据名称
一般固体或气体溶解于液体中,液体为溶剂
两种液体组成溶液,量多的为溶剂
有水时,水作为溶剂4.溶液中溶剂和溶质的判断说明:
1。水是最常用的溶剂,最常见的溶液就是水溶液
2.汽油也可能做溶剂,它可以溶解油脂——用汽油洗油污.
3.酒精也可做溶剂,如溶解碘形成碘酒。 4。物质在溶解过程中发生了化学变化,在形成的溶液中,溶质是反应后的生成物,如:蓝矾(胆矾)溶于水时,形成的溶液中溶质是硫酸铜,而不是胆矾. )1、把下列物质混合,能得到溶液的是 ( )
A.冰加到水中 B.植物油加到水中
C.碘加入酒精中 D.面粉加到水中练一练:2、填下表:CCa(OH)2水酒精水汽油花生油硫酸锌水CaCl2水Zn+H2SO4=ZnSO4+H2↑CaCO3+2HCl=CaCl2+H2O+CO2↑3、可以作为溶质的( )
A、只有固体 B、只有液体
C、只有气体 D、气、液、固体都可以
4、把少量物质加入水中充分搅拌可以得到溶液的有( )
A、泥沙 B、酒精 C、汽油 D、蔗糖
5、下列各组物质中,前者是化合物,后
者是溶液的是( )
A 澄清石灰水、水 B 氧气、稀硫酸
C 空气、汽水 D 氯化氢气体、盐酸D二.乳浊液1.乳浊液: 分散到 里形成的 。
它 (是/不是)溶液。
2.乳化现象:洗涤剂有 功能,它能使植物油分散成无数 ,而不聚集成为 。这些细小的液滴能随着水流走,因此试管的内壁很干净。小液滴液体混合物不是乳化细小的液滴油珠3、特征:不均一、不稳定 、混合物 1.洗涤剂有什么功能? 它的去污原理是什么?洗涤剂有乳化功能;洗涤剂的去污原理是:将油污分散成无数小液滴,然后随水流走。(这种现象称为洗涤剂的乳化作用。)问题:2、修汽车的工人,当他的手上沾满油污时,他常用汽油洗去手上的油污.这说明汽油与洗涤剂一样能去油污,那么二者去油污的原理是否相同?若不同,汽油去油污的原理是什么?汽油去油污的原理是: 油污溶解在汽油中,形成溶液,从而除去油污.三、溶解时的吸热或放热现象探究:NaCl、NH4NO3、 NaOH 三种物质溶于水后溶液的温度改变.物质溶解过程中常常伴随着吸热或放热现象.NaCl温度基本不变NH4NO3温度降低(吸热)温度升高(放热)NaOH遇水放热的物质还有:生石灰CaO浓硫酸1.如右图向试管里的水中加入某种物质后,原来U型管内两臂在同一水平上的红墨水,右边液面降低了些,左边的液面上升了些,则加入的物质是
A、活性炭 B、生石灰
C、硝酸铵 D、氢氧化钠
C 2、右图所示,向小试管中加入一定量的下列物质,U形管液面右侧未发生改变,该物质是( )
U形管液面右侧升高,该物质是( )
U形管液面右侧降低,该物质是( )
A、浓硫酸 B、烧碱 C、生石灰
D、蔗糖 E、硝酸铵 F、氯化钠DFABCE(1)饱和溶液 不饱和溶液 四、溶解度1.概念
(1)饱和溶液和不饱和溶液 在一定温度下,在一定量溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液,还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液.
讲溶液饱和或不饱和,一定要指明温度和溶剂质量.
讲饱和溶液或不饱和溶液一定要强调溶质
强调知识回顾(2)、饱和溶液和不饱和溶液的相互转化关系 ?
一般规律:不饱和溶液 饱和溶液
升温、蒸发溶剂、加溶质
特殊溶质Ca(OH)2不饱和溶液 饱和溶液
降温、加溶剂
记准降温、蒸发溶剂、加溶质升温、加溶剂1.在某一瓶某溶质的饱和溶液中,加入一些该溶质的 晶体,则( )
A 晶体质量减少 B 溶液中溶质质量增大
C 晶体质量不变 D溶液质量增大
2、将40℃时的KCl饱和溶液降温至10℃,然后将析出的晶体过滤;再将滤液恢复到 40℃,则该溶液与原溶液相比 ( )
A.还是饱和溶液 B.溶质的质量分数不变
C 溶质的质量没变 D.溶剂的质量不变CD(2)影响固体溶解度的因素外因:温度内因:溶剂、溶质的性质注意:条件:一定温度。
标准:100克溶剂
状态:饱和状态
单位:克1.固体溶解度:
(1)定义:一定温度下,某固态物质在100克溶剂里
达到饱和状态时所溶解的质量。2、溶解度.....硝酸钾....硝酸钾在不同温度时的溶解度:13.331.620.945.863.985.51101381682022462、固体溶解度随温度变化的表示方法:(1)列表法:(2)溶解度曲线物质的溶解度受温度变化的曲线叫做溶解度曲线溶解度(克)温度(t)1601501401301201101009080706050403020102001901801701010090807060504030200硝酸铵硝酸钾硝酸钠氯化铵氯化钠硼酸固体溶解度曲线及意义点:曲线上的点均表示某物质在该温度下的溶解度。交点:曲线的交点表示这两种物质在该温度下的溶解度相同。曲线:曲线越陡,该物质的溶解度受温度影响越大。.a.b练习题 1、20℃时,A的溶解度是__________ 2、80℃ABC的溶解度大小顺序是____ 3、随着温度的升高,溶解度下降的物质是__________ 4、P点表示的意义是_____________P10gA B Cc在40℃时,A和B的溶解度相同5、把温度从70℃降低到20℃,有溶液变为不饱和的是__有晶体析出的是_,6、把温度从80℃降低到20℃,等质量的AB饱和溶液析出晶体的质量比较多的是__CA,BA7.B 物质属于___溶物,若A,B,C三种物质中有一种是气体,则是___。易C在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。2.气体溶解度影响气体溶解度的因素:气体溶解度一般随温度升高而减小,温度降低而增大。气体溶解度一般随压强增大而增大,压强减小而减小。 为什么要向鱼缸中通入空气? 为什么要把水喷向空中? 增加水与空气的接触面积,增加氧气溶解的量。1.下列几种物质①硝酸钾②熟石灰③氧气④二氧化碳 溶解度随温度的升高而增大的是( ) A.①② B.③④ C.①③④ D.只有①2. 增大二氧化碳在水中的溶解度的方法( )
A. 升温增压; B. 升温减压;
C. 降温增压; D. 降温减压。固体物质的溶解度1、定义(四要素)2、影响因素内因外因4、溶解度曲线(应用)3、溶解性与溶解度的关系知识回顾1.溶液气体的溶解度
2.乳浊液
3.溶液溶解时的吸热和放热
5.溶解度
2、理解饱和溶液、不饱和溶液的概念,知道饱和溶液与不饱和溶液相互转化的条件。
3、理解溶解度的概念,认识溶解度曲线并会正确使用。定义:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物,叫做溶夜。均一性:指溶液任一部分的组成和性质相同
稳定性:在外界条件不变时,溶液稳定存在
混合物:凡是溶液都属于混合物溶液的宏观特征 :(1)均一性 (2)稳定性
(3) 混合物一、溶液的概念关于溶液的认识
(2)溶液一定是无色透明的吗?(3)均一、稳定的液体一定是溶液吗?(1)溶液的特征是什么?均一性、稳定性。不一定。如CuSO4溶液是蓝色的。不一定。如水就不是溶液、
酒精也不是溶液。问题与思考均一、透明、稳定的液体不一定是溶液,如水.溶液不一定是无色的:
硫酸铜溶液(蓝色)—— Cu2+
氯化铁溶液(黄色)——Fe3+
氯化亚铁、硫酸亚铁溶液(浅绿色)——Fe2+
高锰酸钾溶液(紫红色)—— MnO4-注意:A、均一、稳定的液体都是溶液
B、溶液是均一、稳定的纯净物
C、溶液是无色透明的液体
D、溶液是均一、稳定的混合物D练习2:烧杯中有100毫升NaCl溶液,请比较A处和B处密度的大小( )
A:?A > ?B B: ?A < ?B
C:?A= ?B D: 不能确定ABC3:当水分不蒸发,温度不改变时,KNO3溶液放置一年时间后,KNO3将( )
A:会沉降下来 B:不会分离出来
C:会浮上水面 D:不能确定B(1)溶剂:能溶解其它物质的物质
(2)溶质:能被其它物质溶解的物质2、溶液的组成:m溶液 = m溶剂+m溶质3、质量关系提问:是不是 V溶液== V溶质+ V溶剂?不是,因为分子间由间隔,所以,V溶液 < V溶质+ V溶剂根据名称
一般固体或气体溶解于液体中,液体为溶剂
两种液体组成溶液,量多的为溶剂
有水时,水作为溶剂4.溶液中溶剂和溶质的判断说明:
1。水是最常用的溶剂,最常见的溶液就是水溶液
2.汽油也可能做溶剂,它可以溶解油脂——用汽油洗油污.
3.酒精也可做溶剂,如溶解碘形成碘酒。 4。物质在溶解过程中发生了化学变化,在形成的溶液中,溶质是反应后的生成物,如:蓝矾(胆矾)溶于水时,形成的溶液中溶质是硫酸铜,而不是胆矾. )1、把下列物质混合,能得到溶液的是 ( )
A.冰加到水中 B.植物油加到水中
C.碘加入酒精中 D.面粉加到水中练一练:2、填下表:CCa(OH)2水酒精水汽油花生油硫酸锌水CaCl2水Zn+H2SO4=ZnSO4+H2↑CaCO3+2HCl=CaCl2+H2O+CO2↑3、可以作为溶质的( )
A、只有固体 B、只有液体
C、只有气体 D、气、液、固体都可以
4、把少量物质加入水中充分搅拌可以得到溶液的有( )
A、泥沙 B、酒精 C、汽油 D、蔗糖
5、下列各组物质中,前者是化合物,后
者是溶液的是( )
A 澄清石灰水、水 B 氧气、稀硫酸
C 空气、汽水 D 氯化氢气体、盐酸D二.乳浊液1.乳浊液: 分散到 里形成的 。
它 (是/不是)溶液。
2.乳化现象:洗涤剂有 功能,它能使植物油分散成无数 ,而不聚集成为 。这些细小的液滴能随着水流走,因此试管的内壁很干净。小液滴液体混合物不是乳化细小的液滴油珠3、特征:不均一、不稳定 、混合物 1.洗涤剂有什么功能? 它的去污原理是什么?洗涤剂有乳化功能;洗涤剂的去污原理是:将油污分散成无数小液滴,然后随水流走。(这种现象称为洗涤剂的乳化作用。)问题:2、修汽车的工人,当他的手上沾满油污时,他常用汽油洗去手上的油污.这说明汽油与洗涤剂一样能去油污,那么二者去油污的原理是否相同?若不同,汽油去油污的原理是什么?汽油去油污的原理是: 油污溶解在汽油中,形成溶液,从而除去油污.三、溶解时的吸热或放热现象探究:NaCl、NH4NO3、 NaOH 三种物质溶于水后溶液的温度改变.物质溶解过程中常常伴随着吸热或放热现象.NaCl温度基本不变NH4NO3温度降低(吸热)温度升高(放热)NaOH遇水放热的物质还有:生石灰CaO浓硫酸1.如右图向试管里的水中加入某种物质后,原来U型管内两臂在同一水平上的红墨水,右边液面降低了些,左边的液面上升了些,则加入的物质是
A、活性炭 B、生石灰
C、硝酸铵 D、氢氧化钠
C 2、右图所示,向小试管中加入一定量的下列物质,U形管液面右侧未发生改变,该物质是( )
U形管液面右侧升高,该物质是( )
U形管液面右侧降低,该物质是( )
A、浓硫酸 B、烧碱 C、生石灰
D、蔗糖 E、硝酸铵 F、氯化钠DFABCE(1)饱和溶液 不饱和溶液 四、溶解度1.概念
(1)饱和溶液和不饱和溶液 在一定温度下,在一定量溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液,还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液.
讲溶液饱和或不饱和,一定要指明温度和溶剂质量.
讲饱和溶液或不饱和溶液一定要强调溶质
强调知识回顾(2)、饱和溶液和不饱和溶液的相互转化关系 ?
一般规律:不饱和溶液 饱和溶液
升温、蒸发溶剂、加溶质
特殊溶质Ca(OH)2不饱和溶液 饱和溶液
降温、加溶剂
记准降温、蒸发溶剂、加溶质升温、加溶剂1.在某一瓶某溶质的饱和溶液中,加入一些该溶质的 晶体,则( )
A 晶体质量减少 B 溶液中溶质质量增大
C 晶体质量不变 D溶液质量增大
2、将40℃时的KCl饱和溶液降温至10℃,然后将析出的晶体过滤;再将滤液恢复到 40℃,则该溶液与原溶液相比 ( )
A.还是饱和溶液 B.溶质的质量分数不变
C 溶质的质量没变 D.溶剂的质量不变CD(2)影响固体溶解度的因素外因:温度内因:溶剂、溶质的性质注意:条件:一定温度。
标准:100克溶剂
状态:饱和状态
单位:克1.固体溶解度:
(1)定义:一定温度下,某固态物质在100克溶剂里
达到饱和状态时所溶解的质量。2、溶解度.....硝酸钾....硝酸钾在不同温度时的溶解度:13.331.620.945.863.985.51101381682022462、固体溶解度随温度变化的表示方法:(1)列表法:(2)溶解度曲线物质的溶解度受温度变化的曲线叫做溶解度曲线溶解度(克)温度(t)1601501401301201101009080706050403020102001901801701010090807060504030200硝酸铵硝酸钾硝酸钠氯化铵氯化钠硼酸固体溶解度曲线及意义点:曲线上的点均表示某物质在该温度下的溶解度。交点:曲线的交点表示这两种物质在该温度下的溶解度相同。曲线:曲线越陡,该物质的溶解度受温度影响越大。.a.b练习题 1、20℃时,A的溶解度是__________ 2、80℃ABC的溶解度大小顺序是____ 3、随着温度的升高,溶解度下降的物质是__________ 4、P点表示的意义是_____________P10gA B Cc在40℃时,A和B的溶解度相同5、把温度从70℃降低到20℃,有溶液变为不饱和的是__有晶体析出的是_,6、把温度从80℃降低到20℃,等质量的AB饱和溶液析出晶体的质量比较多的是__CA,BA7.B 物质属于___溶物,若A,B,C三种物质中有一种是气体,则是___。易C在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。2.气体溶解度影响气体溶解度的因素:气体溶解度一般随温度升高而减小,温度降低而增大。气体溶解度一般随压强增大而增大,压强减小而减小。 为什么要向鱼缸中通入空气? 为什么要把水喷向空中? 增加水与空气的接触面积,增加氧气溶解的量。1.下列几种物质①硝酸钾②熟石灰③氧气④二氧化碳 溶解度随温度的升高而增大的是( ) A.①② B.③④ C.①③④ D.只有①2. 增大二氧化碳在水中的溶解度的方法( )
A. 升温增压; B. 升温减压;
C. 降温增压; D. 降温减压。固体物质的溶解度1、定义(四要素)2、影响因素内因外因4、溶解度曲线(应用)3、溶解性与溶解度的关系知识回顾1.溶液气体的溶解度
2.乳浊液
3.溶液溶解时的吸热和放热
5.溶解度
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
