人教版(五四制)九年级化学 3.3 实验活动3 酸、碱的化学性质 课件(31张ppt)
文档属性
| 名称 | 人教版(五四制)九年级化学 3.3 实验活动3 酸、碱的化学性质 课件(31张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 736.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-30 00:00:00 | ||
图片预览





文档简介
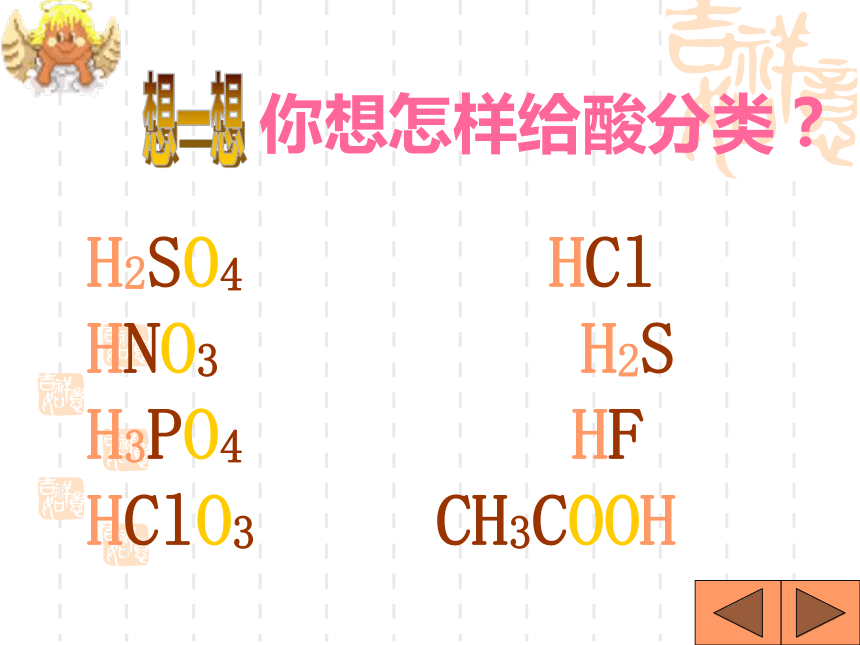
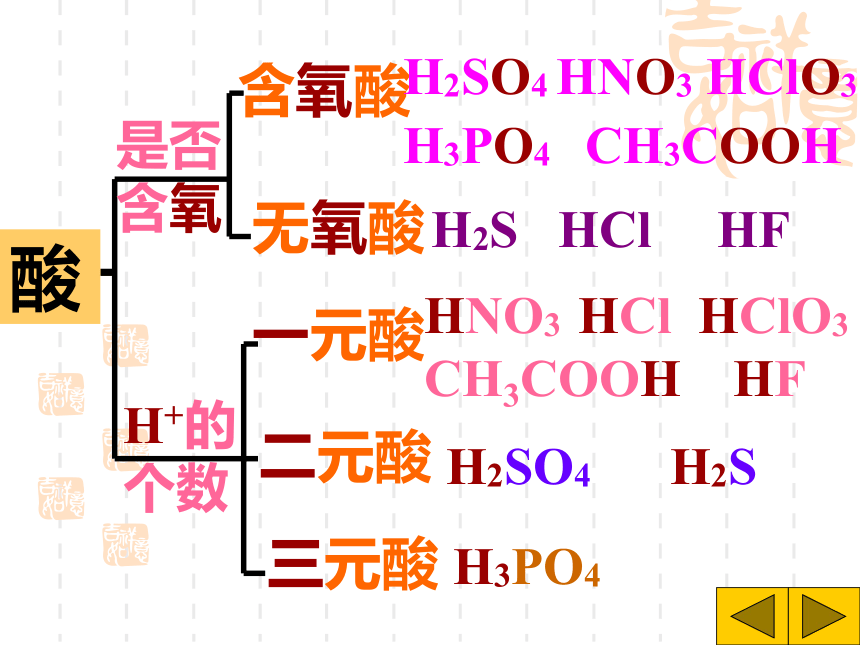
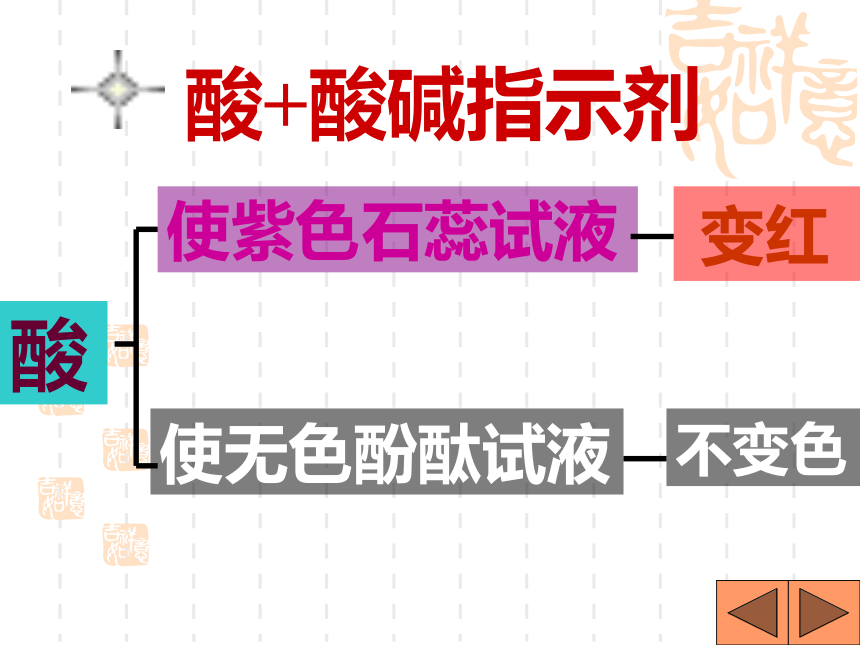
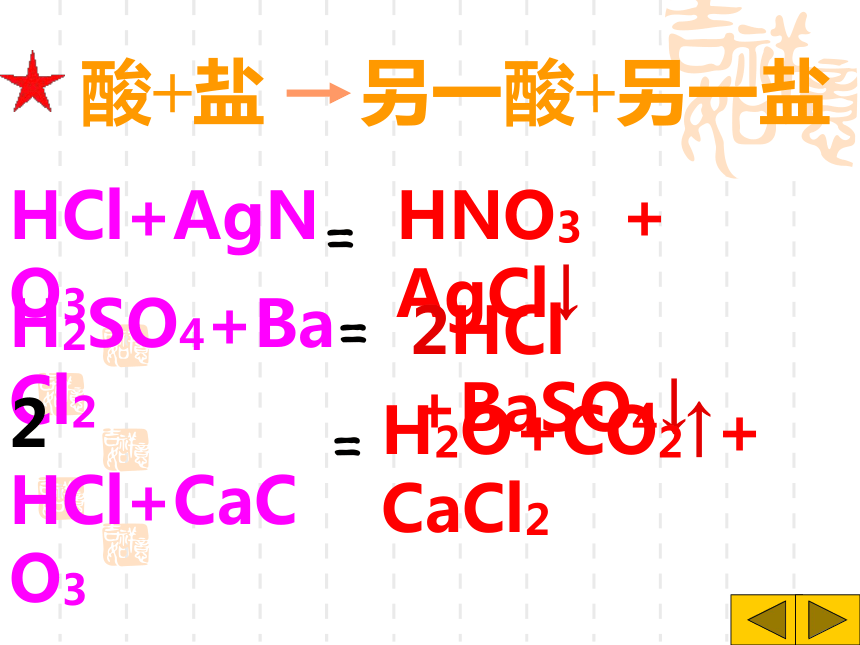
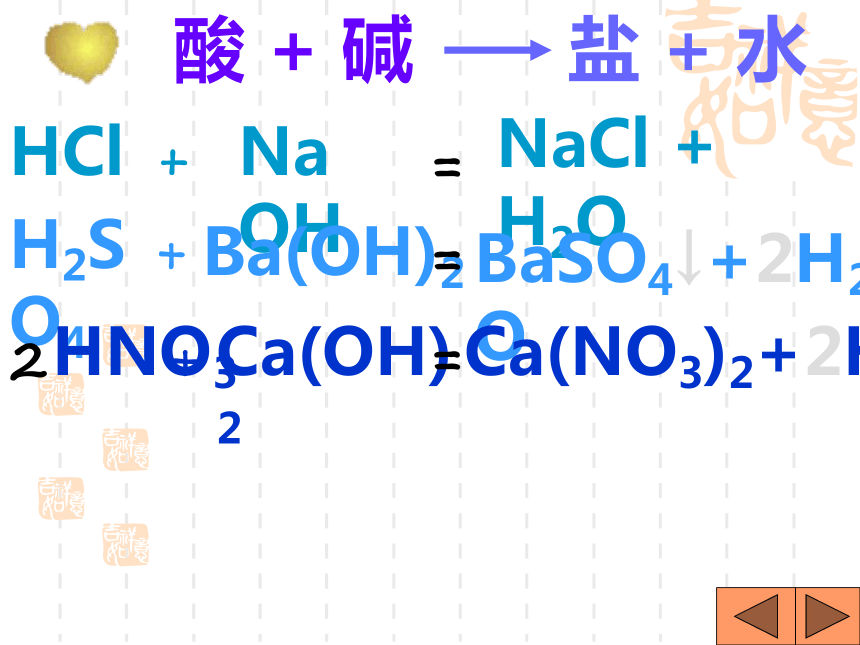
课件31张PPT。H2SO4 HCl HNO3 H2S H3PO4 HF HClO3 CH3COOH你想怎样给酸分类?想一想是否含氧含氧酸无氧酸H+的个数一元酸二元酸三元酸H2SO4 HNO3 HClO3 H3PO4 CH3COOH H2S HCl HFHNO3 HCl HClO3 CH3COOH HF H2SO4 H2S H3PO4酸你能试着读出这些酸的名称吗?H2SO4H2CO3H3PO4HClO3HNO3某 酸HClH2SHF氢某酸无氧酸含氧酸命名命名 酸+酸碱指示剂酸使紫色石蕊试液 变红使无色酚酞试液不变色注意:酸碱指示剂与酸或碱的溶液反应时,
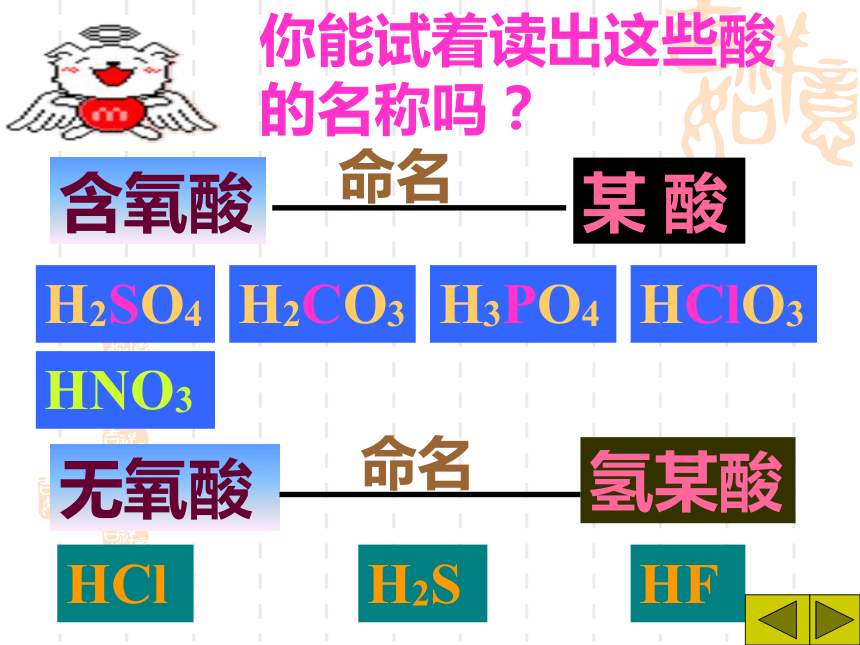
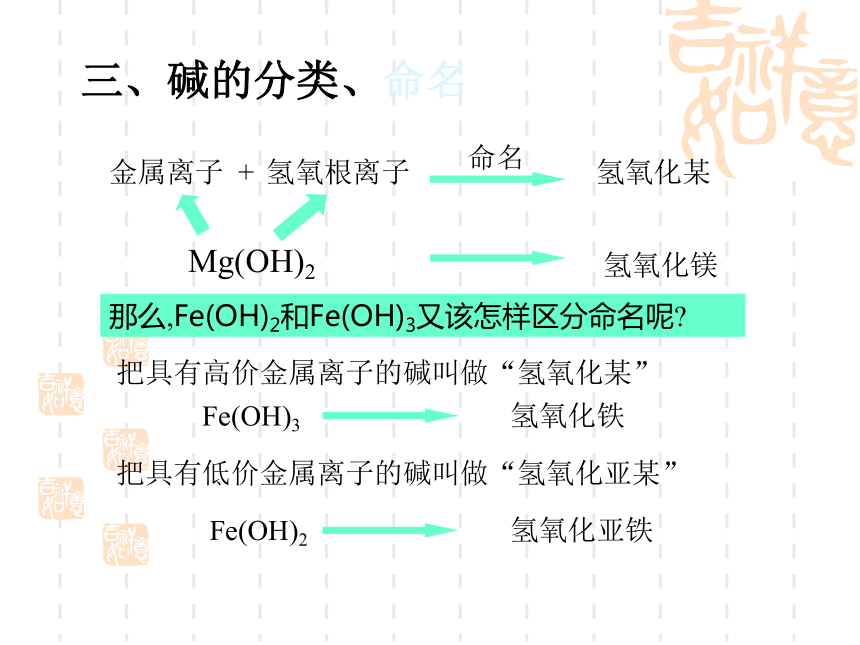
变色的是指示剂,而不是酸碱。酸+ 活泼金属盐+氢气[判断] 镁、锌、铁、 铜、银能否与酸反应酸+金属氧化物盐+水H2SO4+CuOHCl + MgO HCl+Fe2O3CuSO4+H2O MgCl2+H2O2FeCl3+ H2O623盐水酸氧化物酸+盐另一酸+另一盐HCl+AgNO3H2SO4+BaCl2 HCl+CaCO3HNO3 + AgCl↓2HCl +BaSO4↓ H2O+CO2↑+ CaCl22===酸 + 碱盐 + 水HClH2SO4HNO3NaOHBa(OH)2Ca(OH)2+++===NaCl + H2OBaSO4↓+2H2O2Ca(NO3)2+2H2O向放有锈铁钉的试管中加入过量盐酸,充分反应后,铁锈消失,并且有气泡放出,写出有关反应的化学方程式:Fe2O3+6HCl=2FeCl3+3H2OFe+2HCl=FeCl2+H2↑三、碱的分类、命名金属离子氢氧根离子Mg(OH)2+命名氢氧化某氢氧化镁那么,Fe(OH)2和Fe(OH)3又该怎样区分命名呢?把具有高价金属离子的碱叫做“氢氧化某”Fe(OH)3 氢氧化铁把具有低价金属离子的碱叫做“氢氧化亚某”Fe(OH)2 氢氧化亚铁一、氢氧化钠(NaOH)1、物理性质①白色固体;
②能吸收空气中的水分而潮解;
③易溶于水,溶解时放出大量的热;
④具有强烈的腐蚀性。在使用氢氧化钠时必须十分小心,防止皮肤、衣服被它腐蚀,更应防止溅到眼睛里。二、氢氧化钙(CaOH)1、物理性质氢氧化钙对皮肤、衣服等有腐蚀作用。归纳与小结2、化学性质 跟酸碱指示剂的反应
跟非金属氧化物的反应
跟酸的反应
跟某些盐的反应2、化学性质 跟酸碱指示剂的反应
跟非金属氧化物的反应
跟酸的反应
跟某些盐的反应2、化学性质 跟酸碱指示剂的反应
跟非金属氧化物的反应
跟酸的反应
跟某些盐的反应2、化学性质 跟酸碱指示剂的反应
跟非金属氧化物的反应
跟酸的反应
跟某些盐的反应(2)与某些非金属氧化物反应
碱溶液 + 非金属氧化物 → 盐 + 水
如:2NaOH + CO2 == Na2CO3 + H2O;
Ca(OH)2 + SO2 == CaSO3↓ + H2O; 三、常见的碱为什么氢氧化钠固体要密封保存?(3)与酸反应
碱 + 酸 → 盐 + 水
如:NaOH + HCl == NaCl + H2O;
Ca(OH)2 + H2SO4 == CaSO4 + 2H2O; 三、常见的碱1、在硫酸铜溶液中滴加氢氧化钠溶液。
2、在氯化铁溶液中滴加氢氧化钠溶液。
3、在碳酸钠溶液中滴加石灰水。
4、在硫酸铜溶液中滴加石灰水。探究四:CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaClNa2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOHCuSO4 + Ca(OH)2 = Cu(OH)2↓+ CaSO4(4)能与某些盐反应
碱溶液 + 盐溶液 → 新盐 + 新碱
CuSO4 +Ca(OH)2 =Cu(OH)2↓+ CaSO4;
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓ Ca(OH)2 + Na2CO3==2NaOH + CaCO3↓三、常见的碱思考:碱和盐的反应有什么用途?2、化学性质 石灰水使紫色石蕊试液变成蓝色,是无色酚酞试液变成红色。 与二氧化碳反应(用于检验CO2,或用 CO2检验 Ca(OH)2。)
Ca(OH)2+CO2= CaCO3↓+H2O 跟酸发生中和反应,在农业上常用来改良酸性土壤。 跟某些盐起反应。
Ca(OH)2+Na2CO3= CaCO3↓+2NaOH
可以用来制造氢氧化钠。四、碱的通性 能跟酸碱指示剂起反应,使石蕊变蓝,酚酞变红
能跟多数非金属氧化物起反应,生成盐和水
能跟酸起中和反应,生成盐和水
能跟某些盐起反应,生成另一种盐和另一种碱?为什么氯化钠在干燥时不导电,而溶于水后却能导电了呢?干燥的氯化钠晶体中没有能够自由移动的粒子?为什么氯化钠在干燥时不导电,而溶于水后却能导电了呢?氯化钠溶于水后,产生了自由移动的Na+和Cl-?为什么氯化钠在干燥时不导电,而溶于水后却能导电了呢? 在氯化钠溶液中接通直流电源后, Na+向阴极移动,Cl-向阳极移动,带电粒子的定向移动就形成了电流,因此氯化钠的水溶液能够导电。二、酸、碱、盐 盐酸、硝酸和硫酸都能够导电,说明在水溶液中解离生成了能够自由移动的离子。 HNO3 = H+ + NO3-HCl = H+ + Cl-H2SO4 = 2H+ + SO4-解离时生成的阳离子全部是氢离子的化合物叫做酸。全部 同样,氢氧化钠、氢氧化钾和氢氧化钡的溶液也能够导电,说明在水溶液中解离出能够自由移动的离子。KOH = K+ + OH-Ba(OH)2 = Ba2+ + 2 OH-NaOH = Na+ + OH-解离时生成的阴离子全部是氢氧根离子的化合物叫做碱。全部 同样,碳酸钠、硫酸钾和氯化钡的溶液也能够导电,说明在水溶液中解离出能够自由移动的离子。Na2CO3 = 2Na+ + CO3- BaCl2 = Ba+ + 2Cl-电离时生成金属离子和酸根离子的化合物叫做盐。 通过对酸、碱、盐电离出离子的特点,你判断一下NaHSO4、Cu2(OH)2CO3应该属于哪一类化合物?
变色的是指示剂,而不是酸碱。酸+ 活泼金属盐+氢气[判断] 镁、锌、铁、 铜、银能否与酸反应酸+金属氧化物盐+水H2SO4+CuOHCl + MgO HCl+Fe2O3CuSO4+H2O MgCl2+H2O2FeCl3+ H2O623盐水酸氧化物酸+盐另一酸+另一盐HCl+AgNO3H2SO4+BaCl2 HCl+CaCO3HNO3 + AgCl↓2HCl +BaSO4↓ H2O+CO2↑+ CaCl22===酸 + 碱盐 + 水HClH2SO4HNO3NaOHBa(OH)2Ca(OH)2+++===NaCl + H2OBaSO4↓+2H2O2Ca(NO3)2+2H2O向放有锈铁钉的试管中加入过量盐酸,充分反应后,铁锈消失,并且有气泡放出,写出有关反应的化学方程式:Fe2O3+6HCl=2FeCl3+3H2OFe+2HCl=FeCl2+H2↑三、碱的分类、命名金属离子氢氧根离子Mg(OH)2+命名氢氧化某氢氧化镁那么,Fe(OH)2和Fe(OH)3又该怎样区分命名呢?把具有高价金属离子的碱叫做“氢氧化某”Fe(OH)3 氢氧化铁把具有低价金属离子的碱叫做“氢氧化亚某”Fe(OH)2 氢氧化亚铁一、氢氧化钠(NaOH)1、物理性质①白色固体;
②能吸收空气中的水分而潮解;
③易溶于水,溶解时放出大量的热;
④具有强烈的腐蚀性。在使用氢氧化钠时必须十分小心,防止皮肤、衣服被它腐蚀,更应防止溅到眼睛里。二、氢氧化钙(CaOH)1、物理性质氢氧化钙对皮肤、衣服等有腐蚀作用。归纳与小结2、化学性质 跟酸碱指示剂的反应
跟非金属氧化物的反应
跟酸的反应
跟某些盐的反应2、化学性质 跟酸碱指示剂的反应
跟非金属氧化物的反应
跟酸的反应
跟某些盐的反应2、化学性质 跟酸碱指示剂的反应
跟非金属氧化物的反应
跟酸的反应
跟某些盐的反应2、化学性质 跟酸碱指示剂的反应
跟非金属氧化物的反应
跟酸的反应
跟某些盐的反应(2)与某些非金属氧化物反应
碱溶液 + 非金属氧化物 → 盐 + 水
如:2NaOH + CO2 == Na2CO3 + H2O;
Ca(OH)2 + SO2 == CaSO3↓ + H2O; 三、常见的碱为什么氢氧化钠固体要密封保存?(3)与酸反应
碱 + 酸 → 盐 + 水
如:NaOH + HCl == NaCl + H2O;
Ca(OH)2 + H2SO4 == CaSO4 + 2H2O; 三、常见的碱1、在硫酸铜溶液中滴加氢氧化钠溶液。
2、在氯化铁溶液中滴加氢氧化钠溶液。
3、在碳酸钠溶液中滴加石灰水。
4、在硫酸铜溶液中滴加石灰水。探究四:CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaClNa2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOHCuSO4 + Ca(OH)2 = Cu(OH)2↓+ CaSO4(4)能与某些盐反应
碱溶液 + 盐溶液 → 新盐 + 新碱
CuSO4 +Ca(OH)2 =Cu(OH)2↓+ CaSO4;
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓ Ca(OH)2 + Na2CO3==2NaOH + CaCO3↓三、常见的碱思考:碱和盐的反应有什么用途?2、化学性质 石灰水使紫色石蕊试液变成蓝色,是无色酚酞试液变成红色。 与二氧化碳反应(用于检验CO2,或用 CO2检验 Ca(OH)2。)
Ca(OH)2+CO2= CaCO3↓+H2O 跟酸发生中和反应,在农业上常用来改良酸性土壤。 跟某些盐起反应。
Ca(OH)2+Na2CO3= CaCO3↓+2NaOH
可以用来制造氢氧化钠。四、碱的通性 能跟酸碱指示剂起反应,使石蕊变蓝,酚酞变红
能跟多数非金属氧化物起反应,生成盐和水
能跟酸起中和反应,生成盐和水
能跟某些盐起反应,生成另一种盐和另一种碱?为什么氯化钠在干燥时不导电,而溶于水后却能导电了呢?干燥的氯化钠晶体中没有能够自由移动的粒子?为什么氯化钠在干燥时不导电,而溶于水后却能导电了呢?氯化钠溶于水后,产生了自由移动的Na+和Cl-?为什么氯化钠在干燥时不导电,而溶于水后却能导电了呢? 在氯化钠溶液中接通直流电源后, Na+向阴极移动,Cl-向阳极移动,带电粒子的定向移动就形成了电流,因此氯化钠的水溶液能够导电。二、酸、碱、盐 盐酸、硝酸和硫酸都能够导电,说明在水溶液中解离生成了能够自由移动的离子。 HNO3 = H+ + NO3-HCl = H+ + Cl-H2SO4 = 2H+ + SO4-解离时生成的阳离子全部是氢离子的化合物叫做酸。全部 同样,氢氧化钠、氢氧化钾和氢氧化钡的溶液也能够导电,说明在水溶液中解离出能够自由移动的离子。KOH = K+ + OH-Ba(OH)2 = Ba2+ + 2 OH-NaOH = Na+ + OH-解离时生成的阴离子全部是氢氧根离子的化合物叫做碱。全部 同样,碳酸钠、硫酸钾和氯化钡的溶液也能够导电,说明在水溶液中解离出能够自由移动的离子。Na2CO3 = 2Na+ + CO3- BaCl2 = Ba+ + 2Cl-电离时生成金属离子和酸根离子的化合物叫做盐。 通过对酸、碱、盐电离出离子的特点,你判断一下NaHSO4、Cu2(OH)2CO3应该属于哪一类化合物?
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
