人教版(五四制)九年级化学第三单元 酸和碱单元复习 课件(19张ppt)
文档属性
| 名称 | 人教版(五四制)九年级化学第三单元 酸和碱单元复习 课件(19张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 826.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-30 00:00:00 | ||
图片预览





文档简介
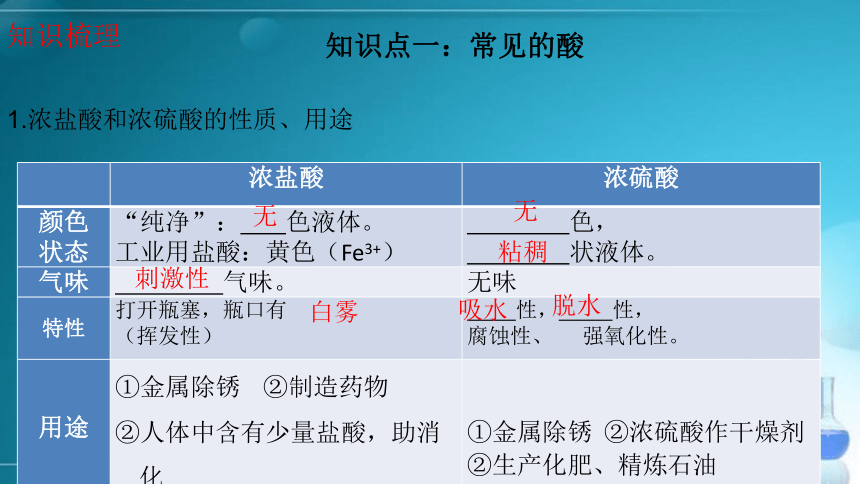
课件19张PPT。 酸和碱的专题复习 知识点一:常见的酸1.浓盐酸和浓硫酸的性质、用途
知识梳理无刺激性白雾无粘稠吸水脱水2.稀盐酸和稀硫酸的化学性质 HCl: H+ 、Cl-
H2SO4: H+ 、SO42-
CH3COOH: H+、CH3COO-白醋里的醋酸有酸的共性吗?小组探究实验醋酸有酸的共性吗?
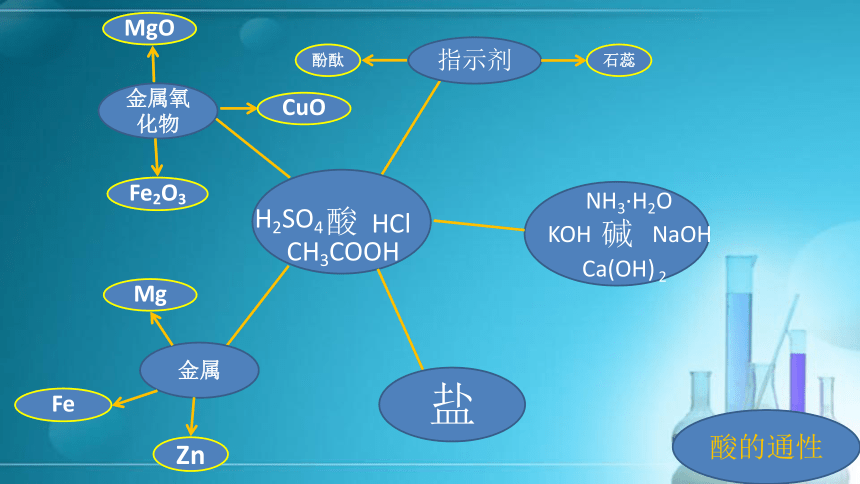
提供的药品:白醋、紫色石蕊、镁条、氧化铜、碳酸钠石蕊酚酞金属氧化物Fe2O3MgOCuO金属ZnMgFe盐酸的通性酸的通性 1、酸溶液与酸碱指示剂的作用:
2、与金属的反应:
3、与金属氧化物的反应:
4、与碱的反应:
5、与某些盐的反应:
酸+金属→盐+氢气酸+金属氧化物→盐+水酸+碱→盐+水酸+盐→新酸+新盐1.氢氧化钠和氢氧化钙的性质、用途知识梳理知识点二:常见的碱白色易火碱烧碱苛性钠白色微熟石灰消石灰石蕊酚酞盐非金属氧化物CO2SO2碱的通性碱的通性(可溶性碱) 1、与酸碱指示剂的作用:
2、与非金属氧化物的反应:
3、与酸的中和反应:
4、与某些盐的反应:碱+非金属氧化物→盐+水碱+酸→盐+水碱+盐→新碱+新盐思考?氨水有碱的通性吗?
提供药品:氨水、氯化铁、稀盐酸、酚酞试剂题一:通过实验,我们测得了石灰水、碳酸饮料、食醋及食盐水的pH,下图中箭头方向表示pH逐渐增大,则表示石灰水的是_______,表示食盐水的是_______。(填字母) 知识点三:溶液的酸碱性与酸碱度
酸碱性
检验方法:
?
酸碱度
1.表示方法:
2.测定方法:
→题二:同学们用Na2CO3溶液和浓HCl来研究简易灭火器的反应原理时,对废液的成分进行探究。
【推理假设】上述两种物质发生反应的化学方程式为_________________ ,由此推测出废液中一定有NaCl,可能有Na2CO3或盐酸。
【实验探究】㈠确定废液中是否含有盐酸
⑴选择试剂: 根据盐酸的化学性质,同学们选用了如图所示的五种物质,其中物质x是酸碱指示剂中的_________溶液。
Na2CO3+2 HCl=2 NaCl+H2O+CO2 ↑石蕊⑵实验验证: 某同学向废液中加入少量的镁粉,观察到___________,
确定废液中一定没有盐酸。
㈡确定废液中是否含有Na2CO3
某同学选用________测出废液的pH=l0,确定废液中一定含有Na2CO3。
㈢处理废液,回收利用
欲从废液中得到纯净的NaCl,请完成如下实验方案设计。
无气泡pH试纸Na2CO3+ Ca(NO3)2= CaCO3 ↓+ 2NaNO3盐酸题三:小政同学在复习Ca(OH)2化学性质时,归纳出了Ca(OH)2与其它物质间相互反应的关系如图所示(图中“——”表示相连的两种物质能发生反应)。
(1)若X是与其它三种不同类别的化合物,则X可以是__________。
(2)根据图示的物质间关系,写出其中两个化学方程式:
①______________________;②__________________________。CO2Ca(OH)2+Na2CO3=CaCO3↓+2NaOHCa(OH)2+2HCl=CaCl2+2H2O 知识点四:中和反应1、定义:
2:实质:
3:用途:酸+碱=盐+水H++OH-=H2O(家庭作业)题四:酸与碱之间发生中和反应,其实质是酸溶液中大量自由移动的H+和碱溶液中大量自由移动的OH- 结合成水分子的过程。请根据以下氢氧化钠溶液与稀盐酸反应的实验,
回答问题。
【实验1】用酚酞试液作指示剂
(1)向一锥形瓶中倾倒20 g质量分数为4.00%的氢氧化钠溶液,滴入3滴酚酞试液,振荡,再逐滴滴入质量分数为3.65%的稀盐酸,边滴边振荡,直至溶液刚好变为______色为止,共用去稀盐酸20 g,则反应后溶液中溶质质量分数为______(结果精确到0.1%)。反应后溶液中的溶质可用__________的方法(填一操作名称)使其析出。
(2)为什么要加酚酞?
无色2.9%蒸发HCl+NaOH=NaCl+H2O学习提醒 1. “结构——性质”
同类物质具有相似的结构,因此具有相似的化学性质; 不同类物质具有不同的结构,因此具有不同的化学性质; 同类的不同物质结构上也存在差异,它们的化学性质上也会存在差异。
2. “性质——用途”
物质的用途是由该物质的性质决定的,不同的物质因具有不同的性质,因而具有不同的用途。
谢谢!
知识梳理无刺激性白雾无粘稠吸水脱水2.稀盐酸和稀硫酸的化学性质 HCl: H+ 、Cl-
H2SO4: H+ 、SO42-
CH3COOH: H+、CH3COO-白醋里的醋酸有酸的共性吗?小组探究实验醋酸有酸的共性吗?
提供的药品:白醋、紫色石蕊、镁条、氧化铜、碳酸钠石蕊酚酞金属氧化物Fe2O3MgOCuO金属ZnMgFe盐酸的通性酸的通性 1、酸溶液与酸碱指示剂的作用:
2、与金属的反应:
3、与金属氧化物的反应:
4、与碱的反应:
5、与某些盐的反应:
酸+金属→盐+氢气酸+金属氧化物→盐+水酸+碱→盐+水酸+盐→新酸+新盐1.氢氧化钠和氢氧化钙的性质、用途知识梳理知识点二:常见的碱白色易火碱烧碱苛性钠白色微熟石灰消石灰石蕊酚酞盐非金属氧化物CO2SO2碱的通性碱的通性(可溶性碱) 1、与酸碱指示剂的作用:
2、与非金属氧化物的反应:
3、与酸的中和反应:
4、与某些盐的反应:碱+非金属氧化物→盐+水碱+酸→盐+水碱+盐→新碱+新盐思考?氨水有碱的通性吗?
提供药品:氨水、氯化铁、稀盐酸、酚酞试剂题一:通过实验,我们测得了石灰水、碳酸饮料、食醋及食盐水的pH,下图中箭头方向表示pH逐渐增大,则表示石灰水的是_______,表示食盐水的是_______。(填字母) 知识点三:溶液的酸碱性与酸碱度
酸碱性
检验方法:
?
酸碱度
1.表示方法:
2.测定方法:
→题二:同学们用Na2CO3溶液和浓HCl来研究简易灭火器的反应原理时,对废液的成分进行探究。
【推理假设】上述两种物质发生反应的化学方程式为_________________ ,由此推测出废液中一定有NaCl,可能有Na2CO3或盐酸。
【实验探究】㈠确定废液中是否含有盐酸
⑴选择试剂: 根据盐酸的化学性质,同学们选用了如图所示的五种物质,其中物质x是酸碱指示剂中的_________溶液。
Na2CO3+2 HCl=2 NaCl+H2O+CO2 ↑石蕊⑵实验验证: 某同学向废液中加入少量的镁粉,观察到___________,
确定废液中一定没有盐酸。
㈡确定废液中是否含有Na2CO3
某同学选用________测出废液的pH=l0,确定废液中一定含有Na2CO3。
㈢处理废液,回收利用
欲从废液中得到纯净的NaCl,请完成如下实验方案设计。
无气泡pH试纸Na2CO3+ Ca(NO3)2= CaCO3 ↓+ 2NaNO3盐酸题三:小政同学在复习Ca(OH)2化学性质时,归纳出了Ca(OH)2与其它物质间相互反应的关系如图所示(图中“——”表示相连的两种物质能发生反应)。
(1)若X是与其它三种不同类别的化合物,则X可以是__________。
(2)根据图示的物质间关系,写出其中两个化学方程式:
①______________________;②__________________________。CO2Ca(OH)2+Na2CO3=CaCO3↓+2NaOHCa(OH)2+2HCl=CaCl2+2H2O 知识点四:中和反应1、定义:
2:实质:
3:用途:酸+碱=盐+水H++OH-=H2O(家庭作业)题四:酸与碱之间发生中和反应,其实质是酸溶液中大量自由移动的H+和碱溶液中大量自由移动的OH- 结合成水分子的过程。请根据以下氢氧化钠溶液与稀盐酸反应的实验,
回答问题。
【实验1】用酚酞试液作指示剂
(1)向一锥形瓶中倾倒20 g质量分数为4.00%的氢氧化钠溶液,滴入3滴酚酞试液,振荡,再逐滴滴入质量分数为3.65%的稀盐酸,边滴边振荡,直至溶液刚好变为______色为止,共用去稀盐酸20 g,则反应后溶液中溶质质量分数为______(结果精确到0.1%)。反应后溶液中的溶质可用__________的方法(填一操作名称)使其析出。
(2)为什么要加酚酞?
无色2.9%蒸发HCl+NaOH=NaCl+H2O学习提醒 1. “结构——性质”
同类物质具有相似的结构,因此具有相似的化学性质; 不同类物质具有不同的结构,因此具有不同的化学性质; 同类的不同物质结构上也存在差异,它们的化学性质上也会存在差异。
2. “性质——用途”
物质的用途是由该物质的性质决定的,不同的物质因具有不同的性质,因而具有不同的用途。
谢谢!
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
