人教版(五四制)九年级化学第一单元 金属和金属材料 单元复习 课件(26张PPT)
文档属性
| 名称 | 人教版(五四制)九年级化学第一单元 金属和金属材料 单元复习 课件(26张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-06-30 15:18:57 | ||
图片预览







文档简介
课件26张PPT。 金属和金属的性质中考考点要求:1.了解金属的物理特性;认识常见金属的主要化学性质。
2.知道生铁和钢等金属的重要合金认识金属材料在生产、生活和社会发展中的重要作用。
3.知道常见金属与氧气的反应。
4.熟练掌握金属的化学性质,尤其掌握金属活动顺序表,会利用金属活动顺序表熟练解决实际问题。
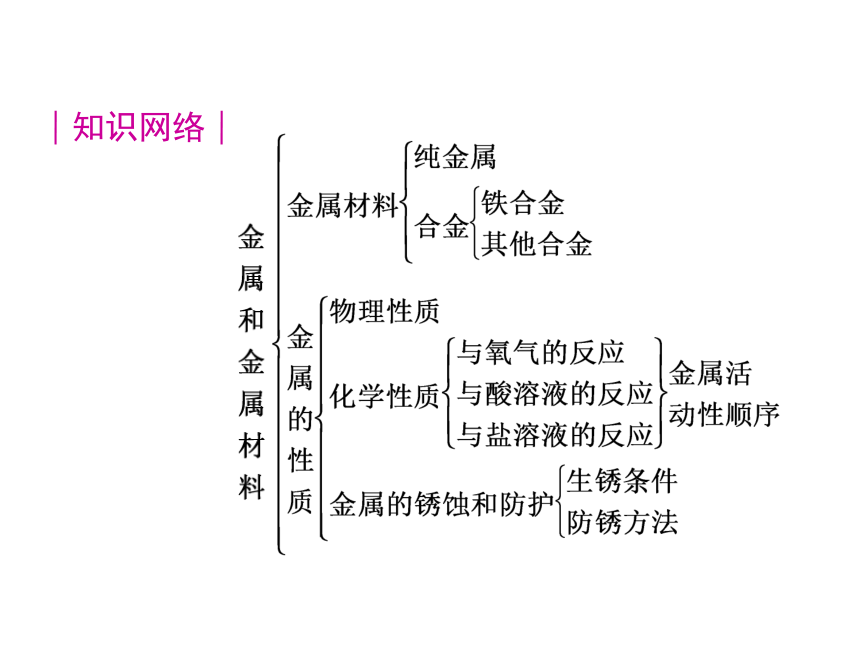
5.了解常见金属的特性及其应用,知道生铁和钢等金属的重要合金。知识网络│考点聚焦│考点 1 金属材料 1.金属材料包括________和______。
2.合金是在金属中加热熔合某些____________(或________)形成的具有________的物质。硬度一般比各成分金属______,熔点一般比各成分金属______,所以比纯金属具有更广泛的用途。
生铁、钢都是铁的合金,其主要成分是铁,不同点是含碳量不同。生铁的含碳量为2%~4.3%,钢的含碳量为0.03%~2%。纯金属 合金金属 非金属 金属特性
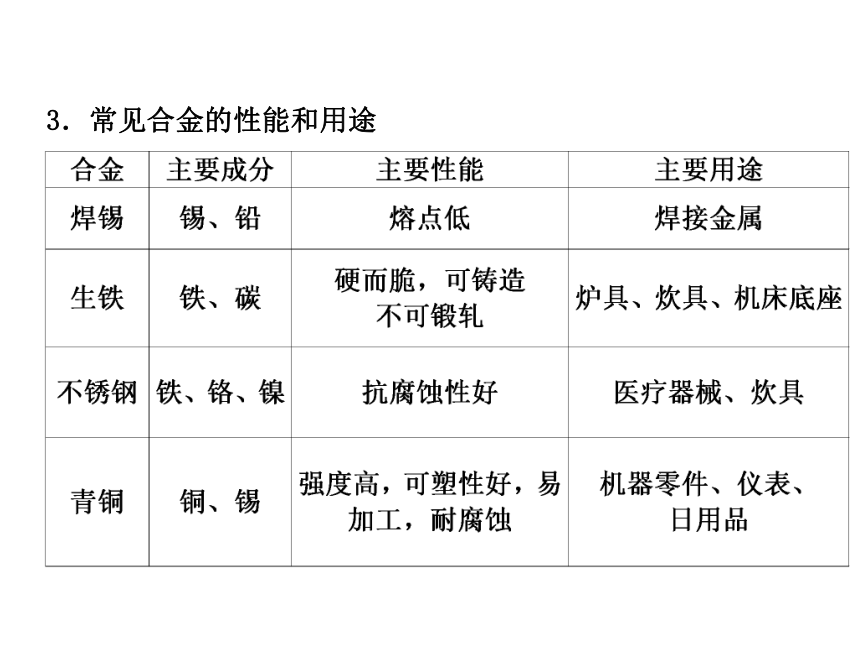
大 低3.常见合金的性能和用途考点 2 金属的性质 1.金属的物理性质
有光泽,常温下为____态;不同金属的密度、熔点、硬度不同。有良好的______性、______性和______性。
[注意]几种金属的特殊物理性质:
①多数金属常温下为固态,汞为液态。
②多数金属呈银白色(铁在粉末时呈黑色),铜呈紫红色,金为黄色,锌呈灰白色。
③铁能被磁铁吸引,其他金属一般不能。固 导电
导热 延展 ④金属的性质决定用途,用途体现金属的性质。要从不同金属的性质以及价格、资源、美观、便利、回收等各方面考虑,实际应用要更加注意性价比。如,银的导电性比铝的导电性大很多,但电线一般用铝制而不用银制,因为铝的密度(2.7)比银的密度(10.5)小,价格比银低很多,资源比银丰富得多。
2.金属的化学性质
(1)与氧气反应
①钾、钙、钠、镁、铝、锌在______下与空气中的氧气反应(铝、锌形成致密的氧化膜),铝与氧气反应的化学方程式为:______________________________。
②铁、铜在______________下能与氧气反应,其反应的化学方程式分别为______________________________、
________________________________________________。
[注意]在纯氧中,铁能剧烈燃烧,生成黑色的四氧化三铁,而在潮湿的空气中,铁则易发生缓慢氧化生成红色的氧化铁,是铁锈的主要成分。常温 点燃或加热 (2)与酸反应
条件:金属(H之前) 酸(盐酸、稀硫酸)
写出下列反应的化学方程式
铁和盐酸反应____________________________________;
铝和稀硫酸反应___________________________________。
[注意]①铁与稀盐酸或稀硫酸发生置换反应时,一般只能生成亚铁离子(Fe2+),溶液的颜色是浅绿色。
②实验室里利用较活泼金属与稀硫酸(或稀盐酸)反应来获得氢气。归类示例? 类型一 金属的用途命题角度:根据物质的性质决定物质的用途来考查学生对
物质性质的理解。 例1 请根据下表信息回答:铁的硬度比铝大 (2)表中导电性最强的金属是__________;
(3)①中形成薄膜的化学方程式是___________________;
(4)金属的冶炼体现了人类文明的发展水平。之所以有先后,主要取决于__________________。 [解析] 由表格信息可知:由于铁的硬度比铝大,所以菜刀要用铁做;导电性的指数越高,导电性也就越强,所以铜的导电性最强;常温下越容易与氧气反应,也表现出其金属活动性越强。 [方法点拨] 物质的性质决定物质的用途,解题时先要充分阅读所给信息,和已有知识相结合,做到有效知识迁移,可以解决此类题目。Cu金属的活动性B? 类型二 合金的性质命题角度:一般围绕合金具有质轻、强度高、耐腐蚀性等
方面来考查。例2 下列关于合金的说法正确的是 ( )
A.合金不属于金属材料
B.合金的硬度一般比各成分金属大
C.合金属于金属单质
D.多数合金的熔点高于组成它的成分金属B看谁反应快? [解析] 金属材料包括纯金属和合金,合金是在金属中加热熔合某些金属或非金属形成的具有金属特性的物质,属于混合物。合金的熔点一般比各成分金属低。 [方法点拨] 在日常生活中,大量使用的常常不是纯金属,而是合金。合金具有质轻、强度高、耐腐蚀等性质。 变式题 鞍钢集团全力支持上海世博会,为上海虹桥交通枢纽建设提供了4.7万吨精品钢材。下列关于钢的说法错误的是 ( )
A.钢是一种铁合金
B.钢的许多性能优于生铁
C.钢的含碳量高于生铁
D.钢是一种混合物 C? 类型三 金属活动性顺序的判断命题角度:根据金属与酸或盐溶液反应的现象判断金属的
活动性顺序。 例3 X、Y、Z是金属活动性顺序表里的三种金属,它们在溶液中能发生如下反应:
则三种金属的活动性满足 ( )
A.X>Y>Z B.Z>Y>X C.Y>Z>X D.X>Z>Y A [解析] 在金属活动性顺序中,位于前面的金属能把后面的金属从其盐溶液中置换出来,位于氢前的金属能和酸反应置换出酸中的氢。由①可知金属活动性X>Y,由②可知Y>Z,由③可知X>H,由④可知H>Z。 [方法点拨] 判断金属活动性可以根据金属与酸反应或金属与盐溶液反应的性质来进行。能与酸溶液反应的金属,证明其性质活泼,排在H之前,反之,排在氢之后。某金属能与另一种金属的盐溶液反应,证明其活动性大于盐溶液中金属的活动性,反之小于其活动性。例4、将等质量的甲、乙两金属分别与足量的稀硫酸反应,产生氢气的质量与反应时间的关系如右图。关于甲、乙两金属判断合理的是( )
A.铁、镁 B.锌、镁 C.锌、铁 D.铁、锌[方法点拨] 根据金属活动性顺序可以判断出金属与酸反应剧烈程度(即时间的长短),氢气质量可以根据相对原子质量大小来判断。C 变式题 向氯化铜溶液加入一定量的锌粉充分反应,下列情况中可能出现的是 ( )
①溶液中有 Zn2+、Cu2+,不溶物为Cu
②溶液中有 Zn2+、Cu2+,不溶物为 Zn
③溶液只有 Zn2+,不溶物为 Zn
④溶液只有 Zn2+,不溶物为 Zn、Cu
A.①③ B.②③
C.①④ D.③④C能力拓展根据下图中化合物与单质的相互转化关系,按要求写出适当的化学式。⑴若乙的溶液是浅绿色, Y是红色固体, 则是 ;
⑵若乙的溶液为浅绿色, Y 是无色气体, 则X是 ;
⑶在常温下若甲是固体,乙是无色液体 ,则X是 ;C uH2H2问题1:问题2:29
、
(
6
分)金属在生产和生活中具有广泛的应用。
(
1
)下列金属制品的用途中,利用金属导热性的是
(填字母序号)
。
(
2
)
人类每年从自然界提取大量的金属,
其中提取量最大的是铁。
赤铁矿
(
主要成分为
Fe
2
O
3
)
和一氧化碳炼铁的化学方程式为
。
(
3
)铁制品容易锈蚀,铁生锈的条件是
。
(
4
)
某工厂废液中含有氯化钠、
氯化铜和氯化亚铁。
某课外小组利用废液制取海绵铜
(
Cu
)
和氧化铁两种产品,过程如下图所示(过程中不引入其他元素)
。
请回答下列问题:
①溶液
D
中的溶质为
;
②检验
C
过量的方法是
;
③
A~G
七种物质中含铁元素的物质有
(
填字母序号
)
。
29
、
(
6
分)金属在生产和生活中具有广泛的应用。
(
1
)下列金属制品的用途中,利用金属导热性的是
(填字母序号)
。
(
2
)
人类每年从自然界提取大量的金属,
其中提取量最大的是铁。
赤铁矿
(
主要成分为
Fe
2
O
3
)
和一氧化碳炼铁的化学方程式为
。
(
3
)铁制品容易锈蚀,铁生锈的条件是
。
(
4
)
某工厂废液中含有氯化钠、
氯化铜和氯化亚铁。
某课外小组利用废液制取海绵铜
(
Cu
)
和氧化铁两种产品,过程如下图所示(过程中不引入其他元素)
。
请回答下列问题:
①溶液
D
中的溶质为
;
②检验
C
过量的方法是
;
③
A~G
七种物质中含铁元素的物质有
(
填字母序号
)
。
金属在生产和生活中具有广泛的应用。
(1)下列金属制品的用途中,利用金属导热性的是( )。
(2)人类每年从自然界提取大量的金属,其中提取量最大的是铁。赤铁矿(主要成分为Fe2O3)和
一氧化碳炼铁的化学方程式为 。
(3)铁制品容易锈蚀,铁生锈的条件是为 。
(4)某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组利用废液制取海绵铜(Cu)和氧化铁两种产品,过程如下图所示(过程中不引入其他元素)。
请回答下列问题:
①溶液D中的溶质为 ;
②检验C过量的方法是 ;
③A~G七种物质中含铁元素的物质有(填字母序号) 。
AFe2O3+3CO=Fe+CO2高温水、氧气NaCl、FeCl2取少量溶液E于试管中,加入Fe等,有气泡冒出则C过量A、B、D、E、G在Zn(NO3)2、AgNO3、Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,洗涤后得到滤渣A和滤液B。
⑴若向滤渣A中加入稀盐酸有气泡产生,则滤渣A中一定含 ;滤液B中含有的溶质是 。
⑵若向滤液B中加入稀盐酸有白色沉淀产生,则滤渣A中一定含 ;滤液B中含有的溶质是 。Fe、Cu、AgZn(NO3)2、Fe(NO3)2 AgZn(NO3)2、Fe(NO3)2、Ag(NO3)2 、Cu (NO3)2问题3:谢谢指导!
2.知道生铁和钢等金属的重要合金认识金属材料在生产、生活和社会发展中的重要作用。
3.知道常见金属与氧气的反应。
4.熟练掌握金属的化学性质,尤其掌握金属活动顺序表,会利用金属活动顺序表熟练解决实际问题。
5.了解常见金属的特性及其应用,知道生铁和钢等金属的重要合金。知识网络│考点聚焦│考点 1 金属材料 1.金属材料包括________和______。
2.合金是在金属中加热熔合某些____________(或________)形成的具有________的物质。硬度一般比各成分金属______,熔点一般比各成分金属______,所以比纯金属具有更广泛的用途。
生铁、钢都是铁的合金,其主要成分是铁,不同点是含碳量不同。生铁的含碳量为2%~4.3%,钢的含碳量为0.03%~2%。纯金属 合金金属 非金属 金属特性
大 低3.常见合金的性能和用途考点 2 金属的性质 1.金属的物理性质
有光泽,常温下为____态;不同金属的密度、熔点、硬度不同。有良好的______性、______性和______性。
[注意]几种金属的特殊物理性质:
①多数金属常温下为固态,汞为液态。
②多数金属呈银白色(铁在粉末时呈黑色),铜呈紫红色,金为黄色,锌呈灰白色。
③铁能被磁铁吸引,其他金属一般不能。固 导电
导热 延展 ④金属的性质决定用途,用途体现金属的性质。要从不同金属的性质以及价格、资源、美观、便利、回收等各方面考虑,实际应用要更加注意性价比。如,银的导电性比铝的导电性大很多,但电线一般用铝制而不用银制,因为铝的密度(2.7)比银的密度(10.5)小,价格比银低很多,资源比银丰富得多。
2.金属的化学性质
(1)与氧气反应
①钾、钙、钠、镁、铝、锌在______下与空气中的氧气反应(铝、锌形成致密的氧化膜),铝与氧气反应的化学方程式为:______________________________。
②铁、铜在______________下能与氧气反应,其反应的化学方程式分别为______________________________、
________________________________________________。
[注意]在纯氧中,铁能剧烈燃烧,生成黑色的四氧化三铁,而在潮湿的空气中,铁则易发生缓慢氧化生成红色的氧化铁,是铁锈的主要成分。常温 点燃或加热 (2)与酸反应
条件:金属(H之前) 酸(盐酸、稀硫酸)
写出下列反应的化学方程式
铁和盐酸反应____________________________________;
铝和稀硫酸反应___________________________________。
[注意]①铁与稀盐酸或稀硫酸发生置换反应时,一般只能生成亚铁离子(Fe2+),溶液的颜色是浅绿色。
②实验室里利用较活泼金属与稀硫酸(或稀盐酸)反应来获得氢气。归类示例? 类型一 金属的用途命题角度:根据物质的性质决定物质的用途来考查学生对
物质性质的理解。 例1 请根据下表信息回答:铁的硬度比铝大 (2)表中导电性最强的金属是__________;
(3)①中形成薄膜的化学方程式是___________________;
(4)金属的冶炼体现了人类文明的发展水平。之所以有先后,主要取决于__________________。 [解析] 由表格信息可知:由于铁的硬度比铝大,所以菜刀要用铁做;导电性的指数越高,导电性也就越强,所以铜的导电性最强;常温下越容易与氧气反应,也表现出其金属活动性越强。 [方法点拨] 物质的性质决定物质的用途,解题时先要充分阅读所给信息,和已有知识相结合,做到有效知识迁移,可以解决此类题目。Cu金属的活动性B? 类型二 合金的性质命题角度:一般围绕合金具有质轻、强度高、耐腐蚀性等
方面来考查。例2 下列关于合金的说法正确的是 ( )
A.合金不属于金属材料
B.合金的硬度一般比各成分金属大
C.合金属于金属单质
D.多数合金的熔点高于组成它的成分金属B看谁反应快? [解析] 金属材料包括纯金属和合金,合金是在金属中加热熔合某些金属或非金属形成的具有金属特性的物质,属于混合物。合金的熔点一般比各成分金属低。 [方法点拨] 在日常生活中,大量使用的常常不是纯金属,而是合金。合金具有质轻、强度高、耐腐蚀等性质。 变式题 鞍钢集团全力支持上海世博会,为上海虹桥交通枢纽建设提供了4.7万吨精品钢材。下列关于钢的说法错误的是 ( )
A.钢是一种铁合金
B.钢的许多性能优于生铁
C.钢的含碳量高于生铁
D.钢是一种混合物 C? 类型三 金属活动性顺序的判断命题角度:根据金属与酸或盐溶液反应的现象判断金属的
活动性顺序。 例3 X、Y、Z是金属活动性顺序表里的三种金属,它们在溶液中能发生如下反应:
则三种金属的活动性满足 ( )
A.X>Y>Z B.Z>Y>X C.Y>Z>X D.X>Z>Y A [解析] 在金属活动性顺序中,位于前面的金属能把后面的金属从其盐溶液中置换出来,位于氢前的金属能和酸反应置换出酸中的氢。由①可知金属活动性X>Y,由②可知Y>Z,由③可知X>H,由④可知H>Z。 [方法点拨] 判断金属活动性可以根据金属与酸反应或金属与盐溶液反应的性质来进行。能与酸溶液反应的金属,证明其性质活泼,排在H之前,反之,排在氢之后。某金属能与另一种金属的盐溶液反应,证明其活动性大于盐溶液中金属的活动性,反之小于其活动性。例4、将等质量的甲、乙两金属分别与足量的稀硫酸反应,产生氢气的质量与反应时间的关系如右图。关于甲、乙两金属判断合理的是( )
A.铁、镁 B.锌、镁 C.锌、铁 D.铁、锌[方法点拨] 根据金属活动性顺序可以判断出金属与酸反应剧烈程度(即时间的长短),氢气质量可以根据相对原子质量大小来判断。C 变式题 向氯化铜溶液加入一定量的锌粉充分反应,下列情况中可能出现的是 ( )
①溶液中有 Zn2+、Cu2+,不溶物为Cu
②溶液中有 Zn2+、Cu2+,不溶物为 Zn
③溶液只有 Zn2+,不溶物为 Zn
④溶液只有 Zn2+,不溶物为 Zn、Cu
A.①③ B.②③
C.①④ D.③④C能力拓展根据下图中化合物与单质的相互转化关系,按要求写出适当的化学式。⑴若乙的溶液是浅绿色, Y是红色固体, 则是 ;
⑵若乙的溶液为浅绿色, Y 是无色气体, 则X是 ;
⑶在常温下若甲是固体,乙是无色液体 ,则X是 ;C uH2H2问题1:问题2:29
、
(
6
分)金属在生产和生活中具有广泛的应用。
(
1
)下列金属制品的用途中,利用金属导热性的是
(填字母序号)
。
(
2
)
人类每年从自然界提取大量的金属,
其中提取量最大的是铁。
赤铁矿
(
主要成分为
Fe
2
O
3
)
和一氧化碳炼铁的化学方程式为
。
(
3
)铁制品容易锈蚀,铁生锈的条件是
。
(
4
)
某工厂废液中含有氯化钠、
氯化铜和氯化亚铁。
某课外小组利用废液制取海绵铜
(
Cu
)
和氧化铁两种产品,过程如下图所示(过程中不引入其他元素)
。
请回答下列问题:
①溶液
D
中的溶质为
;
②检验
C
过量的方法是
;
③
A~G
七种物质中含铁元素的物质有
(
填字母序号
)
。
29
、
(
6
分)金属在生产和生活中具有广泛的应用。
(
1
)下列金属制品的用途中,利用金属导热性的是
(填字母序号)
。
(
2
)
人类每年从自然界提取大量的金属,
其中提取量最大的是铁。
赤铁矿
(
主要成分为
Fe
2
O
3
)
和一氧化碳炼铁的化学方程式为
。
(
3
)铁制品容易锈蚀,铁生锈的条件是
。
(
4
)
某工厂废液中含有氯化钠、
氯化铜和氯化亚铁。
某课外小组利用废液制取海绵铜
(
Cu
)
和氧化铁两种产品,过程如下图所示(过程中不引入其他元素)
。
请回答下列问题:
①溶液
D
中的溶质为
;
②检验
C
过量的方法是
;
③
A~G
七种物质中含铁元素的物质有
(
填字母序号
)
。
金属在生产和生活中具有广泛的应用。
(1)下列金属制品的用途中,利用金属导热性的是( )。
(2)人类每年从自然界提取大量的金属,其中提取量最大的是铁。赤铁矿(主要成分为Fe2O3)和
一氧化碳炼铁的化学方程式为 。
(3)铁制品容易锈蚀,铁生锈的条件是为 。
(4)某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组利用废液制取海绵铜(Cu)和氧化铁两种产品,过程如下图所示(过程中不引入其他元素)。
请回答下列问题:
①溶液D中的溶质为 ;
②检验C过量的方法是 ;
③A~G七种物质中含铁元素的物质有(填字母序号) 。
AFe2O3+3CO=Fe+CO2高温水、氧气NaCl、FeCl2取少量溶液E于试管中,加入Fe等,有气泡冒出则C过量A、B、D、E、G在Zn(NO3)2、AgNO3、Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,洗涤后得到滤渣A和滤液B。
⑴若向滤渣A中加入稀盐酸有气泡产生,则滤渣A中一定含 ;滤液B中含有的溶质是 。
⑵若向滤液B中加入稀盐酸有白色沉淀产生,则滤渣A中一定含 ;滤液B中含有的溶质是 。Fe、Cu、AgZn(NO3)2、Fe(NO3)2 AgZn(NO3)2、Fe(NO3)2、Ag(NO3)2 、Cu (NO3)2问题3:谢谢指导!
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
