鲁科版 化学 选修3 第一章复习课 原子结构(共21张ppt)
文档属性
| 名称 | 鲁科版 化学 选修3 第一章复习课 原子结构(共21张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 518.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-01 18:20:20 | ||
图片预览




文档简介
课件21张PPT。选修三《物质结构与性质》
第一章 原子结构 复习课
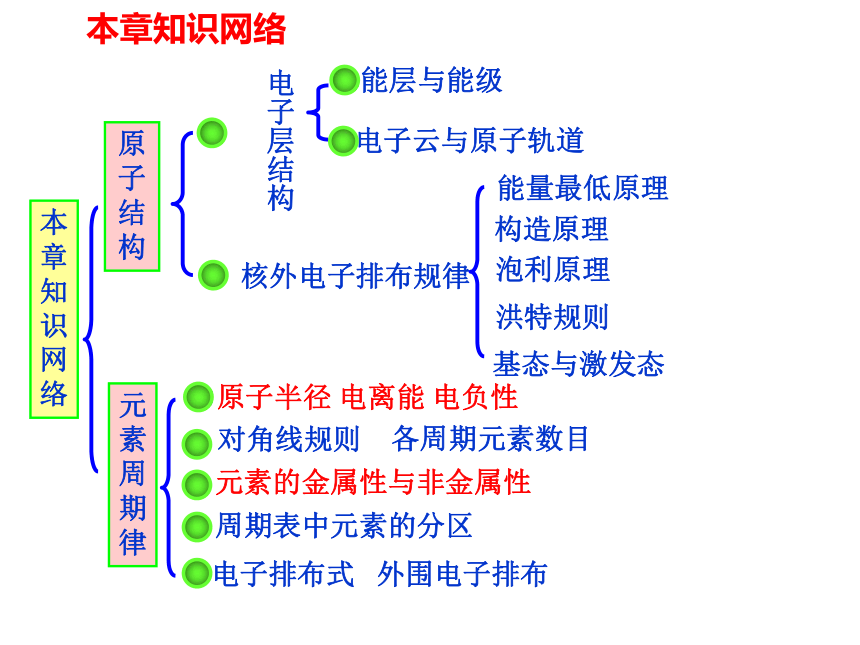
本章知识网络原子结构元素周期律电子层结构能层与能级电子云与原子轨道核外电子排布规律原子半径 电离能 电负性对角线规则各周期元素数目周期表中元素的分区电子排布式 外围电子排布能量最低原理泡利原理洪特规则构造原理基态与激发态本章知识网络元素的金属性与非金属性教学目标了解电离能的概念,认识主族元素电离能的变化规律,知道电离能与元素化合价的关系(重点)
了解电负性的概念,知道主族元素电负性与元素性质的关系,认识主族元素电负性的变化规律(重点)
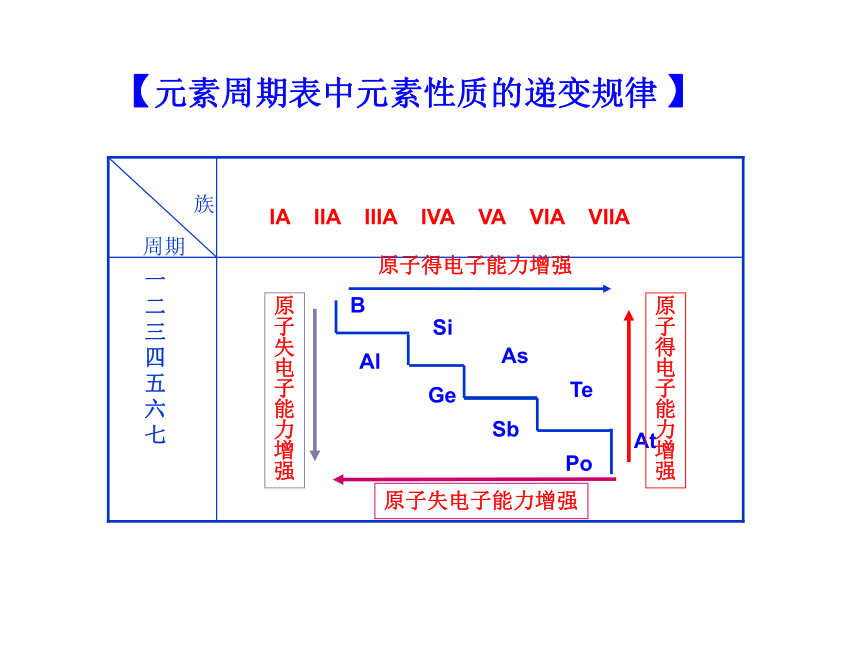
体会原子结构与元素周期律的本质联系(难点)【知识回顾】元素周期律的内容?元素周期律的本质?内容:元素周期律是指元素的性质随着原子序数的递增而呈周期性变化的规律本质:元素性质的周期性变化是原子核外电子排布周期性变化的必然结果族周期IA IIA IIIA IVA VA VIA VIIA原子得电子能力增强原
子
得
电
子
能
力
增
强原子失电子能力增强原
子
失
电
子
能
力
增
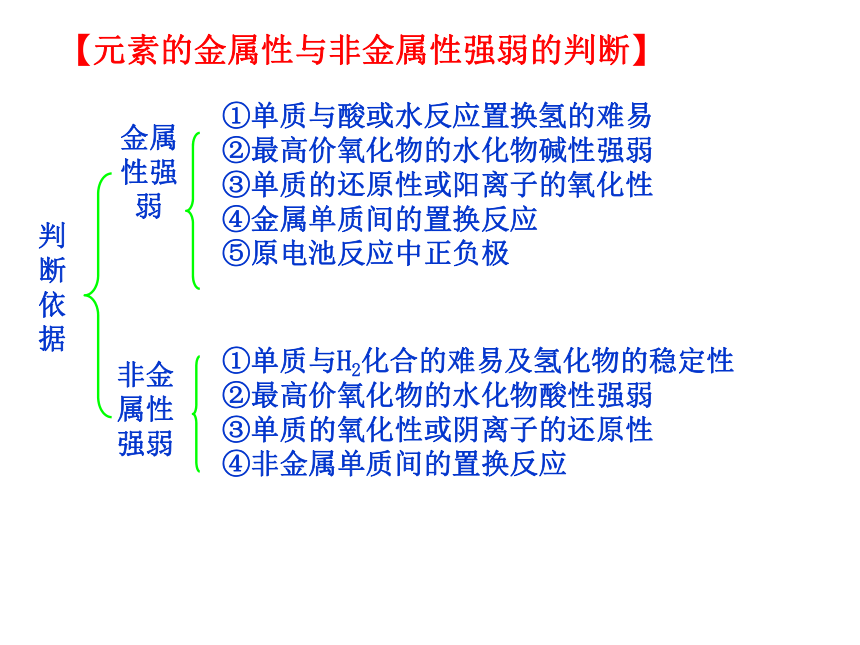
强【元素周期表中元素性质的递变规律 】金属性强弱非金属性强弱①单质与酸或水反应置换氢的难易
②最高价氧化物的水化物碱性强弱
③单质的还原性或阳离子的氧化性
④金属单质间的置换反应
⑤原电池反应中正负极①单质与H2化合的难易及氢化物的稳定性
②最高价氧化物的水化物酸性强弱
③单质的氧化性或阴离子的还原性
④非金属单质间的置换反应判断依据【元素的金属性与非金属性强弱的判断】【基础梳理】一、电离能及其变化规律气态原子或气态离子失去一个电子所需要的
最小能量叫做电离能。IM(g)= M+ (g) + e- I1(第一电离能)4.意义:M+(g)= M2+ (g) + e- I2(第二电离能)M2+(g)= M3+ (g) + e- I3(第三电离能)KJ/mol2.符号:单位:3.表示式:1.定义: 表示原子或离子失去电子的难易程度
电离能越小,气态时该原子越容易失去电子;
电离能越大,气态时该原子越难失去电子。
同种元素:I1﹤I2﹤I3﹤I4﹤……
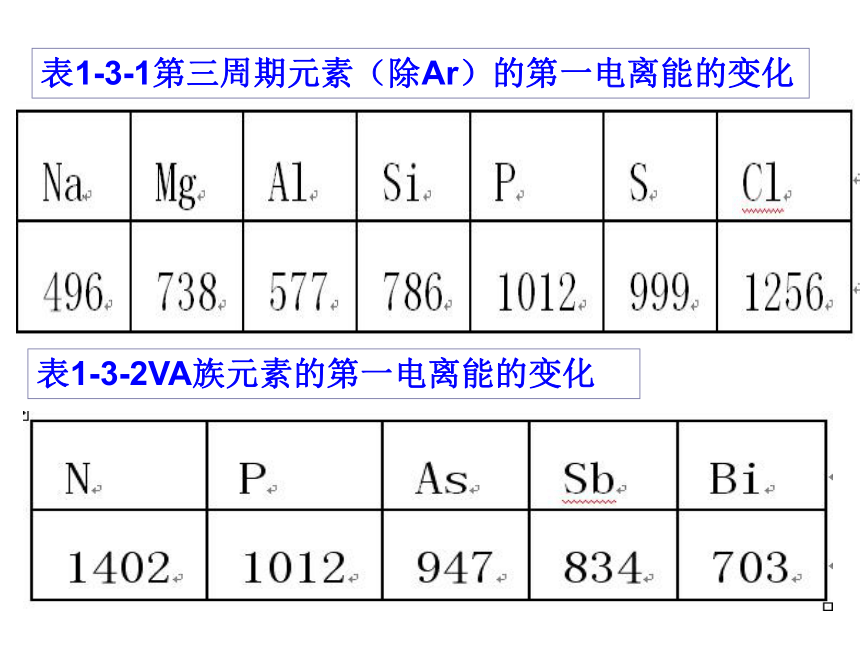
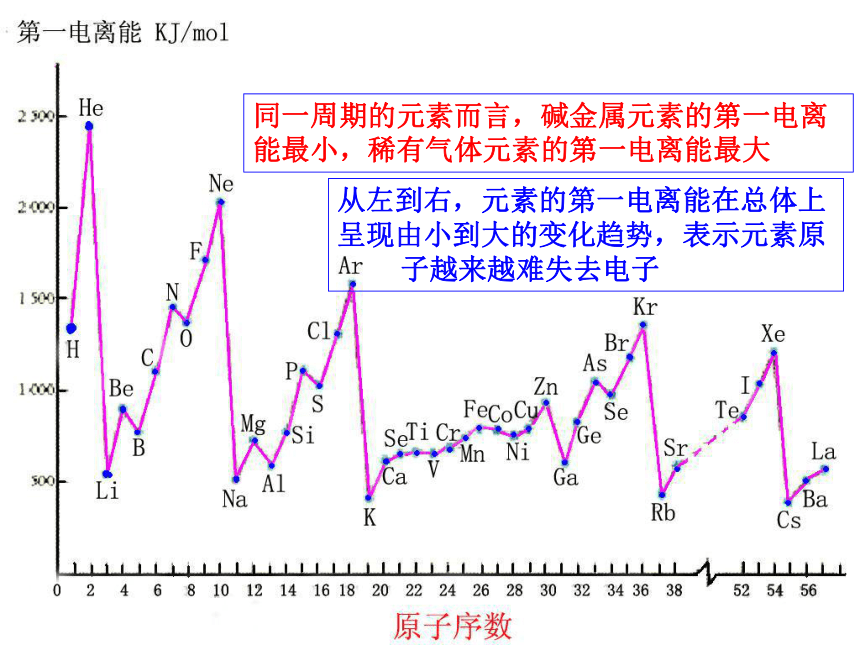
表1-3-1第三周期元素(除Ar)的第一电离能的变化表1-3-2VA族元素的第一电离能的变化同一周期的元素而言,碱金属元素的第一电离能最小,稀有气体元素的第一电离能最大从左到右,元素的第一电离能在总体上呈现由小到大的变化趋势,表示元素原 子越来越难失去电子5、元素第一电离能的变化规律:1)同周期:
a、从左到右呈现递增趋势(最小的是碱金属,最大的是稀有气体的元素);2)同主族的元素自上而下第一电离能逐渐减少。
(第ⅡA元素和第ⅤA元素的反常现象如何解释?)b、第ⅡA元素>ⅢA的元素;第ⅤA元素>ⅥA元素 ⅡA全充满电子结构 ⅤA半充满电子结构 原因:随着核电荷数的增加和原子半径的减小,核对外层电子的有效吸引作 用依次增强。
原因:同主族元素原子的价电子数相同,原 子半径逐渐增大,原子核对核外电子的有效吸引作用逐渐减弱
实质分析第一电离能的周期性递变规律是原子半径、核外电子排布周期性变化的结果1.下列说法正确的是( )
A.第3周期所含的元素中钠的第一电离能最小
B.铝的第一电离能比镁的第一电离能大
C.在所有元素中,氟的第一电离能最大.
D.钾的第一电离能比镁的第一电离能大.A反常现象:第ⅡA元素>ⅢA的元素最大的是稀有气体的元素:He从左到右呈现递增趋势(最小的是碱金属)K<Na<Mg【对点训练】 电负性是元素的原子在化合物中 的 能力的标度。
元素的电负性越大,表示其原子在化合物中吸引电子的能力越强。
元素的电负性越小,表示其原子在化合物中吸引电子的能力越弱。1、电负性的概念:吸引电子二、电负性及其变化规律增 大减小 原因?2、电负性的递变规律:1)同周期从左到右,元素电负性增大2)同主族自上而下,元素电负性减小3)金属元素的电负性小,非金属元素电负性大原因:同周期元素原子从左至右,电子层数相同,核电荷数增大,原子半径递减,有效核电荷数递增,对外层电子的吸引能力逐渐增强,因而电负性递增。
原因:同主族元素原子从上到下,虽然核电荷数也增多,但电子层数增多引起原子半径增大比较明显,原子核对外层电子的吸引能力逐渐减弱,元素的电负性递减Be(OH)2+2H+=Be2++2H2O,Be(OH)2+2OH-=BeO22-+2H2O0.93~1.57 金属性越强,电负性越小;非金属性越强,电负性越大 Al元素和Cl元素的电负性差值为1.55<1.7,所以形成共价键,
为共价化合物。将氯化铝加热到熔融态,进行导电性实验,
如果不导电,说明是共价化合物
原子结构的周期性变化元素性质的周期性变化表现形式元素周期表小结:相同递增减小增多相同增大+1→+7 -4→-1 主族序数主族增强减弱增强减弱增大减小 增大减小 减弱增强增强减弱
了解电负性的概念,知道主族元素电负性与元素性质的关系,认识主族元素电负性的变化规律(重点)
体会原子结构与元素周期律的本质联系(难点)【知识回顾】元素周期律的内容?元素周期律的本质?内容:元素周期律是指元素的性质随着原子序数的递增而呈周期性变化的规律本质:元素性质的周期性变化是原子核外电子排布周期性变化的必然结果族周期IA IIA IIIA IVA VA VIA VIIA原子得电子能力增强原
子
得
电
子
能
力
增
强原子失电子能力增强原
子
失
电
子
能
力
增
强【元素周期表中元素性质的递变规律 】金属性强弱非金属性强弱①单质与酸或水反应置换氢的难易
②最高价氧化物的水化物碱性强弱
③单质的还原性或阳离子的氧化性
④金属单质间的置换反应
⑤原电池反应中正负极①单质与H2化合的难易及氢化物的稳定性
②最高价氧化物的水化物酸性强弱
③单质的氧化性或阴离子的还原性
④非金属单质间的置换反应判断依据【元素的金属性与非金属性强弱的判断】【基础梳理】一、电离能及其变化规律气态原子或气态离子失去一个电子所需要的
最小能量叫做电离能。IM(g)= M+ (g) + e- I1(第一电离能)4.意义:M+(g)= M2+ (g) + e- I2(第二电离能)M2+(g)= M3+ (g) + e- I3(第三电离能)KJ/mol2.符号:单位:3.表示式:1.定义: 表示原子或离子失去电子的难易程度
电离能越小,气态时该原子越容易失去电子;
电离能越大,气态时该原子越难失去电子。
同种元素:I1﹤I2﹤I3﹤I4﹤……
表1-3-1第三周期元素(除Ar)的第一电离能的变化表1-3-2VA族元素的第一电离能的变化同一周期的元素而言,碱金属元素的第一电离能最小,稀有气体元素的第一电离能最大从左到右,元素的第一电离能在总体上呈现由小到大的变化趋势,表示元素原 子越来越难失去电子5、元素第一电离能的变化规律:1)同周期:
a、从左到右呈现递增趋势(最小的是碱金属,最大的是稀有气体的元素);2)同主族的元素自上而下第一电离能逐渐减少。
(第ⅡA元素和第ⅤA元素的反常现象如何解释?)b、第ⅡA元素>ⅢA的元素;第ⅤA元素>ⅥA元素 ⅡA全充满电子结构 ⅤA半充满电子结构 原因:随着核电荷数的增加和原子半径的减小,核对外层电子的有效吸引作 用依次增强。
原因:同主族元素原子的价电子数相同,原 子半径逐渐增大,原子核对核外电子的有效吸引作用逐渐减弱
实质分析第一电离能的周期性递变规律是原子半径、核外电子排布周期性变化的结果1.下列说法正确的是( )
A.第3周期所含的元素中钠的第一电离能最小
B.铝的第一电离能比镁的第一电离能大
C.在所有元素中,氟的第一电离能最大.
D.钾的第一电离能比镁的第一电离能大.A反常现象:第ⅡA元素>ⅢA的元素最大的是稀有气体的元素:He从左到右呈现递增趋势(最小的是碱金属)K<Na<Mg【对点训练】 电负性是元素的原子在化合物中 的 能力的标度。
元素的电负性越大,表示其原子在化合物中吸引电子的能力越强。
元素的电负性越小,表示其原子在化合物中吸引电子的能力越弱。1、电负性的概念:吸引电子二、电负性及其变化规律增 大减小 原因?2、电负性的递变规律:1)同周期从左到右,元素电负性增大2)同主族自上而下,元素电负性减小3)金属元素的电负性小,非金属元素电负性大原因:同周期元素原子从左至右,电子层数相同,核电荷数增大,原子半径递减,有效核电荷数递增,对外层电子的吸引能力逐渐增强,因而电负性递增。
原因:同主族元素原子从上到下,虽然核电荷数也增多,但电子层数增多引起原子半径增大比较明显,原子核对外层电子的吸引能力逐渐减弱,元素的电负性递减Be(OH)2+2H+=Be2++2H2O,Be(OH)2+2OH-=BeO22-+2H2O0.93~1.57 金属性越强,电负性越小;非金属性越强,电负性越大 Al元素和Cl元素的电负性差值为1.55<1.7,所以形成共价键,
为共价化合物。将氯化铝加热到熔融态,进行导电性实验,
如果不导电,说明是共价化合物
原子结构的周期性变化元素性质的周期性变化表现形式元素周期表小结:相同递增减小增多相同增大+1→+7 -4→-1 主族序数主族增强减弱增强减弱增大减小 增大减小 减弱增强增强减弱
