鲁科版高中化学 选修4 第3章第1节 水溶液(共13张ppt)
文档属性
| 名称 | 鲁科版高中化学 选修4 第3章第1节 水溶液(共13张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 157.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-01 00:00:00 | ||
图片预览



文档简介
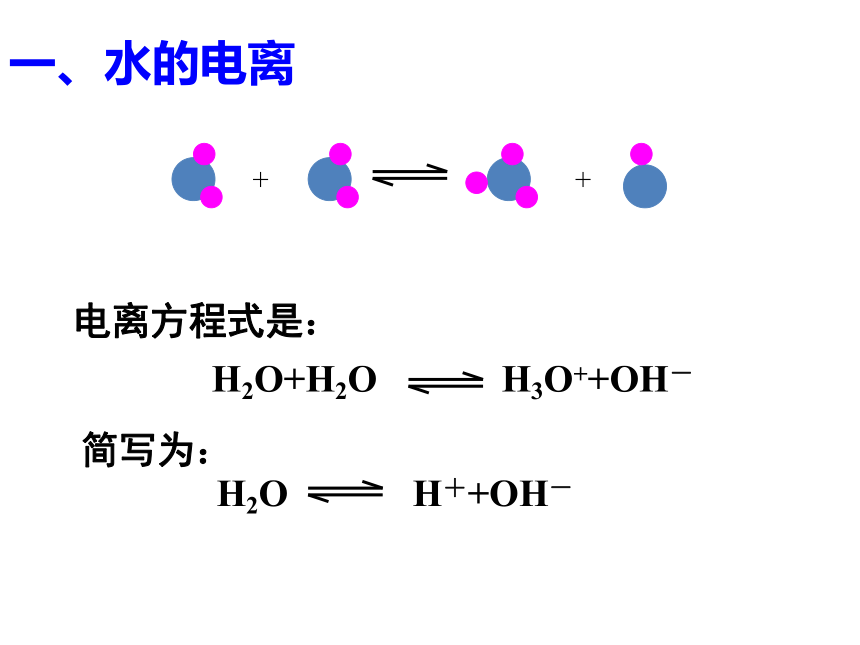
课件13张PPT。 第三章 物质在水溶液中的行为第一节 水溶液(第1课时)一、水的电离 H2O+H2O H3O++OH-
电离方程式是:简写为:[H+] =[OH-]=1×10-7mol/L25℃时,1L纯水中只有1×10-7molH2O发生电离。
H2O H++OH- 变形为:K · [H2O]= [H+] [OH-]KW叫水的离子积常数,简称水的离子积 25℃时,KW= [H+][OH-]=1×10-14mol2·L-2平衡常数:假设水的体积为1L,则:
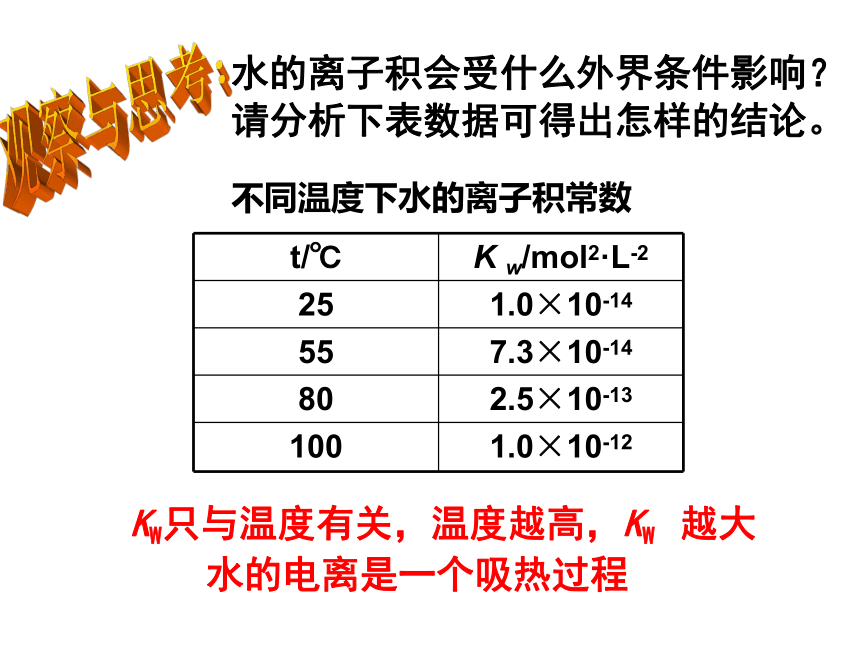
m(H2O)=1000g= KW不同温度下水的离子积常数请分析下表数据可得出怎样的结论。
KW只与温度有关,温度越高,KW 越大
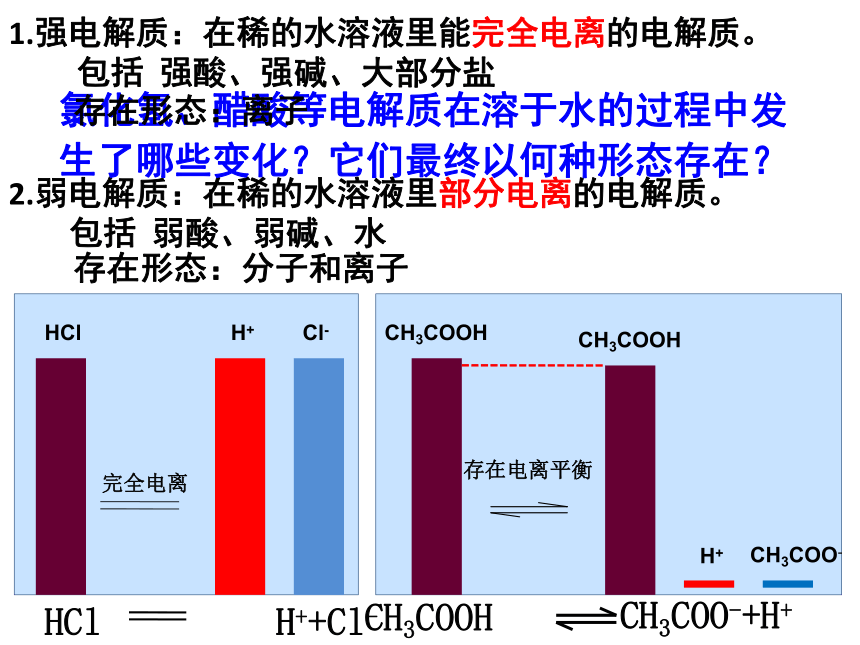
观察与思考:水的离子积会受什么外界条件影响? 水的电离是一个吸热过程观察.思考—(实验)强弱强弱亮暗亮暗二、电解质在水溶液中的存在形态1.浓度相同的不同电解质的水溶液的导电能力不同,其原因是什么?2.浓度相同的不同电解质的水溶液的自由离子浓度不同,其原因是什么?你的问题、任务1.强电解质:在稀的水溶液里能完全电离的电解质。
包括 强酸、强碱、大部分盐
2.弱电解质:在稀的水溶液里部分电离的电解质。
包括 弱酸、弱碱、水
氯化氢、醋酸等电解质在溶于水的过程中发生了哪些变化?它们最终以何种形态存在?存在形态:离子存在形态:分子和离子
HClO
H2SO4
NH3·H2O
NaHSO4ClO-+H+ SO42-+2H+ OH-+NH4+SO42-+H++Na+写出下列物质在水溶液中的电离方程式判断正误:
1、强电解质溶液一定比弱电解质溶液的导电
能力强。
2、BaSO4的水溶液导电能力很弱,所以硫酸钡
是弱电解质。
3、相同条件下,浓度均为1mol/L 的HCl和CH3COOH溶液,HCl溶液的导电能力强,所以HCl是强电解质,CH3COOH是弱电解质。××强弱电解质判断的依据:
是电解质在水溶液中是否完全电离。×对常温下的纯水进行下列操作(不考虑加入物质引起的温度变化的影响),完成下表: H2O H++OH-酸性逆向减小增大增大不变碱性逆向减小减小减小不变中性不移动不变不变不变不变酸性逆向减小增大减小不变加NaHSO4
固体加入Na2CO3固体呢?三、电解质对水的电离平衡的影响思考:1.纯水中加入酸或碱是否影响水的离子积?2.水溶液中KW中的[H+] [OH-]是指溶液中的[H+] [OH-]还是指水电离产生的[H+] [OH-]?3.在酸或碱溶液中,水电离出来的C(H+)和
C(OH-)是否相等?(1)Kw只随温度变化,升高温度,Kw增大。 25℃时,Kw=1×10-14(mol/L)2。 (2)水的离子积不仅适用于纯水,也适用于任何酸、碱、盐的稀溶液。
(3)酸溶液中: [H+] = [H+]酸 + [H+]水
碱溶液中: [H+] = [H+]水
注意[OH-]= [OH-]水 [OH-]= [OH-]碱+[OH-]水自我诊断:判断正误:
1.任何水溶液中都存在水的电离平衡。
2.任何水溶液中(不论酸、碱或中性),都存在Kw=10-14 mol2/L2
3.25℃ 时,某溶液中[H+]= 10-7mol/L,则该溶液一定是纯水。
4.某温度下,纯水中H+浓度为1×10-6mol/L,则溶液显酸性 √××× 【小结】加酸加碱加热抑制电离 促进电离抑制电离完全电离部分电离 水的电离
过程 水的离子
积常数平衡移动强电解质弱电解质KW= [H+][OH-]
电离方程式是:简写为:[H+] =[OH-]=1×10-7mol/L25℃时,1L纯水中只有1×10-7molH2O发生电离。
H2O H++OH- 变形为:K · [H2O]= [H+] [OH-]KW叫水的离子积常数,简称水的离子积 25℃时,KW= [H+][OH-]=1×10-14mol2·L-2平衡常数:假设水的体积为1L,则:
m(H2O)=1000g= KW不同温度下水的离子积常数请分析下表数据可得出怎样的结论。
KW只与温度有关,温度越高,KW 越大
观察与思考:水的离子积会受什么外界条件影响? 水的电离是一个吸热过程观察.思考—(实验)强弱强弱亮暗亮暗二、电解质在水溶液中的存在形态1.浓度相同的不同电解质的水溶液的导电能力不同,其原因是什么?2.浓度相同的不同电解质的水溶液的自由离子浓度不同,其原因是什么?你的问题、任务1.强电解质:在稀的水溶液里能完全电离的电解质。
包括 强酸、强碱、大部分盐
2.弱电解质:在稀的水溶液里部分电离的电解质。
包括 弱酸、弱碱、水
氯化氢、醋酸等电解质在溶于水的过程中发生了哪些变化?它们最终以何种形态存在?存在形态:离子存在形态:分子和离子
HClO
H2SO4
NH3·H2O
NaHSO4ClO-+H+ SO42-+2H+ OH-+NH4+SO42-+H++Na+写出下列物质在水溶液中的电离方程式判断正误:
1、强电解质溶液一定比弱电解质溶液的导电
能力强。
2、BaSO4的水溶液导电能力很弱,所以硫酸钡
是弱电解质。
3、相同条件下,浓度均为1mol/L 的HCl和CH3COOH溶液,HCl溶液的导电能力强,所以HCl是强电解质,CH3COOH是弱电解质。××强弱电解质判断的依据:
是电解质在水溶液中是否完全电离。×对常温下的纯水进行下列操作(不考虑加入物质引起的温度变化的影响),完成下表: H2O H++OH-酸性逆向减小增大增大不变碱性逆向减小减小减小不变中性不移动不变不变不变不变酸性逆向减小增大减小不变加NaHSO4
固体加入Na2CO3固体呢?三、电解质对水的电离平衡的影响思考:1.纯水中加入酸或碱是否影响水的离子积?2.水溶液中KW中的[H+] [OH-]是指溶液中的[H+] [OH-]还是指水电离产生的[H+] [OH-]?3.在酸或碱溶液中,水电离出来的C(H+)和
C(OH-)是否相等?(1)Kw只随温度变化,升高温度,Kw增大。 25℃时,Kw=1×10-14(mol/L)2。 (2)水的离子积不仅适用于纯水,也适用于任何酸、碱、盐的稀溶液。
(3)酸溶液中: [H+] = [H+]酸 + [H+]水
碱溶液中: [H+] = [H+]水
注意[OH-]= [OH-]水 [OH-]= [OH-]碱+[OH-]水自我诊断:判断正误:
1.任何水溶液中都存在水的电离平衡。
2.任何水溶液中(不论酸、碱或中性),都存在Kw=10-14 mol2/L2
3.25℃ 时,某溶液中[H+]= 10-7mol/L,则该溶液一定是纯水。
4.某温度下,纯水中H+浓度为1×10-6mol/L,则溶液显酸性 √××× 【小结】加酸加碱加热抑制电离 促进电离抑制电离完全电离部分电离 水的电离
过程 水的离子
积常数平衡移动强电解质弱电解质KW= [H+][OH-]
