鲁科版高中 化学 选修4 3.3 沉淀溶解平衡(共14张ppt)
文档属性
| 名称 | 鲁科版高中 化学 选修4 3.3 沉淀溶解平衡(共14张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-01 18:54:42 | ||
图片预览






文档简介
课件14张PPT。第三章 水溶液中的离子平衡第3节 沉淀溶解平衡 当你外出旅游, 沉醉于神奇的溶洞,欣赏着美丽的珊瑚时,一定会惊叹于大自然的鬼斧神工。你想知道它们是如何形成的吗?“桃花流水窅然去,别有天地非人间”诗仙李白别有洞天的诗句,恰如其分的表现
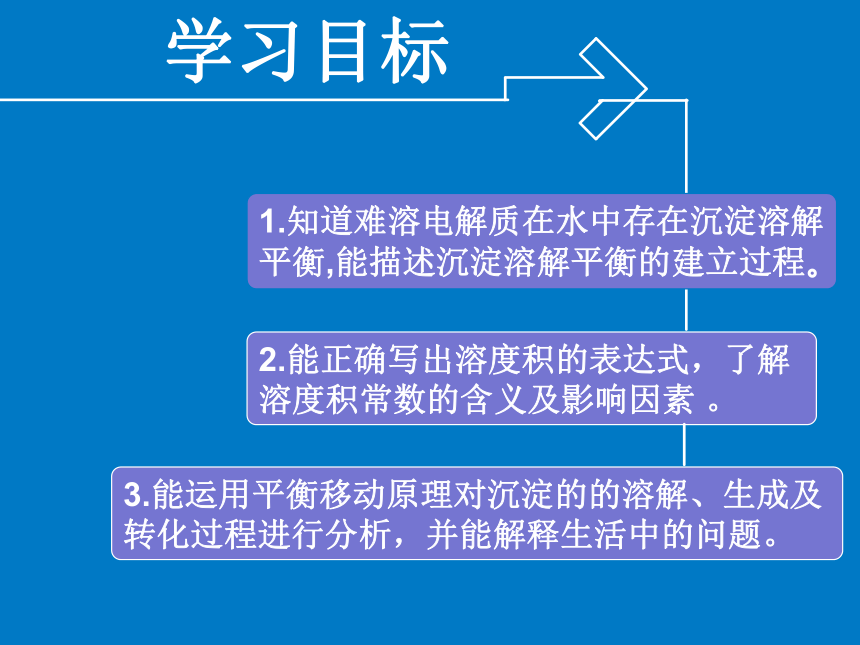
出中国古老溶洞的壮观和神奇。 学习目标2.能正确写出溶度积的表达式,了解溶度积常数的含义及影响因素 。1.知道难溶电解质在水中存在沉淀溶解平衡,能描述沉淀溶解平衡的建立过程。3.能运用平衡移动原理对沉淀的的溶解、生成及转化过程进行分析,并能解释生活中的问题。 【实验探究1】 PbI2的溶解平衡向PbI2饱和溶液上层清液中滴加几滴0.1mol/L
的(CH3COO)2Pb溶液或者 0.1mol/LKI溶液注意:在操作过程中不能震荡试管①号试管加(CH3COO)2Pb溶液
②号试管加0.1mol/LKI溶液 观察实验现象PbI2在水中溶解平衡一、沉淀溶解平衡与溶度积1.沉淀溶解平衡:一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成电解质的饱和溶液,达到平衡状态,此时离子浓度保持不变(或一定)2.溶度积常数或溶度积(Ksp )② Ksp反映了难溶电解质在水中的溶解度
只与难溶电解质的性质和温度有关。美丽的珊瑚礁空气中二氧化碳增多,干扰珊瑚的生长,甚至造成珊瑚虫的死亡。你知道是为什么吗?1.运用沉淀溶解平衡理论解释:
①医学上做钡餐透视时为什么用BaSO4而不用BaCO3?可溶性钡盐中毒,如何处理?
②溶洞的形成并写出有关化学方程式。
③海洋中多彩的珊瑚为什么濒临灭绝?
2. 合作完成【实验探究2】观察现象 解释原因小组合作·交流讨论1.沉淀的溶解与生成
Q>Ksp, 平衡向生成沉淀的方向移动。
Q=Ksp, 平衡状态
Q实质:沉淀溶解平衡的移动
规律:一种沉淀可以转化为更难溶的沉淀,两种难溶物的溶解能力差别越大,越容易转化 利用沉淀转化原理,在工业废水的处理过程中,常用FeS(s) MnS(s)等难溶物作为沉淀剂除去废水中的Cu2+、Hg2+、Pb2+等重金属离子。 FeS(s) + Cu2+(aq) = CuS(s) + Fe2+ 化学与生产 锅炉中水垢中含有CaSO4 ,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3。+
CO32- 化学与生活CaSO4 (s) + CO32- (aq) = CaCO3 (s) + SO42- (aq) 牙齿表面由一层硬的、组成为Ca5(PO4)3OH
的物质保护着,它在唾液中存在下列平衡:
Ca5(PO4)3OH(s) 5Ca2++3PO43-+OH- 进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是?生成的有机酸能中和OH-,使平衡向脱矿方向移动,加速腐蚀牙齿 化学与生活我们这节课学到了什么?KSP和沉
淀
溶
解
平
衡
的
移
动 当我们以一种新的姿态来学习化学、应用化学,相信我们的生活将变得更加美好!
出中国古老溶洞的壮观和神奇。 学习目标2.能正确写出溶度积的表达式,了解溶度积常数的含义及影响因素 。1.知道难溶电解质在水中存在沉淀溶解平衡,能描述沉淀溶解平衡的建立过程。3.能运用平衡移动原理对沉淀的的溶解、生成及转化过程进行分析,并能解释生活中的问题。 【实验探究1】 PbI2的溶解平衡向PbI2饱和溶液上层清液中滴加几滴0.1mol/L
的(CH3COO)2Pb溶液或者 0.1mol/LKI溶液注意:在操作过程中不能震荡试管①号试管加(CH3COO)2Pb溶液
②号试管加0.1mol/LKI溶液 观察实验现象PbI2在水中溶解平衡一、沉淀溶解平衡与溶度积1.沉淀溶解平衡:一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成电解质的饱和溶液,达到平衡状态,此时离子浓度保持不变(或一定)2.溶度积常数或溶度积(Ksp )② Ksp反映了难溶电解质在水中的溶解度
只与难溶电解质的性质和温度有关。美丽的珊瑚礁空气中二氧化碳增多,干扰珊瑚的生长,甚至造成珊瑚虫的死亡。你知道是为什么吗?1.运用沉淀溶解平衡理论解释:
①医学上做钡餐透视时为什么用BaSO4而不用BaCO3?可溶性钡盐中毒,如何处理?
②溶洞的形成并写出有关化学方程式。
③海洋中多彩的珊瑚为什么濒临灭绝?
2. 合作完成【实验探究2】观察现象 解释原因小组合作·交流讨论1.沉淀的溶解与生成
Q>Ksp, 平衡向生成沉淀的方向移动。
Q=Ksp, 平衡状态
Q
规律:一种沉淀可以转化为更难溶的沉淀,两种难溶物的溶解能力差别越大,越容易转化 利用沉淀转化原理,在工业废水的处理过程中,常用FeS(s) MnS(s)等难溶物作为沉淀剂除去废水中的Cu2+、Hg2+、Pb2+等重金属离子。 FeS(s) + Cu2+(aq) = CuS(s) + Fe2+ 化学与生产 锅炉中水垢中含有CaSO4 ,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3。+
CO32- 化学与生活CaSO4 (s) + CO32- (aq) = CaCO3 (s) + SO42- (aq) 牙齿表面由一层硬的、组成为Ca5(PO4)3OH
的物质保护着,它在唾液中存在下列平衡:
Ca5(PO4)3OH(s) 5Ca2++3PO43-+OH- 进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是?生成的有机酸能中和OH-,使平衡向脱矿方向移动,加速腐蚀牙齿 化学与生活我们这节课学到了什么?KSP和沉
淀
溶
解
平
衡
的
移
动 当我们以一种新的姿态来学习化学、应用化学,相信我们的生活将变得更加美好!
