鲁科版高中 化学 选修4 2.3 化学反应的速率(36张ppt)
文档属性
| 名称 | 鲁科版高中 化学 选修4 2.3 化学反应的速率(36张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 938.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-01 19:03:32 | ||
图片预览








文档简介
课件36张PPT。第二章第三节 化学反应速率
第四课时
1.理解催化剂对化学反应速率的影响。
2 .能用相关理论简单解释催化剂对速率造成的影响
3.认识催化剂在生产、生活和科学领域中的重大作用浓度、温度、压强对化学反应速率有什么影响?他们是如何改变化学反应速率的?温故知新
1.对于反应:A + B = C?,下列条件的改变一定能使化学反应速率加快的是 ( )
A.增加A的物质的量 B.升高体系的温度
C. 增加体系的压强 D.减少c的物质的量
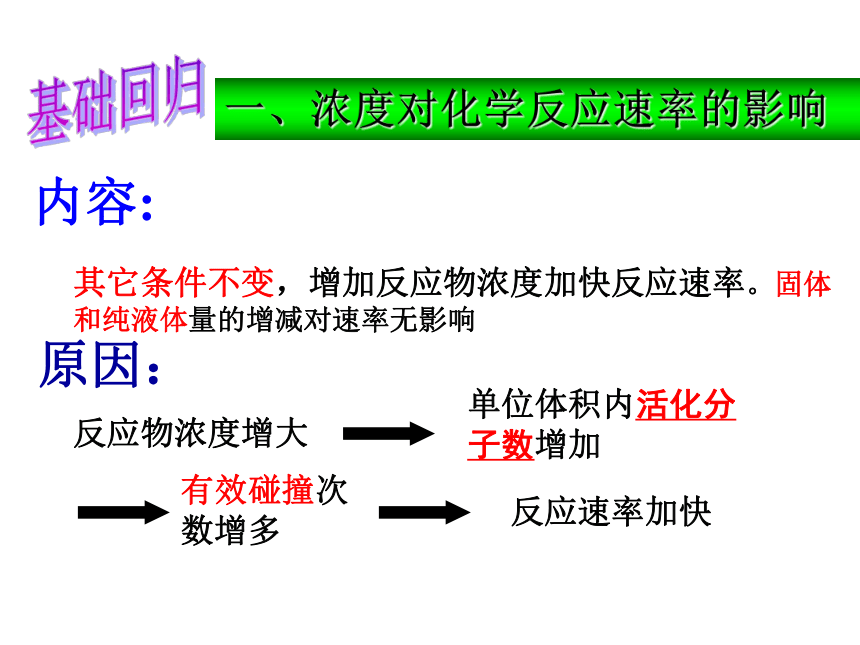
B 自我检测其它条件不变,增加反应物浓度加快反应速率。固体和纯液体量的增减对速率无影响内容:原因:反应物浓度增大单位体积内活化分子数增加有效碰撞次数增多反应速率加快一、浓度对化学反应速率的影响基础回归2.对于在密闭容器中进行的反应:N2+O2 2NO,下列条件中不能加快该反应速率的是 ( )
A.缩小体积 B.充入更多的NO
C.充入更多的He D.升高温度
C1.对于反应:A + B = C?,下列条件的改变一定能使化学反应速率加快的是 ( B )
A.增加A的物质的量 B.升高体系的温度
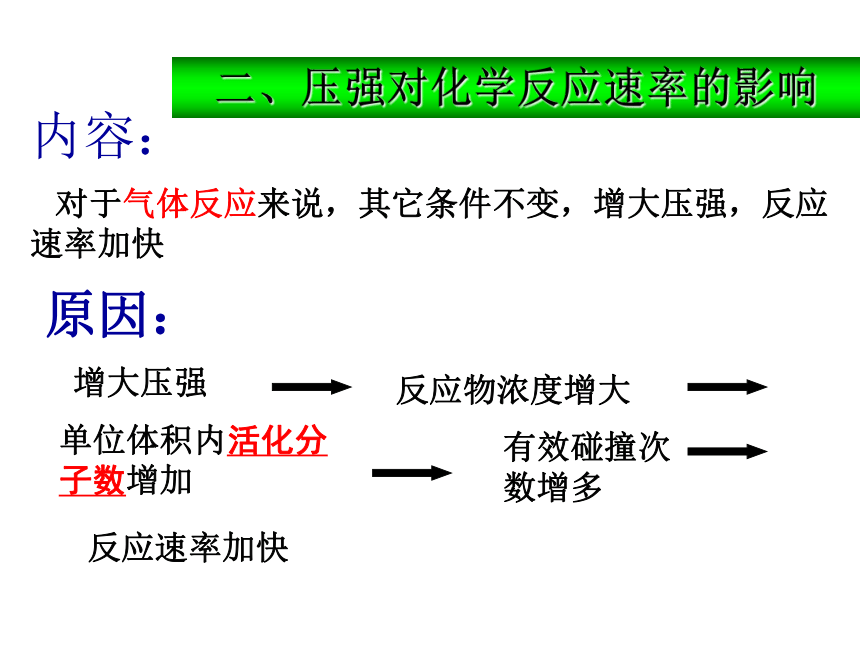
C. 增加体系的压强 D.减少c的物质的量自我检测内容:二、压强对化学反应速率的影响 对于气体反应来说,其它条件不变,增大压强,反应速率加快.“惰性”气体(不参与反应的气体)对速率的影响
①恒温、恒容
原平衡体系 各组分的浓度不变,速率不变。
②恒温、恒压
原平衡体系 容器容积增大,体系中各反应成分的浓度同倍数减小(等效于减压),速率减慢
充入惰性气体 原因:基础回归充入惰性气体 内容: 对于气体反应来说,其它条件不变,增大压强,反应速率加快原因:增大压强反应物浓度增大单位体积内活化分子数增加有效碰撞次数增多反应速率加快二、压强对化学反应速率的影响
3.升高温度时,化学反应速率加快,是因为( )
A.分子运动速率加快,使反应物分子间的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞
数增多,化学反应速率加快
C.该反应的过程是吸热的
D.该反应的过程是放热的
4. 反应:A(气)+3B(气) 2C(气); ΔH<0 达平衡后,将气体混合物的温度降低,下列叙述中正确的是( )
A.正反应速率加大,逆反应速率变小,平衡正向移动
B.正反应速率变小,逆反应速率加大,平衡逆向移动
C.正反应速率和逆反应速率都变小,平衡正向移动
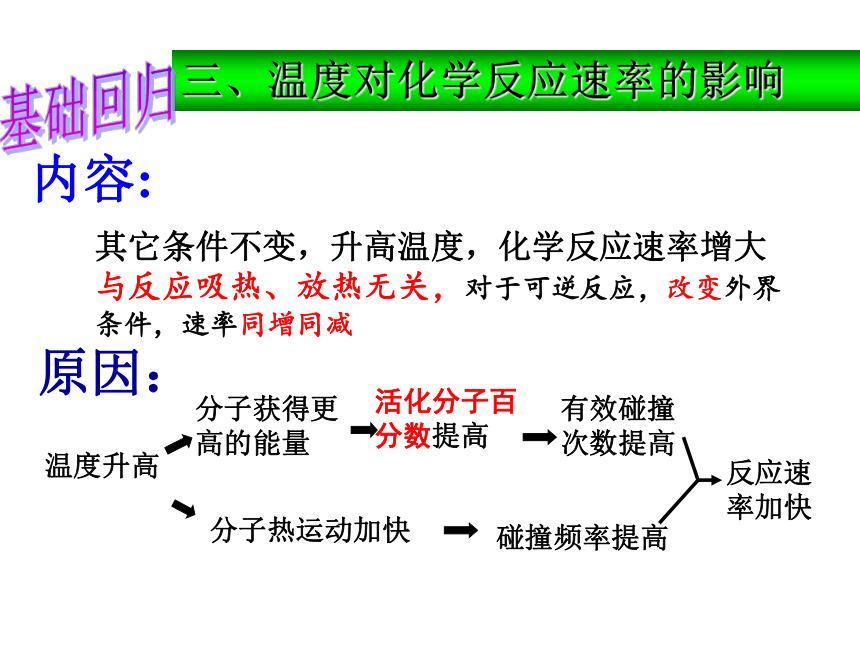
D.正反应速率和逆反应速率都变小,平衡逆向移动 CB 自我检测内容:原因:其它条件不变,升高温度,化学反应速率增大与反应吸热、放热无关,对于可逆反应,改变外界条件,速率同增同减
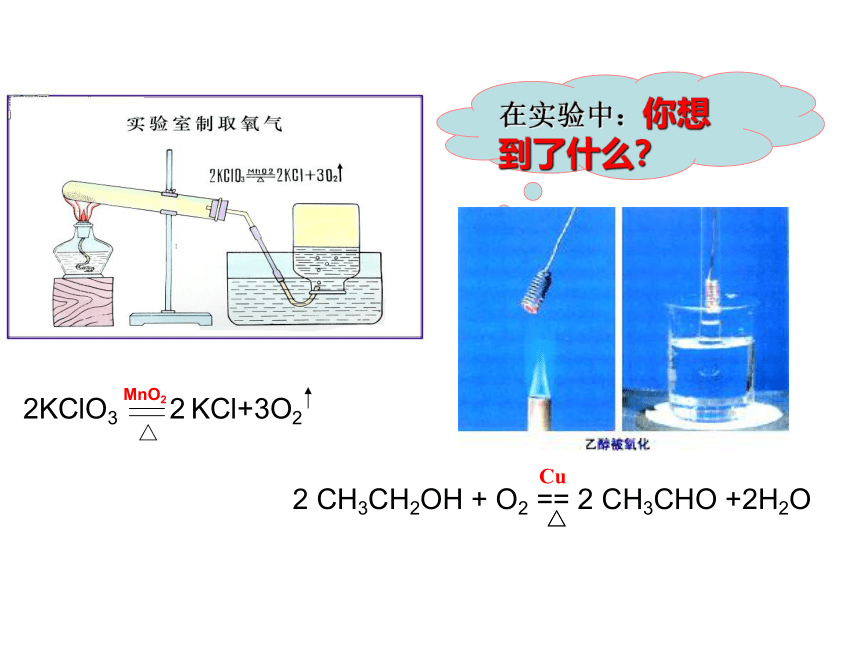
温度升高分子热运动加快碰撞频率提高分子获得更高的能量活化分子百分数提高有效碰撞次数提高三、温度对化学反应速率的影响基础回归在实验中:你想到了什么?2KClO3 2 KCl+3O2MnO2△
2 CH3CH2OH + O2 == 2 CH3CHO +2H2O△Cu△生活中你想到了什么?变色眼镜用洗衣粉的成分加快去污凡是能改变反应速率而自身在反应前后化学性质和质量没有发生变化的物质叫催化剂。
(二)、催化原理(一)、催化剂定义四、催化剂对化学反应速率的影响小组讨论教材P61表2-3-5所列出的数据信息,并根据表中数据分析:
思考一
催化剂对化学反应速率有怎样的影响?交流研讨思考二
与其他因素相比,催化剂对化学反应速率影响程度如何?从数据可以看出催化剂能成千上万倍的提高化学反应的速率。思考三
结合图2-3-9你能看出催化剂是如何提高化学反应速率的? 思考二
与其他因素相比,催化剂对化学反应速率影响程度如何? 各条件对速率的影响大小是:
催化剂 >>温度>浓度=压强(体积变化引起的)
思考三
结合图2-3-9你能看出催化剂是如何提高化学反应速率的?催化剂通过参与反应,改变反应历程,降低反应的活化能,来提高化学反应速率。(二)、催化原理(一)、催化剂定义四、催化剂对化学反应速率的影响催化剂通过参与反应,改变反应历程,降低反应的活化能,来提高化学反应速率。能量反应过程E1E2反应物平均能量生成物平均能量活化分子活化能活化分子变成生成物分子放出的能量反应热没加催化剂加了催化剂→E3尝试写出乙醇催化氧化的分步反应历程体验
2 CH3CH2OH + O2 == 2 CH3CHO +2H2O△Cu 请同学们阅读教材62页,思考以下问题:
思考四
从乙烯与氧气的两个反应中,你发现催化剂具有什么特点?
思考五
催化剂能改变化学反应的平衡常数和平衡转化率吗?选择性既不能改变化学反应的平衡常数,也不
能改变平衡转化率,但可以改变到达平衡的时间只对某一反应或某类反应起催化作用。头脑风暴 1、使用催化剂同等程度的增大(减慢)正逆反应速率,从而改变反应到达平衡所需时间。
2、没特别指明一般指正催化剂
3、催化剂只能催化可能发生的反应,对不发生的反应无作用
4、催化剂具有一定的选择性和高效性
(三)、催化剂的特点(四)、速度-时间图:自我诊断对于反应mA(g)+nB(g) pC(g)+qD(g)有如下图所示的变化,请分析t1时的改变因素可能是什么?并说明理由。= ?由于v正、v逆相同程 度的增大,平衡-----------。 t1时的改变因素可能是------
-----------------------------------
----------------------------没有移动a.加入(正)催化剂
b.当m+n=p+q时增大压强。前面我们从微观角度理解了浓度、压强、温度对化学反应速率的影响,现在我们试着从理论上解释催化剂是如何影响化学反应速率的。头脑风暴反应速率理论本质探讨分子
运动分子具有
足够能量有合适的取向 (五)、速率的微观分析n活=n总×活%正催化剂→降低反应的活化能→v↑催化剂——改变反应的途径,不改变结果→活%↑
n总不变阶段小结四、催化剂对反应速率的影响内容:
其他条件不变时,加入催化剂能加快反应速率原因:
加入催化剂 →降低反应的活化能→活%↑
n总不变→v↑五、其他因素的影响
其他如光照、反应物固体的颗粒大小、电磁波、超声波、溶剂的性质等,也会对化学反应的速率产生影响。除了反应物的浓度、温度、压强和使用催化剂能改变反应速率外,还有一些方法也能改变反应速率。你能举出一些例子吗?头脑风暴一、化学反应速率1.表示方法:2.数学表达式:3. 单位:通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。mol/(L ·s) 或 mol (L ·min) -1或 mol·L-1 ·h-1概括整合 1.反应速率是指某一时间段内的平均速率,而不是瞬时速率; 2.同一反应的反应速率用不同的物质来表示,可能有不同的速率值,但这些速率的数值之比等于化学方程式的计量系数之比应注意的几个重要的问题:对于反应:mA + nB = pC + qD比例关系: V(A) :V(B) :V(C) :V(D) = m :n :p :q 3.比较同一反应在不同条件下的反应速率时,应:①统一基准物质; ②统一单位。 二、影响化学反应速率的因素
内因(主):反应物自身的性质
外因(次):当其他条件不变时
1.浓度的影响:增加反应物的浓度可以加快反应速率;
2.压强的影响:(仅适用于有气体参加的反应)增加体系的压强,可以加快化学反应速率;
3.温度的影响:升高体系的温度可以加快化学反应速率;
4.催化剂的影响:同等程度的改变正逆反应速率
5.其他因素的影响:如:光、固体颗粒大小、溶剂等与反应吸热、放热无关对于可逆反应,改变外界条件,速率同增同减 作业:
必做部分:
课本P64 2 、3
导学案中的课后习题1---9
选做部分:
导学案中的课后习题10---191.下列说法正确的是( )
①参加反应的物质的性质是影响化学反应速率的主要因素
②光是影响某些化学反应速率的外界条件之一
③决定化学反应速率的主要因素是浓度
④不管什么反应,增大浓度,或加热或加压,或使用催化剂,都可以加快反应速率A.①② B.②③ C.③④ D.①④自我诊断A
下列说法不正确的是( )
A.升高温度可使该反应的逆反应速率降低
B.使用高效催化剂可有效提高正反应速率
C.反应达到平衡后,NO的反应速率保持恒定
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡2、已知汽车尾气无害化处理反应2NO(g)+2CO(g)N2(g)+2CO2(g)自我诊断A3、把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生的速率的因素是( )
A.盐酸的浓度 B.铝条的表面积
C .溶液的温度 D.加少Na2SO4固体自我诊断D 4、2SO2(g)+O2(g)是制备硫酸的重要反应。下列叙述正确的是( )
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强、反应速度一定增大
C.该反应是放热反应,降低温度将缩短反应达 到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2,
则时间间隔t1~t2内,SO3(g)生成的平均速率为v =2SO3(g)V2O5自我诊断D反应A(g)+B(g) C(g)+D(g)
过程中的能量变化如图所示,回答下列
问题。
(1)该反应是________反应(填“吸热”“放热”);
(2)反应体系中加入催化剂对反应热是否有影响? _______原因是————————————————————————————————————
————————————————————————————————————————— (3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小”“不变”)。
A(g)+B(g)C(g)+D(g)E1E2能量反应历程放热没有催化剂只能改变化学反应的速率和途径,不能改变化学
反应的始态和终态的能量,因此对反应热没有影响 减小减小自我诊断5、A(g)+B(g)能量A(g)+B(g)能量A(g)+B(g)能量A(g)+B(g)E2能量A(g)+B(g)E1E2能量A(g)+B(g)C(g)+D(g)E1E2能量A(g)+B(g)
外界条件、速率与平衡是否移动的关系
外界条件改变,速率一定变化吗?
速率改变了,平衡一定移动吗?
平衡发生移动,反应速率一定变化吗?精华提炼
外界条件、速率与平衡是否移动的关系
外界条件改变,速率一定变化吗?
速率改变了,平衡一定移动吗?
平衡发生移动,反应速率一定变化吗?a.改变化学平衡体系中固体或纯液体的物质的量时
b.恒温、恒容下充入惰性气体不一定不一定a平衡后加入催化剂
B等体反应加压一定因为速率的改变是平衡移动的本质精华提炼
第四课时
1.理解催化剂对化学反应速率的影响。
2 .能用相关理论简单解释催化剂对速率造成的影响
3.认识催化剂在生产、生活和科学领域中的重大作用浓度、温度、压强对化学反应速率有什么影响?他们是如何改变化学反应速率的?温故知新
1.对于反应:A + B = C?,下列条件的改变一定能使化学反应速率加快的是 ( )
A.增加A的物质的量 B.升高体系的温度
C. 增加体系的压强 D.减少c的物质的量
B 自我检测其它条件不变,增加反应物浓度加快反应速率。固体和纯液体量的增减对速率无影响内容:原因:反应物浓度增大单位体积内活化分子数增加有效碰撞次数增多反应速率加快一、浓度对化学反应速率的影响基础回归2.对于在密闭容器中进行的反应:N2+O2 2NO,下列条件中不能加快该反应速率的是 ( )
A.缩小体积 B.充入更多的NO
C.充入更多的He D.升高温度
C1.对于反应:A + B = C?,下列条件的改变一定能使化学反应速率加快的是 ( B )
A.增加A的物质的量 B.升高体系的温度
C. 增加体系的压强 D.减少c的物质的量自我检测内容:二、压强对化学反应速率的影响 对于气体反应来说,其它条件不变,增大压强,反应速率加快.“惰性”气体(不参与反应的气体)对速率的影响
①恒温、恒容
原平衡体系 各组分的浓度不变,速率不变。
②恒温、恒压
原平衡体系 容器容积增大,体系中各反应成分的浓度同倍数减小(等效于减压),速率减慢
充入惰性气体 原因:基础回归充入惰性气体 内容: 对于气体反应来说,其它条件不变,增大压强,反应速率加快原因:增大压强反应物浓度增大单位体积内活化分子数增加有效碰撞次数增多反应速率加快二、压强对化学反应速率的影响
3.升高温度时,化学反应速率加快,是因为( )
A.分子运动速率加快,使反应物分子间的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞
数增多,化学反应速率加快
C.该反应的过程是吸热的
D.该反应的过程是放热的
4. 反应:A(气)+3B(气) 2C(气); ΔH<0 达平衡后,将气体混合物的温度降低,下列叙述中正确的是( )
A.正反应速率加大,逆反应速率变小,平衡正向移动
B.正反应速率变小,逆反应速率加大,平衡逆向移动
C.正反应速率和逆反应速率都变小,平衡正向移动
D.正反应速率和逆反应速率都变小,平衡逆向移动 CB 自我检测内容:原因:其它条件不变,升高温度,化学反应速率增大与反应吸热、放热无关,对于可逆反应,改变外界条件,速率同增同减
温度升高分子热运动加快碰撞频率提高分子获得更高的能量活化分子百分数提高有效碰撞次数提高三、温度对化学反应速率的影响基础回归在实验中:你想到了什么?2KClO3 2 KCl+3O2MnO2△
2 CH3CH2OH + O2 == 2 CH3CHO +2H2O△Cu△生活中你想到了什么?变色眼镜用洗衣粉的成分加快去污凡是能改变反应速率而自身在反应前后化学性质和质量没有发生变化的物质叫催化剂。
(二)、催化原理(一)、催化剂定义四、催化剂对化学反应速率的影响小组讨论教材P61表2-3-5所列出的数据信息,并根据表中数据分析:
思考一
催化剂对化学反应速率有怎样的影响?交流研讨思考二
与其他因素相比,催化剂对化学反应速率影响程度如何?从数据可以看出催化剂能成千上万倍的提高化学反应的速率。思考三
结合图2-3-9你能看出催化剂是如何提高化学反应速率的? 思考二
与其他因素相比,催化剂对化学反应速率影响程度如何? 各条件对速率的影响大小是:
催化剂 >>温度>浓度=压强(体积变化引起的)
思考三
结合图2-3-9你能看出催化剂是如何提高化学反应速率的?催化剂通过参与反应,改变反应历程,降低反应的活化能,来提高化学反应速率。(二)、催化原理(一)、催化剂定义四、催化剂对化学反应速率的影响催化剂通过参与反应,改变反应历程,降低反应的活化能,来提高化学反应速率。能量反应过程E1E2反应物平均能量生成物平均能量活化分子活化能活化分子变成生成物分子放出的能量反应热没加催化剂加了催化剂→E3尝试写出乙醇催化氧化的分步反应历程体验
2 CH3CH2OH + O2 == 2 CH3CHO +2H2O△Cu 请同学们阅读教材62页,思考以下问题:
思考四
从乙烯与氧气的两个反应中,你发现催化剂具有什么特点?
思考五
催化剂能改变化学反应的平衡常数和平衡转化率吗?选择性既不能改变化学反应的平衡常数,也不
能改变平衡转化率,但可以改变到达平衡的时间只对某一反应或某类反应起催化作用。头脑风暴 1、使用催化剂同等程度的增大(减慢)正逆反应速率,从而改变反应到达平衡所需时间。
2、没特别指明一般指正催化剂
3、催化剂只能催化可能发生的反应,对不发生的反应无作用
4、催化剂具有一定的选择性和高效性
(三)、催化剂的特点(四)、速度-时间图:自我诊断对于反应mA(g)+nB(g) pC(g)+qD(g)有如下图所示的变化,请分析t1时的改变因素可能是什么?并说明理由。= ?由于v正、v逆相同程 度的增大,平衡-----------。 t1时的改变因素可能是------
-----------------------------------
----------------------------没有移动a.加入(正)催化剂
b.当m+n=p+q时增大压强。前面我们从微观角度理解了浓度、压强、温度对化学反应速率的影响,现在我们试着从理论上解释催化剂是如何影响化学反应速率的。头脑风暴反应速率理论本质探讨分子
运动分子具有
足够能量有合适的取向 (五)、速率的微观分析n活=n总×活%正催化剂→降低反应的活化能→v↑催化剂——改变反应的途径,不改变结果→活%↑
n总不变阶段小结四、催化剂对反应速率的影响内容:
其他条件不变时,加入催化剂能加快反应速率原因:
加入催化剂 →降低反应的活化能→活%↑
n总不变→v↑五、其他因素的影响
其他如光照、反应物固体的颗粒大小、电磁波、超声波、溶剂的性质等,也会对化学反应的速率产生影响。除了反应物的浓度、温度、压强和使用催化剂能改变反应速率外,还有一些方法也能改变反应速率。你能举出一些例子吗?头脑风暴一、化学反应速率1.表示方法:2.数学表达式:3. 单位:通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。mol/(L ·s) 或 mol (L ·min) -1或 mol·L-1 ·h-1概括整合 1.反应速率是指某一时间段内的平均速率,而不是瞬时速率; 2.同一反应的反应速率用不同的物质来表示,可能有不同的速率值,但这些速率的数值之比等于化学方程式的计量系数之比应注意的几个重要的问题:对于反应:mA + nB = pC + qD比例关系: V(A) :V(B) :V(C) :V(D) = m :n :p :q 3.比较同一反应在不同条件下的反应速率时,应:①统一基准物质; ②统一单位。 二、影响化学反应速率的因素
内因(主):反应物自身的性质
外因(次):当其他条件不变时
1.浓度的影响:增加反应物的浓度可以加快反应速率;
2.压强的影响:(仅适用于有气体参加的反应)增加体系的压强,可以加快化学反应速率;
3.温度的影响:升高体系的温度可以加快化学反应速率;
4.催化剂的影响:同等程度的改变正逆反应速率
5.其他因素的影响:如:光、固体颗粒大小、溶剂等与反应吸热、放热无关对于可逆反应,改变外界条件,速率同增同减 作业:
必做部分:
课本P64 2 、3
导学案中的课后习题1---9
选做部分:
导学案中的课后习题10---191.下列说法正确的是( )
①参加反应的物质的性质是影响化学反应速率的主要因素
②光是影响某些化学反应速率的外界条件之一
③决定化学反应速率的主要因素是浓度
④不管什么反应,增大浓度,或加热或加压,或使用催化剂,都可以加快反应速率A.①② B.②③ C.③④ D.①④自我诊断A
下列说法不正确的是( )
A.升高温度可使该反应的逆反应速率降低
B.使用高效催化剂可有效提高正反应速率
C.反应达到平衡后,NO的反应速率保持恒定
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡2、已知汽车尾气无害化处理反应2NO(g)+2CO(g)N2(g)+2CO2(g)自我诊断A3、把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生的速率的因素是( )
A.盐酸的浓度 B.铝条的表面积
C .溶液的温度 D.加少Na2SO4固体自我诊断D 4、2SO2(g)+O2(g)是制备硫酸的重要反应。下列叙述正确的是( )
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强、反应速度一定增大
C.该反应是放热反应,降低温度将缩短反应达 到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2,
则时间间隔t1~t2内,SO3(g)生成的平均速率为v =2SO3(g)V2O5自我诊断D反应A(g)+B(g) C(g)+D(g)
过程中的能量变化如图所示,回答下列
问题。
(1)该反应是________反应(填“吸热”“放热”);
(2)反应体系中加入催化剂对反应热是否有影响? _______原因是————————————————————————————————————
————————————————————————————————————————— (3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小”“不变”)。
A(g)+B(g)C(g)+D(g)E1E2能量反应历程放热没有催化剂只能改变化学反应的速率和途径,不能改变化学
反应的始态和终态的能量,因此对反应热没有影响 减小减小自我诊断5、A(g)+B(g)能量A(g)+B(g)能量A(g)+B(g)能量A(g)+B(g)E2能量A(g)+B(g)E1E2能量A(g)+B(g)C(g)+D(g)E1E2能量A(g)+B(g)
外界条件、速率与平衡是否移动的关系
外界条件改变,速率一定变化吗?
速率改变了,平衡一定移动吗?
平衡发生移动,反应速率一定变化吗?精华提炼
外界条件、速率与平衡是否移动的关系
外界条件改变,速率一定变化吗?
速率改变了,平衡一定移动吗?
平衡发生移动,反应速率一定变化吗?a.改变化学平衡体系中固体或纯液体的物质的量时
b.恒温、恒容下充入惰性气体不一定不一定a平衡后加入催化剂
B等体反应加压一定因为速率的改变是平衡移动的本质精华提炼
