鲁科版高中 化学 选修3 第2章 第1节 共价键模型(共25张ppt)
文档属性
| 名称 | 鲁科版高中 化学 选修3 第2章 第1节 共价键模型(共25张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-01 19:08:58 | ||
图片预览





文档简介
课件25张PPT。共价键模型 第3课时 键参数微检测下列物质中含有非极性共价键的是 ( )
含有极性共价键的是( )
?、O2
?、NH3
?、HF
?、NaOH
?、MgCl2
?、H2O2
?、Na2O2
?、C2H4
?????????一、学习目标
1、知识与技能:
(1)、认识并理解键能、键长、键角等键参数的概念;
(2)、能用键参数说明简单分子的某些性质;
2、过程与方法:
(1)、通过提供图表等信息,进一步培养学生的数据处理能力和分析能力;
(2)、提供比例模型、球棍模型图让学生更加直观的理解键角等知识;
3、情感态度与价值观
进一步建立从宏观到微观的关系,初步培养学生的空间思维想象能力。
二、教学重难点
(1)、重点:键能的概念及用键参数分析简单分子的某些性质。
(2)、难点:用键参数分析分子的某些性质及用键参数分析
分子的空间构型。
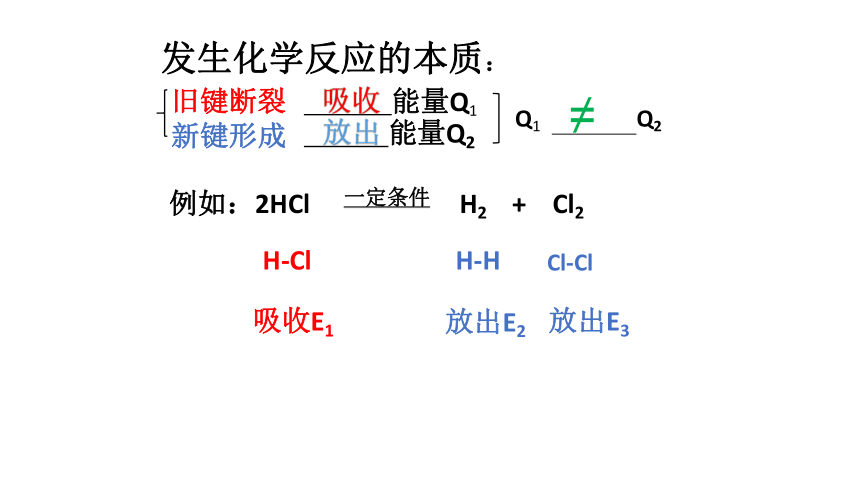
氯化氢、碘化氢的分子结构非常相似,它们都是双原子分子,分子中都只有一个共价键,但它们表现出来的稳定性却大不一样。例如,在1000℃时,只有0.001%的氯化氢分解生成氢气和氯气,却有高达33%的碘化氢分解 为氢气和单质碘。这是为什么?联想·质疑发生化学反应的本质:旧键断裂
新键形成 能量Q1 能量Q2Q1 Q2例如:2HCl H2 + Cl2一定条件 H-Cl
H-HCl-Cl吸收E1放出E2放出E3吸收放出≠ 1、键能:在101.3KPa、298K条件下,断开1molAB(g)分子中的化学键,使其分别生成气态A原子和气态B原子所吸收的能量或气态基态原子形成1molAB(g)分子中的化学键时所释放的能量。实验测得下列过程在101.3KPa、298K时所吸收或放出的能量E分别为:
HCl(g)→H(g)+Cl(g) E1=431KJ·mol-1
2H(g)→H2(g) E2=436KJ·mol-1
2Cl(g)→ Cl2(g) E3=243KJ·mol-1
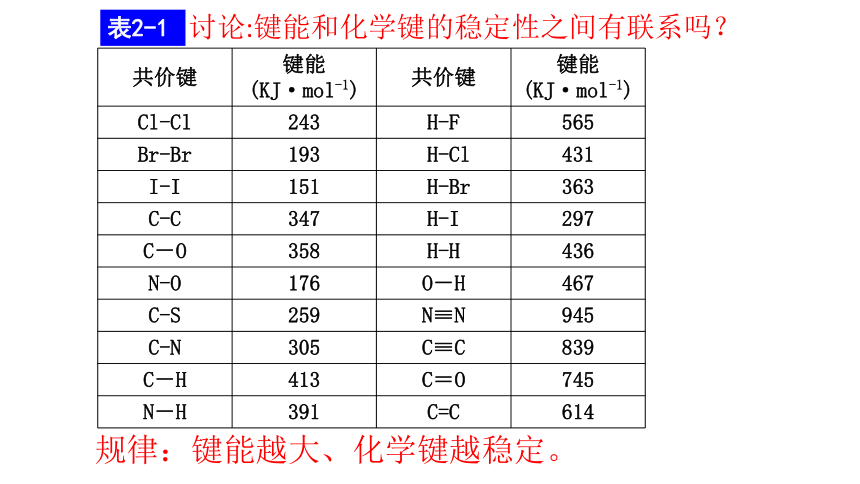
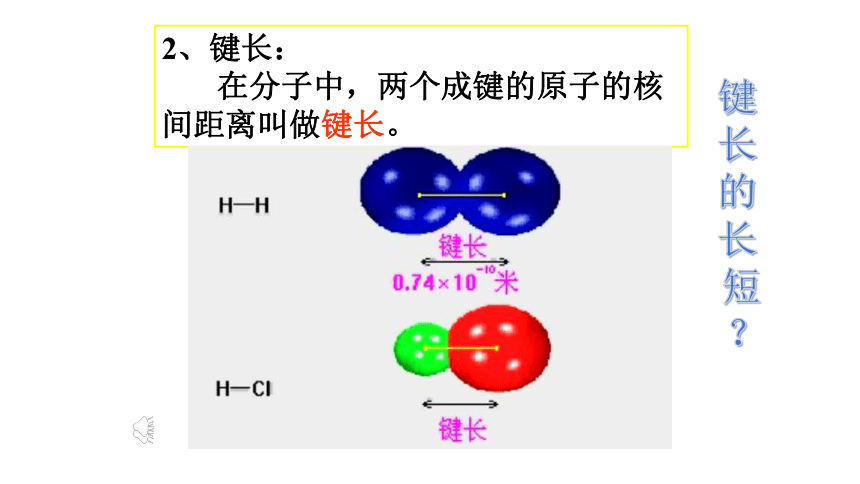
键参数讨论:键能和化学键的稳定性之间有联系吗?规律:键能越大、化学键越稳定。表2-12、键长:
在分子中,两个成键的原子的核间距离叫做键长。键
长
的
长
短
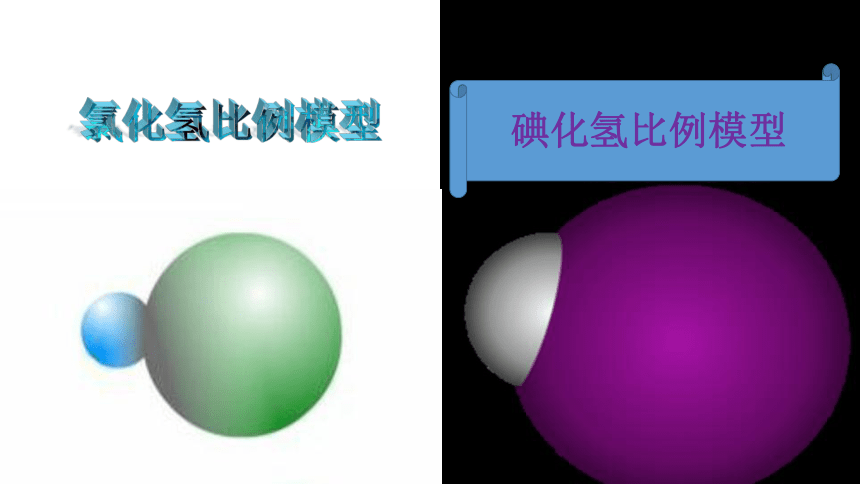
?碘化氢比例模型氯化氢比例模型某些共价键键能(kJ·mol-1)键长(nm )(1nm=10-9m)表2-2规律:键能越大、键长越短, 化学键越稳定。键
长
影
响
键
的
稳
定
性
吗
?形形色色的分子甲烷结构式:探究:甲烷的空间构型√×3、键角:两个共价键之间的夹角了解常见分子的空间构型109.5o
(1)、甲烷(CH4)正四面体(2)、二氧化碳(CO2)180o直
线
型(3)、水(H2O)104.5ov型(4)、氨气(NH3)三角锥型107.3°104.5° 107.3°109.5°键角常用于描述多原子分子的空间构型180 ° V型 直线型 三角锥型 正四面体四面体键长、
}你学到了什么?
键能越大、键长越短,分子越稳定键
参
数为什么碘化氢比氯化氢更易分解?
你找到答案了吗?1、关于键能、键长 和键角下列说法不正确的是( )
A、键能越小,共价化合物越稳定
B、键长越短,共价化合物越稳定
C、键角是描述分子立体结构的重要参数
D、键角的大小与键能、键长的大小无关A课堂练习课堂练习2、下列共价键的键能最大的是:( )B3、下列共价键中键长最短的是( )D课堂练习4、比较下列分子的稳定性 Cl2 Br2 I2 >>课堂练习5、下列说法错误的是:( )
A、CO2为键角为1800
B、H2O为V型分子
C、CCl4的空间构型为正四面体
D、CH3Br的空间构型为正四面体D课堂练习用橡皮泥和木棍制作CH4、H2O、
CO2、NH3、CH3Cl的球棍模型课后作业
含有极性共价键的是( )
?、O2
?、NH3
?、HF
?、NaOH
?、MgCl2
?、H2O2
?、Na2O2
?、C2H4
?????????一、学习目标
1、知识与技能:
(1)、认识并理解键能、键长、键角等键参数的概念;
(2)、能用键参数说明简单分子的某些性质;
2、过程与方法:
(1)、通过提供图表等信息,进一步培养学生的数据处理能力和分析能力;
(2)、提供比例模型、球棍模型图让学生更加直观的理解键角等知识;
3、情感态度与价值观
进一步建立从宏观到微观的关系,初步培养学生的空间思维想象能力。
二、教学重难点
(1)、重点:键能的概念及用键参数分析简单分子的某些性质。
(2)、难点:用键参数分析分子的某些性质及用键参数分析
分子的空间构型。
氯化氢、碘化氢的分子结构非常相似,它们都是双原子分子,分子中都只有一个共价键,但它们表现出来的稳定性却大不一样。例如,在1000℃时,只有0.001%的氯化氢分解生成氢气和氯气,却有高达33%的碘化氢分解 为氢气和单质碘。这是为什么?联想·质疑发生化学反应的本质:旧键断裂
新键形成 能量Q1 能量Q2Q1 Q2例如:2HCl H2 + Cl2一定条件 H-Cl
H-HCl-Cl吸收E1放出E2放出E3吸收放出≠ 1、键能:在101.3KPa、298K条件下,断开1molAB(g)分子中的化学键,使其分别生成气态A原子和气态B原子所吸收的能量或气态基态原子形成1molAB(g)分子中的化学键时所释放的能量。实验测得下列过程在101.3KPa、298K时所吸收或放出的能量E分别为:
HCl(g)→H(g)+Cl(g) E1=431KJ·mol-1
2H(g)→H2(g) E2=436KJ·mol-1
2Cl(g)→ Cl2(g) E3=243KJ·mol-1
键参数讨论:键能和化学键的稳定性之间有联系吗?规律:键能越大、化学键越稳定。表2-12、键长:
在分子中,两个成键的原子的核间距离叫做键长。键
长
的
长
短
?碘化氢比例模型氯化氢比例模型某些共价键键能(kJ·mol-1)键长(nm )(1nm=10-9m)表2-2规律:键能越大、键长越短, 化学键越稳定。键
长
影
响
键
的
稳
定
性
吗
?形形色色的分子甲烷结构式:探究:甲烷的空间构型√×3、键角:两个共价键之间的夹角了解常见分子的空间构型109.5o
(1)、甲烷(CH4)正四面体(2)、二氧化碳(CO2)180o直
线
型(3)、水(H2O)104.5ov型(4)、氨气(NH3)三角锥型107.3°104.5° 107.3°109.5°键角常用于描述多原子分子的空间构型180 ° V型 直线型 三角锥型 正四面体四面体键长、
}你学到了什么?
键能越大、键长越短,分子越稳定键
参
数为什么碘化氢比氯化氢更易分解?
你找到答案了吗?1、关于键能、键长 和键角下列说法不正确的是( )
A、键能越小,共价化合物越稳定
B、键长越短,共价化合物越稳定
C、键角是描述分子立体结构的重要参数
D、键角的大小与键能、键长的大小无关A课堂练习课堂练习2、下列共价键的键能最大的是:( )B3、下列共价键中键长最短的是( )D课堂练习4、比较下列分子的稳定性 Cl2 Br2 I2 >>课堂练习5、下列说法错误的是:( )
A、CO2为键角为1800
B、H2O为V型分子
C、CCl4的空间构型为正四面体
D、CH3Br的空间构型为正四面体D课堂练习用橡皮泥和木棍制作CH4、H2O、
CO2、NH3、CH3Cl的球棍模型课后作业
