鲁科版高中 化学 选修3 3.3金属晶体与离子晶体(共17张ppt)
文档属性
| 名称 | 鲁科版高中 化学 选修3 3.3金属晶体与离子晶体(共17张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 829.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-10 21:19:23 | ||
图片预览





文档简介
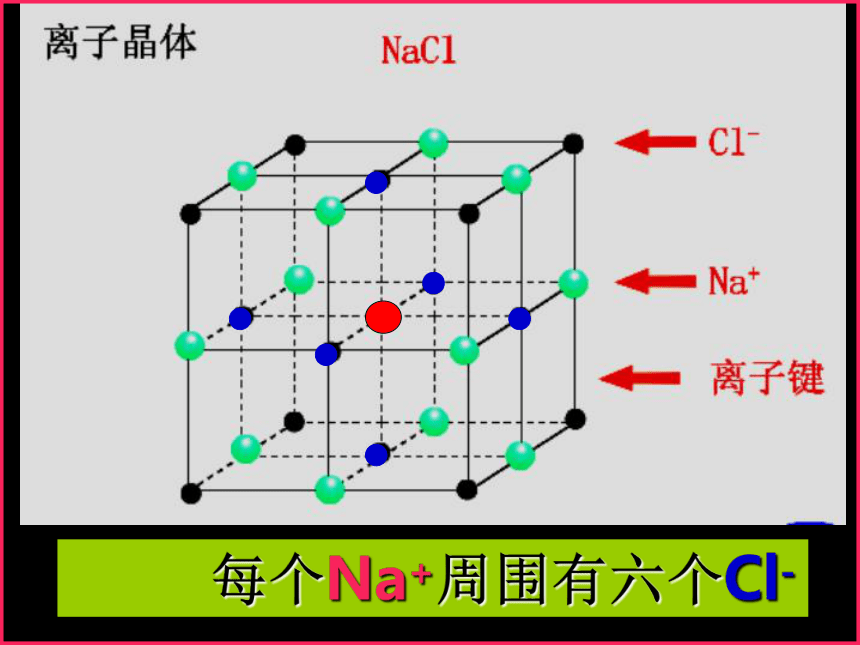
课件17张PPT。1、定义:由阳离子和阴离子通过离子键结合而成的晶体。2、成键微粒:阴、阳离子3、微粒间相互作用力:离子键4、常见的离子晶体:强碱、活泼金属氧化物、大部分的盐类第二节 离子晶体一、离子晶体氯化钠型晶胞 每个Na+周围有六个Cl- 每个Cl-周围有六个Na+计算氯化钠晶胞中含有的离子个数氯离子个数:8×1/8 + 6×1/2 = 4
钠离子个数:1 + 12×1/4=4 ——拥有4个氯离子,4个钠离子。Cl—:Na+ = 1 : 1氯化钠晶体的一个晶胞中,所以氯化钠化学式表示为: Na Cl
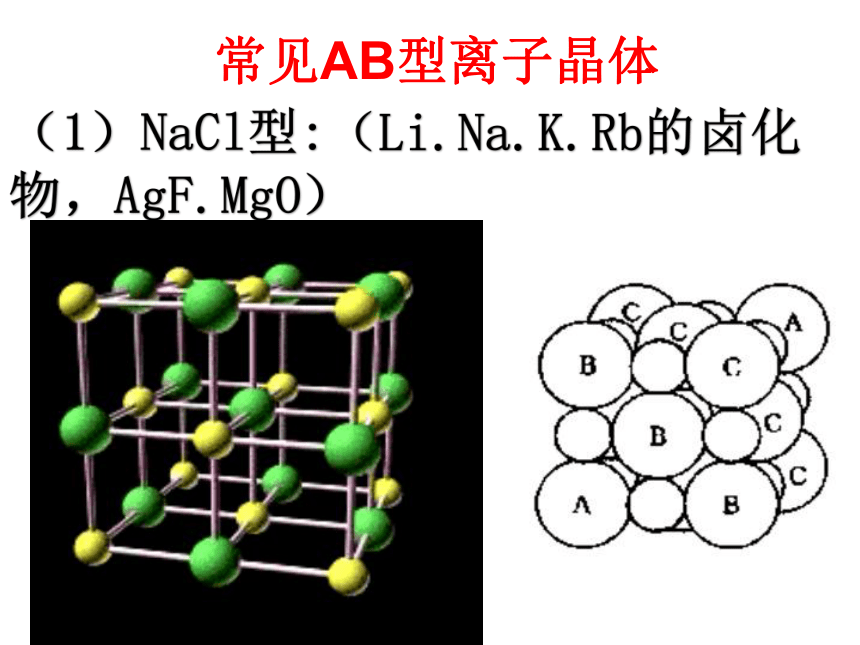
“Na Cl”只表示组成,不表示单独的分子(1)NaCl型:(Li.Na.K.Rb的卤化物,AgF.MgO)常见AB型离子晶体① 钠离子和氯离子的位置:钠离子:体心和棱中点;氯离子:面心和顶点。或者反之。③ Na+ 与Cl- 的配位数:② 每个晶胞含钠离子、
氯离子的个数:均为4离子晶体中离子的配位数是指一个离子周围
最邻近的异电性离子的数目均为6无单个分子存在;NaCl不表示分子式。12④在氯化钠晶体中,若钠离子与周围最近的氯离子距离为a,那么每个钠离子周围最近且等距离的钠离子有 个,其距离为 。(2)氯化铯型晶胞①铯离子和氯离子的位置:铯离子:体心;氯离子:顶点。或反之。②每个晶胞含铯离子、氯离子的个数:均为1③Cs+ 与Cl- 的配位数:均为8④在氯化铯晶体中,每个铯离子周围最近且等距离的铯离子有 ____个,每个氯离子周围最近且等距离的氯离子有____个。66②Zn2+、S2-的配位数:① 每个ZnS晶胞中含阴、阳离子: (3)ZnS型晶胞均为4均为4 为什么NaCl的熔沸点比CsCl高?交流与讨论结论:
对于组成和结构相似的物质,阴阳离子半径越小,离子键越强,熔沸点较高,晶体越稳定。 离子键的强弱在一定程度上可以用离子晶体的晶格能来衡量。二、晶格能1、定义:气态离子形成1mol离子晶体时释放的能量。分析表3—8,分析晶格能的大小与离子晶体的熔点有什么关系?
离子晶体的晶格能与哪些因素有关?(2)晶格能与阴、阳离子间的距离成反比。(1)晶格能的大小与阴、阳离子所带电荷的乘积成正比,晶格能越大,形成的离子晶体越稳定;
(离子键越强)熔点越高;硬度越大。1、下表列出了有关晶体的知识,其中错误的是( )
2、离子晶体熔点的高低决定于阴、阳离子核间距离和晶格能的大小,据所学知识判断KCl、NaCl、CaO、BaO四种晶体熔点的高低顺序是 ( )
A.KCl>NaCl>BaO>CaO B.NaCl>KCl>CaO>BaO
C.CaO>BaO>KCl>NaCl D.CaO>BaO>NaCl>KCl◆离子晶体的特点?
●无单个分子存在。如NaCl 和CsCl不是表示分子式。
●一般易溶于水,难溶于非极性溶剂。
●熔沸点较高,硬度较大,难挥发难压缩。
●固态时不导电,水溶液或者熔融状态下均导电。
小结:离子晶体是阴阳离子通过离子键结合而成的晶体 。 离子晶体的结构型式可归纳为不等径圆球的密堆积。 离子晶体的性质主要由晶格能决定。
“Na Cl”只表示组成,不表示单独的分子(1)NaCl型:(Li.Na.K.Rb的卤化物,AgF.MgO)常见AB型离子晶体① 钠离子和氯离子的位置:钠离子:体心和棱中点;氯离子:面心和顶点。或者反之。③ Na+ 与Cl- 的配位数:② 每个晶胞含钠离子、
氯离子的个数:均为4离子晶体中离子的配位数是指一个离子周围
最邻近的异电性离子的数目均为6无单个分子存在;NaCl不表示分子式。12④在氯化钠晶体中,若钠离子与周围最近的氯离子距离为a,那么每个钠离子周围最近且等距离的钠离子有 个,其距离为 。(2)氯化铯型晶胞①铯离子和氯离子的位置:铯离子:体心;氯离子:顶点。或反之。②每个晶胞含铯离子、氯离子的个数:均为1③Cs+ 与Cl- 的配位数:均为8④在氯化铯晶体中,每个铯离子周围最近且等距离的铯离子有 ____个,每个氯离子周围最近且等距离的氯离子有____个。66②Zn2+、S2-的配位数:① 每个ZnS晶胞中含阴、阳离子: (3)ZnS型晶胞均为4均为4 为什么NaCl的熔沸点比CsCl高?交流与讨论结论:
对于组成和结构相似的物质,阴阳离子半径越小,离子键越强,熔沸点较高,晶体越稳定。 离子键的强弱在一定程度上可以用离子晶体的晶格能来衡量。二、晶格能1、定义:气态离子形成1mol离子晶体时释放的能量。分析表3—8,分析晶格能的大小与离子晶体的熔点有什么关系?
离子晶体的晶格能与哪些因素有关?(2)晶格能与阴、阳离子间的距离成反比。(1)晶格能的大小与阴、阳离子所带电荷的乘积成正比,晶格能越大,形成的离子晶体越稳定;
(离子键越强)熔点越高;硬度越大。1、下表列出了有关晶体的知识,其中错误的是( )
2、离子晶体熔点的高低决定于阴、阳离子核间距离和晶格能的大小,据所学知识判断KCl、NaCl、CaO、BaO四种晶体熔点的高低顺序是 ( )
A.KCl>NaCl>BaO>CaO B.NaCl>KCl>CaO>BaO
C.CaO>BaO>KCl>NaCl D.CaO>BaO>NaCl>KCl◆离子晶体的特点?
●无单个分子存在。如NaCl 和CsCl不是表示分子式。
●一般易溶于水,难溶于非极性溶剂。
●熔沸点较高,硬度较大,难挥发难压缩。
●固态时不导电,水溶液或者熔融状态下均导电。
小结:离子晶体是阴阳离子通过离子键结合而成的晶体 。 离子晶体的结构型式可归纳为不等径圆球的密堆积。 离子晶体的性质主要由晶格能决定。
