人教版(五四制)九年级化学 第三单元 酸和碱单元复习 课件(21张ppt)
文档属性
| 名称 | 人教版(五四制)九年级化学 第三单元 酸和碱单元复习 课件(21张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 378.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-01 16:50:56 | ||
图片预览








文档简介
课件21张PPT。酸 和 碱
单元复习学习目标
1、会用酸碱指示剂和PH试纸检验溶液酸碱性的方法。
2、掌握常见酸碱(盐酸、硫酸、氢氧化钠、氢氧化钙等)的主要性质和用途,初步认识酸碱的腐蚀性。
3、掌握酸碱的化学性质。
4、初步学会常见酸碱溶液的稀释方法。
5、知道酸碱性对人体健康和农作物生长的主要影响。复习目标一1、学生能说出酸碱指示剂(石蕊、酚酞)遇酸碱显示不同的颜色。
2、学会用酸碱指示剂检验溶液的酸碱性。复习指导一1、复习内容:课本P50 —P51,回顾石蕊和酚酞遇酸碱显示不同的颜色。
2、复习方式:快速读记。
3、复习时间:1分钟
复习检测一1、石蕊和酚酞是 两种常见的指示剂。
石蕊本身为 色,遇酸显 遇碱显 。
酚酞本身为 色,遇酸显 遇碱显 遇中性溶液 2、(14苏州)下列生活中的常见物质能使无色酚酞试液变红的是( )
A.食醋 B.柠檬汁 C.食盐水 D.肥皂水
3、能使无色酚酞试液变红的溶液可使紫色石蕊溶液变 紫色红色蓝色无色无色红色无色D蓝色4、鉴别NaOH、NaCl、H2SO4用一种试剂是 。紫色石蕊试液复习目标二1、掌握常见酸(盐酸、硫酸)的主要性质和用途,初步认识酸的腐蚀性。
2、初步学会常见酸溶液的稀释方法。
复习指导二
1、复习内容:课本P52 –P54记住常见酸的组成及物理
性质和用途,知道浓硫酸的稀释方法,能说出酸的
化学性质。
2、复习方式:快速阅读识记并思考归纳总结。
3、时间:3分钟复习检测二1.浓盐酸和浓硫酸的物理性质无色无色液态黏稠、油状液体有刺激性气味无有无无有有有复习检测二1、纯净的硫酸是____ 色液体,不易挥发。浓硫酸有 性,所以可作干燥剂,浓硫酸对皮肤和衣服有很强的_______性。在稀释浓硫酸时,一定要把 _______沿 , _______注入水中,并用 _______ 不断搅拌。2、浓盐酸是 色液体,有 气味,打开浓盐酸瓶盖,会见到 ,原因是什么?
3、若浓盐酸质量为A,敞口放置一段时间后,测得其质量为B,则A B (填﹥﹤ =,下同);若浓硫酸质量分数为A,敞口放置一段时间后,测得其质量分数为B,则A B
4、一根生锈的铁钉,长时间浸泡在稀盐酸中,开始会看到
, 化学方程式为
, 过一会又看到
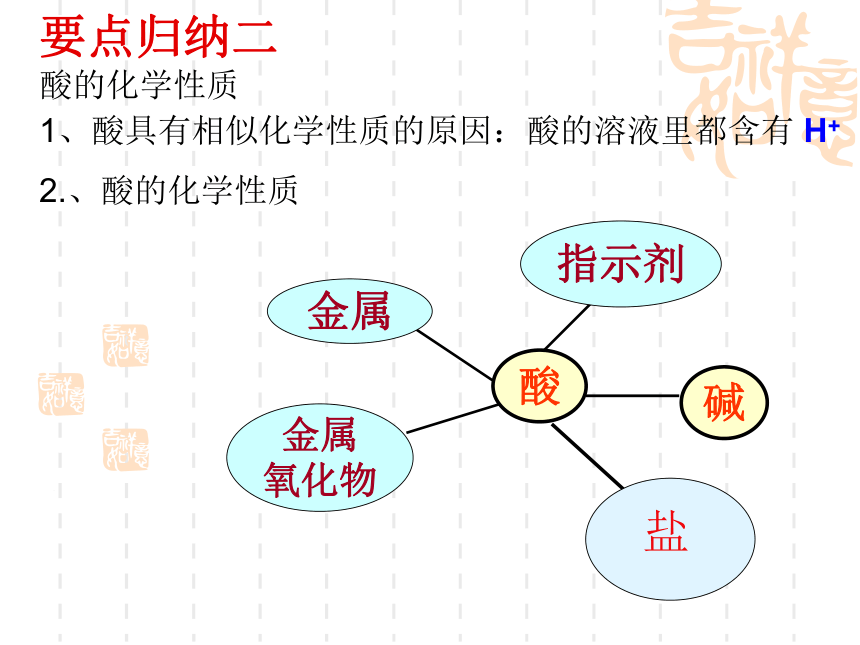
,化学方程式为 。无色吸水腐蚀性浓硫酸器壁慢慢玻璃棒无刺激性白雾>>红色铁锈逐渐消失,溶液有无色变成黄色Fe2O3+6HCl=2FeCl3+3H2O有气泡生成Fe+2HCl=FeCl2+H2 ↑要点归纳二 酸的化学性质盐1、酸具有相似化学性质的原因:
2.、酸的化学性质酸的溶液里都含有 H+复习目标三 1、掌握常见碱(氢氧化钠、氢氧化钙)的性质和用途,初步认识碱的腐蚀性,知道它们的俗名 2、掌握碱的通性。 3、知道溶液不一定导电而酸碱盐的水溶液都导电复习指导三
复习内容:识记课本P55 –P57
复习方式:快速阅读记忆
复习时间:3分钟NaOHCa(OH)2苛性钠、火碱、烧碱熟石灰、消石灰白色、片状固体白色、粉末露置在空气中,能吸收水分而潮解,有吸水性不明显易溶于水,
并放出大量的热微溶于水强腐蚀性有腐蚀性CaO+H2O=Ca(OH)2复习检测三 1、填空:2、2、生活中的一些物质中含有碱,石灰水中含有 ,
炉具清洁剂中含有 , 氢氧化钠是一种重要的化工原料,广泛用于 ,还能与
,在生活中可用来去除 。熟石灰可用来改良 土壤 ,在树木上涂刷含有 ,
可保护树木;还可与 配制农药波尔多液;还是建筑上的一种材料。
3、氢氧化钠在空气中密封保存的原因是什么?
4、怎样鉴别石灰水和氢氧化钠溶液?Ca(OH)2NaOH肥皂、石油、造纸、纺织和印染等工业油脂反应油污酸性硫磺粉的石灰浆硫酸铜氢氧化钠固体吸收空气中的水分而潮解,还能与空气中的二氧化碳反应而变质。①通入CO2 ②滴Na2CO3 溶液要点归纳三 碱的化学性质1、碱有一些相似的化学性质,其原因是不同的碱溶液中含有相同的_____。OH –2、碱的化学性质(1)碱溶液和酸碱指示剂作用(2)碱溶液和非金属氧化物反应Ca(OH)2+CO2=
NaOH+CO2=
NaOH+SO2=3、碱和酸反应4、碱和盐反应Ca(OH)2+Na2CO3 =CaCO3↓+H2O2Na2CO3+H2O2Na2SO3+H2OCaCO3↓+2NaOH复习目标四 1、知道酸和碱会发生中和反应,知道中和反应的实质。 2、知道中和反应在实际中的应用。复习指导四
1、复习内容:课本P60 -P61 中和反应的定义及中和反应在实际
生活中的应用
2、复习方式:学生自主复习,读记。
3、复习时间:2分钟复习检测四
1、酸和碱反应生成盐和水,我们把酸和碱的反应叫 。
2、下列物质间的作用不属于中和反应的是( )
A、Cu(OH)2 H2SO4 B、Mg(OH)2 HCl
C、NaOH HNO3 D、Ca(OH)2 CO2
3、可以用熟石灰中和硫酸厂的污水,其反应方程式为
服用氢氧化镁或氢氧化铝的药物可中和胃酸过多,其化学方程式 。
.
蚊虫叮咬人体皮肤后,会分泌出 ,从而使人皮肤肿痛,若涂抹一些 性物质,就会减轻痛痒。中和反应DCa(OH)2+H2SO4=CaSO4+2H2OMg(OH)2+2HCl=MgCl2+2H2OAl(OH)3+3HCl=AlCl3+3H2O蚁酸碱性要点归纳四1、酸碱中和反应的实质是: 。
2、中和反应在实际生产中的应用:H+ +OH- =H2O 1、农业上:改变土壤的酸碱性,如熟石灰改良酸性土壤。
2、工业上:处理工厂排出的废水,用熟石灰处理硫酸厂排出的废水。
3、生活上:医药。胃液分泌过多。如胃舒平里含有Al(OH)3 中和过多胃酸(HCl).复习目标五
1、学会用PH试纸检验溶液的酸碱性。
2、知道酸碱性对人体健康和农作物的影响。复习指导五
1、复习内容:课本P61-P64,知道溶液的酸碱度用PH表示,知道测定PH最简单的方法及酸碱性对生活、生产以及人类生命活动具有的意义。
2、复习方式:快速阅读识记。
3、复习时间:2分钟。
复习检测五
1、溶液的酸碱性常用________________来测出.酸碱指示剂 2、溶液的酸程度常用________来表示.
3、酸性溶液的PH 7,中性溶液的PH 7,碱性溶液的PH 7。测定PH最简单的方法是使用 ,测定方法是:
4、如果在测碱溶液时先把PH试纸用水润湿,然后再测该溶液的PH,这样会导致所得的结果 (填偏大、偏小或不变)
5、实验测得人体内一些液体的PH如下,期中酸性最强的是( )
A、唾液 6.6~7.1 B、胃液 0.9~1.5
C、汗液 6.6~7.6 D、血浆 7.35~7.45pH用洁净的玻璃棒蘸取待测液到PH试纸上,半分钟后与比色卡对照,估读出PH值,整数。﹤=﹥PH试纸偏小B归纳总结五 酸碱度的范围 正常雨水的PH约为5.6,因为CO2+H2O=H2CO3
小于5.6的雨水为酸雨。强化训练五【题1】有一瓶无色溶液的PH是4.5,取少量注入试管中,再滴入几滴酚酞试液,溶液呈______色,如果要使试管中溶液的PH升为10,可以采取______________________的方法。无滴加碱溶液【题2】有一瓶无色溶液的PH是9.5,取少量注入试管中,再滴入几滴酚酞试液,溶液呈______色,如果要使试管中溶液的PH降为5,可以采取______________________的方法。红滴加酸溶液中考链接1.(13河南)物质的性质和用途是化学研究的重要内容。(1)浓硫酸有吸水性,在实验室中常用它做 剂。(2)用石灰浆粉刷墙壁,干燥后墙面就变硬了,请用化学原理解释该现象。2.(14河南)NaOH是化学实验中常用的试剂。 (1)将某NaOH溶液逐滴滴人一定量的某盐酸中,
右边图像合理的是________(填“甲”或“乙”)。 (2)向长期敞口放置的NaOH溶液中滴加盐酸时,
意外发现有气泡产生,请解释其原因。 (3)向足量某NaOH溶液中通入CO2,反应后溶液中的溶质可能只有Na2CO3,
也可能还有NaOH,请设计实验检验溶质的成分,简要写出实验步骤、现象和结论。3、(10河南)下列区分物质的试剂或方法不正确的是 【 】 A.用水区分氯化钙和碳酸钙 B.用闻气味的方法区分白酒和白醋 C.用盐酸区分黄金和黄铜(含锌) D.用酚酞溶液区分氯化钠溶液和盐酸4.(14开封一模)下列气体中,既能用固体NaOH干燥又能用浓H2SO4干燥的是( )
A. CO2 B. HCl C. SO2 D. O2干燥乙D D再见!
单元复习学习目标
1、会用酸碱指示剂和PH试纸检验溶液酸碱性的方法。
2、掌握常见酸碱(盐酸、硫酸、氢氧化钠、氢氧化钙等)的主要性质和用途,初步认识酸碱的腐蚀性。
3、掌握酸碱的化学性质。
4、初步学会常见酸碱溶液的稀释方法。
5、知道酸碱性对人体健康和农作物生长的主要影响。复习目标一1、学生能说出酸碱指示剂(石蕊、酚酞)遇酸碱显示不同的颜色。
2、学会用酸碱指示剂检验溶液的酸碱性。复习指导一1、复习内容:课本P50 —P51,回顾石蕊和酚酞遇酸碱显示不同的颜色。
2、复习方式:快速读记。
3、复习时间:1分钟
复习检测一1、石蕊和酚酞是 两种常见的指示剂。
石蕊本身为 色,遇酸显 遇碱显 。
酚酞本身为 色,遇酸显 遇碱显 遇中性溶液 2、(14苏州)下列生活中的常见物质能使无色酚酞试液变红的是( )
A.食醋 B.柠檬汁 C.食盐水 D.肥皂水
3、能使无色酚酞试液变红的溶液可使紫色石蕊溶液变 紫色红色蓝色无色无色红色无色D蓝色4、鉴别NaOH、NaCl、H2SO4用一种试剂是 。紫色石蕊试液复习目标二1、掌握常见酸(盐酸、硫酸)的主要性质和用途,初步认识酸的腐蚀性。
2、初步学会常见酸溶液的稀释方法。
复习指导二
1、复习内容:课本P52 –P54记住常见酸的组成及物理
性质和用途,知道浓硫酸的稀释方法,能说出酸的
化学性质。
2、复习方式:快速阅读识记并思考归纳总结。
3、时间:3分钟复习检测二1.浓盐酸和浓硫酸的物理性质无色无色液态黏稠、油状液体有刺激性气味无有无无有有有复习检测二1、纯净的硫酸是____ 色液体,不易挥发。浓硫酸有 性,所以可作干燥剂,浓硫酸对皮肤和衣服有很强的_______性。在稀释浓硫酸时,一定要把 _______沿 , _______注入水中,并用 _______ 不断搅拌。2、浓盐酸是 色液体,有 气味,打开浓盐酸瓶盖,会见到 ,原因是什么?
3、若浓盐酸质量为A,敞口放置一段时间后,测得其质量为B,则A B (填﹥﹤ =,下同);若浓硫酸质量分数为A,敞口放置一段时间后,测得其质量分数为B,则A B
4、一根生锈的铁钉,长时间浸泡在稀盐酸中,开始会看到
, 化学方程式为
, 过一会又看到
,化学方程式为 。无色吸水腐蚀性浓硫酸器壁慢慢玻璃棒无刺激性白雾>>红色铁锈逐渐消失,溶液有无色变成黄色Fe2O3+6HCl=2FeCl3+3H2O有气泡生成Fe+2HCl=FeCl2+H2 ↑要点归纳二 酸的化学性质盐1、酸具有相似化学性质的原因:
2.、酸的化学性质酸的溶液里都含有 H+复习目标三 1、掌握常见碱(氢氧化钠、氢氧化钙)的性质和用途,初步认识碱的腐蚀性,知道它们的俗名 2、掌握碱的通性。 3、知道溶液不一定导电而酸碱盐的水溶液都导电复习指导三
复习内容:识记课本P55 –P57
复习方式:快速阅读记忆
复习时间:3分钟NaOHCa(OH)2苛性钠、火碱、烧碱熟石灰、消石灰白色、片状固体白色、粉末露置在空气中,能吸收水分而潮解,有吸水性不明显易溶于水,
并放出大量的热微溶于水强腐蚀性有腐蚀性CaO+H2O=Ca(OH)2复习检测三 1、填空:2、2、生活中的一些物质中含有碱,石灰水中含有 ,
炉具清洁剂中含有 , 氢氧化钠是一种重要的化工原料,广泛用于 ,还能与
,在生活中可用来去除 。熟石灰可用来改良 土壤 ,在树木上涂刷含有 ,
可保护树木;还可与 配制农药波尔多液;还是建筑上的一种材料。
3、氢氧化钠在空气中密封保存的原因是什么?
4、怎样鉴别石灰水和氢氧化钠溶液?Ca(OH)2NaOH肥皂、石油、造纸、纺织和印染等工业油脂反应油污酸性硫磺粉的石灰浆硫酸铜氢氧化钠固体吸收空气中的水分而潮解,还能与空气中的二氧化碳反应而变质。①通入CO2 ②滴Na2CO3 溶液要点归纳三 碱的化学性质1、碱有一些相似的化学性质,其原因是不同的碱溶液中含有相同的_____。OH –2、碱的化学性质(1)碱溶液和酸碱指示剂作用(2)碱溶液和非金属氧化物反应Ca(OH)2+CO2=
NaOH+CO2=
NaOH+SO2=3、碱和酸反应4、碱和盐反应Ca(OH)2+Na2CO3 =CaCO3↓+H2O2Na2CO3+H2O2Na2SO3+H2OCaCO3↓+2NaOH复习目标四 1、知道酸和碱会发生中和反应,知道中和反应的实质。 2、知道中和反应在实际中的应用。复习指导四
1、复习内容:课本P60 -P61 中和反应的定义及中和反应在实际
生活中的应用
2、复习方式:学生自主复习,读记。
3、复习时间:2分钟复习检测四
1、酸和碱反应生成盐和水,我们把酸和碱的反应叫 。
2、下列物质间的作用不属于中和反应的是( )
A、Cu(OH)2 H2SO4 B、Mg(OH)2 HCl
C、NaOH HNO3 D、Ca(OH)2 CO2
3、可以用熟石灰中和硫酸厂的污水,其反应方程式为
服用氢氧化镁或氢氧化铝的药物可中和胃酸过多,其化学方程式 。
.
蚊虫叮咬人体皮肤后,会分泌出 ,从而使人皮肤肿痛,若涂抹一些 性物质,就会减轻痛痒。中和反应DCa(OH)2+H2SO4=CaSO4+2H2OMg(OH)2+2HCl=MgCl2+2H2OAl(OH)3+3HCl=AlCl3+3H2O蚁酸碱性要点归纳四1、酸碱中和反应的实质是: 。
2、中和反应在实际生产中的应用:H+ +OH- =H2O 1、农业上:改变土壤的酸碱性,如熟石灰改良酸性土壤。
2、工业上:处理工厂排出的废水,用熟石灰处理硫酸厂排出的废水。
3、生活上:医药。胃液分泌过多。如胃舒平里含有Al(OH)3 中和过多胃酸(HCl).复习目标五
1、学会用PH试纸检验溶液的酸碱性。
2、知道酸碱性对人体健康和农作物的影响。复习指导五
1、复习内容:课本P61-P64,知道溶液的酸碱度用PH表示,知道测定PH最简单的方法及酸碱性对生活、生产以及人类生命活动具有的意义。
2、复习方式:快速阅读识记。
3、复习时间:2分钟。
复习检测五
1、溶液的酸碱性常用________________来测出.酸碱指示剂 2、溶液的酸程度常用________来表示.
3、酸性溶液的PH 7,中性溶液的PH 7,碱性溶液的PH 7。测定PH最简单的方法是使用 ,测定方法是:
4、如果在测碱溶液时先把PH试纸用水润湿,然后再测该溶液的PH,这样会导致所得的结果 (填偏大、偏小或不变)
5、实验测得人体内一些液体的PH如下,期中酸性最强的是( )
A、唾液 6.6~7.1 B、胃液 0.9~1.5
C、汗液 6.6~7.6 D、血浆 7.35~7.45pH用洁净的玻璃棒蘸取待测液到PH试纸上,半分钟后与比色卡对照,估读出PH值,整数。﹤=﹥PH试纸偏小B归纳总结五 酸碱度的范围 正常雨水的PH约为5.6,因为CO2+H2O=H2CO3
小于5.6的雨水为酸雨。强化训练五【题1】有一瓶无色溶液的PH是4.5,取少量注入试管中,再滴入几滴酚酞试液,溶液呈______色,如果要使试管中溶液的PH升为10,可以采取______________________的方法。无滴加碱溶液【题2】有一瓶无色溶液的PH是9.5,取少量注入试管中,再滴入几滴酚酞试液,溶液呈______色,如果要使试管中溶液的PH降为5,可以采取______________________的方法。红滴加酸溶液中考链接1.(13河南)物质的性质和用途是化学研究的重要内容。(1)浓硫酸有吸水性,在实验室中常用它做 剂。(2)用石灰浆粉刷墙壁,干燥后墙面就变硬了,请用化学原理解释该现象。2.(14河南)NaOH是化学实验中常用的试剂。 (1)将某NaOH溶液逐滴滴人一定量的某盐酸中,
右边图像合理的是________(填“甲”或“乙”)。 (2)向长期敞口放置的NaOH溶液中滴加盐酸时,
意外发现有气泡产生,请解释其原因。 (3)向足量某NaOH溶液中通入CO2,反应后溶液中的溶质可能只有Na2CO3,
也可能还有NaOH,请设计实验检验溶质的成分,简要写出实验步骤、现象和结论。3、(10河南)下列区分物质的试剂或方法不正确的是 【 】 A.用水区分氯化钙和碳酸钙 B.用闻气味的方法区分白酒和白醋 C.用盐酸区分黄金和黄铜(含锌) D.用酚酞溶液区分氯化钠溶液和盐酸4.(14开封一模)下列气体中,既能用固体NaOH干燥又能用浓H2SO4干燥的是( )
A. CO2 B. HCl C. SO2 D. O2干燥乙D D再见!
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
