鲁科版 化学 选修3 1.3 原子结构与元素性质 元素的电负性及其变化规律(共19张ppt)
文档属性
| 名称 | 鲁科版 化学 选修3 1.3 原子结构与元素性质 元素的电负性及其变化规律(共19张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 300.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-03 09:58:31 | ||
图片预览






文档简介
课件19张PPT。1.什么是电离能。
2.符号和单位
3.意义想一想
1.定义:
2.符号: 单位:
表示式:
气态原子或气态离子失去一个电子所需要的
最小能量叫做电离能。IM(g)= M+ (g) + e- I1(第一电离能)3.意义:表示原子或离子失去电子的难易程度 电离能越小,该气态原子越容易失去电子 电离能越大,气态时该原子越难失去电子 故可判断金属原子在气态时失电子的难易程度 M+(g)= M2+ (g) + e- I2(第二电离能)M2+(g)= M3+ (g) + e- I3(第三电离能)KJ/mol 第3节?原子结构与元素性质
二、 元素的电负性及其变化规律想一想:1.为什么钠原子和氯原子形成
的是离子化合物?
2.那为什么氢原子和氯原子形
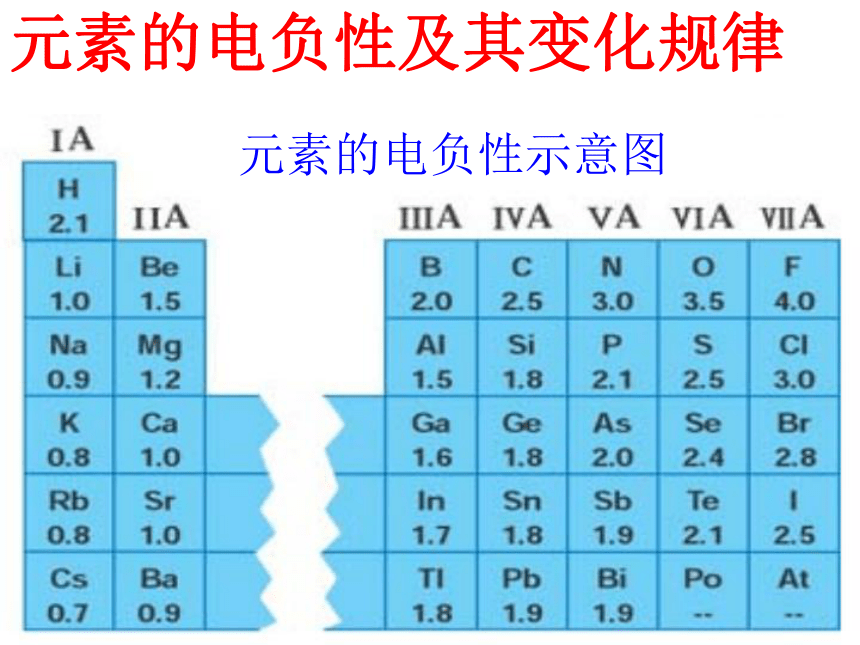
成的是共价化合物? 电负性是元素的原子在化合物中 的 能力的标度。元素的电负性越大,表示其原子在化合物中吸引电子的能力越强。1、电负性的概念:吸引电子1932年鲍林引入电负性的概念,用来表示当两个不同原子在形成化学键时吸引电子能力的相对强弱。元素的电负性及其变化规律元素的电负性示意图增 大减小 同一周期从左到右,主族元素电负性逐渐 ,表明其吸引电子的能力逐渐 。同一主族从上到下,元素电负性呈现 趋势,表明其吸引电子的能力逐渐 。2、电负性的递变规律:增 大减 小增 大减 小为什么?3、电负性的意义 反映了原子间的成键能力和成键类型。 一般认为,电负性 1.8的元素为非金属元素,电负性 1.8的元素为金属元素。小于大于 一般认为,如果两个成键元素间的电负性差值大于1.7,他们之间通常形成 键;如果两个成键元素间的电负性差值小于1.7,他们之间通常形成 键。规律与总结离 子共 价概念应用 请查阅下列化合物中元素的电负性值,判断他们哪些是离子化合物,哪些是共价化合物
NaF HCl NO MgO KCl CH4
离子化合物: 。
共价化合物: 。NaF、 MgO、 KClHCl、 NO、 CH4规律与总结 电负性小的元素在化合物中吸引电子的能力 ,元素的化合价为 值;电负性大的元素在化合物中吸引电子的能力 ,元素的化合价为 值。弱正强负概念应用 请查阅下列化合物中元素的电负性值,指出化合物中为正值的元素
NaH ICl NF3 SO2
H2S CH4 NH3 HBr1、下列各组元素按电负性由大到小顺序排列的是( ) A. F N O B. O Cl F C. As P H D. Cl S AsD2、下列哪个系列的排列顺序正好是电负性减小的顺序( ) A. K Na Li B. O Cl H C. As P H D. 三者都是B巩固练习4、下列不是元素电负性的应用的是( ) A.判断一种元素是金属还是非金属 B.判断化合物中元素化合价的正负 C.判断化学键的类型 D.判断化合物的溶解度D 3、电负性差值大的元素之间形成的化学键主要为( ) A.共价键 B.离子键 C.金属键 D.配位键B差值若为零时呢?巩固练习5、在下列空格中,填上适当的元素符号。 (1) 在第3周期中,第一电离能最小的元素是 ,第一电离能最大的元素是 ; 电负性最小的元素是 ,电负性最大的元素是 。 (2)在元素周期表中,第一电离能最小的元素是 ,第一电离能最大的元素是 ;电负性最小的元素是 ,电负性最大的元素是 。(不考虑放射性元素!) NaArClNaCsHeCsF巩固练习6、A、B、C、D四种元素,已知A元素是自然界中含量最多的元素;B元素为金属元素,已知它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第3周期第一电离能最小的元素,D元素在第3周期中电负性最大。
(1)试推断A、B、C、D四种元素的名称和符号。
(2)写出上述元素两两化合生成的离子化合物的 化学式。O CaNaClCaO Na2O Na2O2 CaCl2 NaCl巩固练习
2.符号和单位
3.意义想一想
1.定义:
2.符号: 单位:
表示式:
气态原子或气态离子失去一个电子所需要的
最小能量叫做电离能。IM(g)= M+ (g) + e- I1(第一电离能)3.意义:表示原子或离子失去电子的难易程度 电离能越小,该气态原子越容易失去电子 电离能越大,气态时该原子越难失去电子 故可判断金属原子在气态时失电子的难易程度 M+(g)= M2+ (g) + e- I2(第二电离能)M2+(g)= M3+ (g) + e- I3(第三电离能)KJ/mol 第3节?原子结构与元素性质
二、 元素的电负性及其变化规律想一想:1.为什么钠原子和氯原子形成
的是离子化合物?
2.那为什么氢原子和氯原子形
成的是共价化合物? 电负性是元素的原子在化合物中 的 能力的标度。元素的电负性越大,表示其原子在化合物中吸引电子的能力越强。1、电负性的概念:吸引电子1932年鲍林引入电负性的概念,用来表示当两个不同原子在形成化学键时吸引电子能力的相对强弱。元素的电负性及其变化规律元素的电负性示意图增 大减小 同一周期从左到右,主族元素电负性逐渐 ,表明其吸引电子的能力逐渐 。同一主族从上到下,元素电负性呈现 趋势,表明其吸引电子的能力逐渐 。2、电负性的递变规律:增 大减 小增 大减 小为什么?3、电负性的意义 反映了原子间的成键能力和成键类型。 一般认为,电负性 1.8的元素为非金属元素,电负性 1.8的元素为金属元素。小于大于 一般认为,如果两个成键元素间的电负性差值大于1.7,他们之间通常形成 键;如果两个成键元素间的电负性差值小于1.7,他们之间通常形成 键。规律与总结离 子共 价概念应用 请查阅下列化合物中元素的电负性值,判断他们哪些是离子化合物,哪些是共价化合物
NaF HCl NO MgO KCl CH4
离子化合物: 。
共价化合物: 。NaF、 MgO、 KClHCl、 NO、 CH4规律与总结 电负性小的元素在化合物中吸引电子的能力 ,元素的化合价为 值;电负性大的元素在化合物中吸引电子的能力 ,元素的化合价为 值。弱正强负概念应用 请查阅下列化合物中元素的电负性值,指出化合物中为正值的元素
NaH ICl NF3 SO2
H2S CH4 NH3 HBr1、下列各组元素按电负性由大到小顺序排列的是( ) A. F N O B. O Cl F C. As P H D. Cl S AsD2、下列哪个系列的排列顺序正好是电负性减小的顺序( ) A. K Na Li B. O Cl H C. As P H D. 三者都是B巩固练习4、下列不是元素电负性的应用的是( ) A.判断一种元素是金属还是非金属 B.判断化合物中元素化合价的正负 C.判断化学键的类型 D.判断化合物的溶解度D 3、电负性差值大的元素之间形成的化学键主要为( ) A.共价键 B.离子键 C.金属键 D.配位键B差值若为零时呢?巩固练习5、在下列空格中,填上适当的元素符号。 (1) 在第3周期中,第一电离能最小的元素是 ,第一电离能最大的元素是 ; 电负性最小的元素是 ,电负性最大的元素是 。 (2)在元素周期表中,第一电离能最小的元素是 ,第一电离能最大的元素是 ;电负性最小的元素是 ,电负性最大的元素是 。(不考虑放射性元素!) NaArClNaCsHeCsF巩固练习6、A、B、C、D四种元素,已知A元素是自然界中含量最多的元素;B元素为金属元素,已知它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第3周期第一电离能最小的元素,D元素在第3周期中电负性最大。
(1)试推断A、B、C、D四种元素的名称和符号。
(2)写出上述元素两两化合生成的离子化合物的 化学式。O CaNaClCaO Na2O Na2O2 CaCl2 NaCl巩固练习
