人教版(五四制)八年级全一册化学课件:3.2《原子的构成》(共32张PPT)
文档属性
| 名称 | 人教版(五四制)八年级全一册化学课件:3.2《原子的构成》(共32张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 310.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-05 13:25:03 | ||
图片预览









文档简介
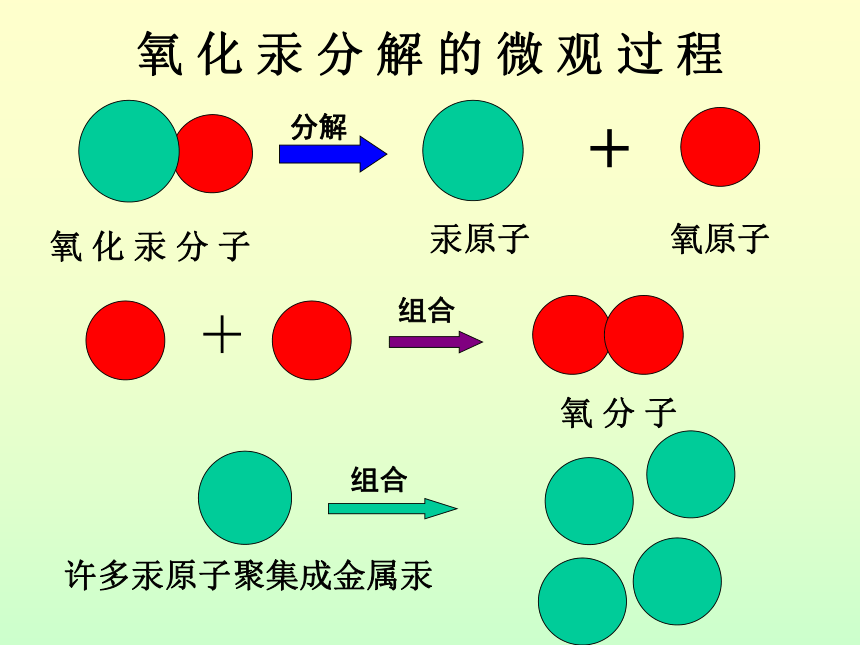
课件32张PPT。课题1 原子的构成 氧 化 汞 分 解 的 微 观 过 程
1.定义:原子是化学变化中的最小粒子。一、原子的构成 在化学反应里分子可以分为原子,原子不能再分,那么用其它方法能不能将原子再分呢?原子的结构究竟如何?请以“我想像中的原子”为题,提出你的想法。 1897年,在英国科学家汤姆生发现了电子以后,人们开始揭示了原子内部的秘密。经过20世纪整整一个世纪的努力,科学家不但打开了原子的大门,而且发现小小的原子内部结构十分复杂。播放:原子结构动画
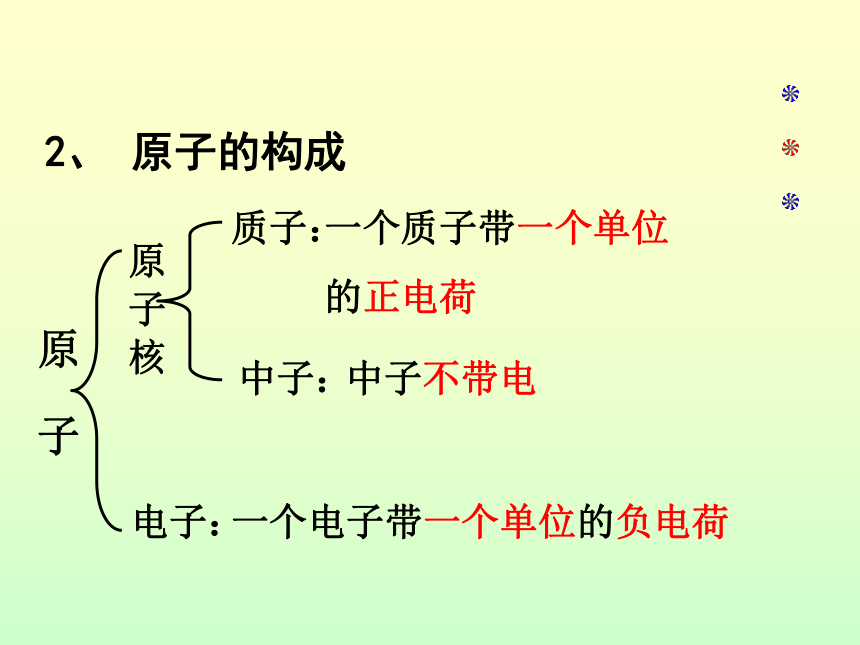
课题1 原子结构模型.swf质子:一个质子带一个单位
的正电荷中子:中子不带电电子:一个电子带一个单位的负电荷2、 原子的构成原 子原 子 核 质子:一个质子带一个单位的正电荷中子:中子不带电电子:一个电子带一个单位的负电荷1、 原子的构成得出结论原子核所带的电荷数简称为核电荷数
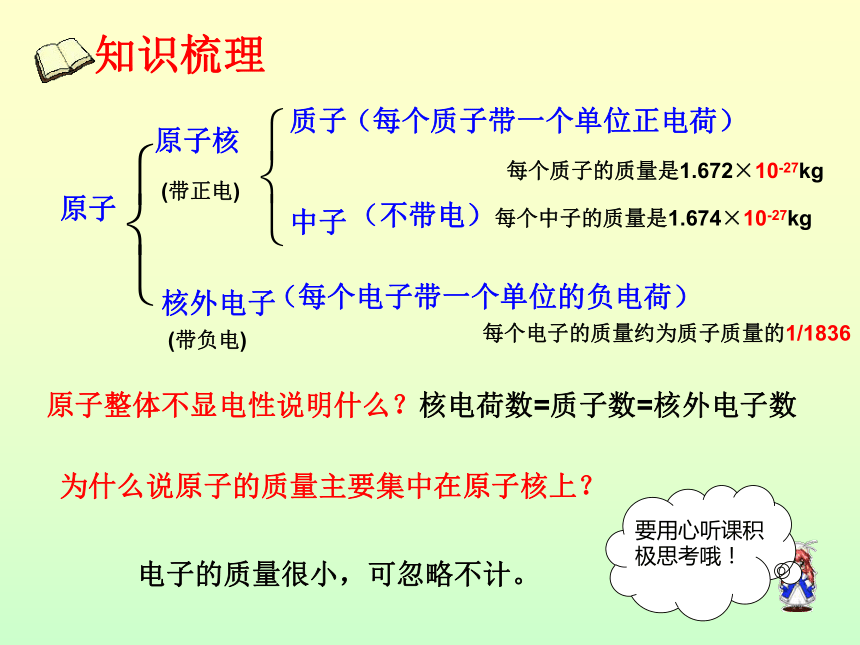
原子是否显电性?为什么?构成原子的粒子的电性和质量从下表中你能总结出什么规律?知识梳理原子原子核核外电子质子中子(每个质子带一个单位正电荷)(不带电)(每个电子带一个单位的负电荷)原子整体不显电性说明什么?(带正电)(带负电)核电荷数=质子数=核外电子数要用心听课积极思考哦!为什么说原子的质量主要集中在原子核上?每个电子的质量约为质子质量的1/1836每个质子的质量是1.672×10-27kg每个中子的质量是1.674×10-27kg电子的质量很小,可忽略不计。原子构成中的规律:另:
⑴ 、质 子 数 不 一 定 等 于 中 子 数
⑵ 、原 子 中 不 一 定 含 有 中 子⑶ 、构成原子的必要粒子是质子、电子, ⑴粒子数量关系:核电荷数 = 质子数 = 核外电子数= 原子序数
(原子核所带的电荷数简称为核电荷数)
⑵质 量 关 系: 原子的质量主要集中在原子的原子核上
⑶电性、量关系: ……
⑷体 积 关 系: 原子核体积很小
⑸决定原子种类的是核内质子数(即:核电荷数)3、原子不显电性的原因: 由于原子核所带电量和核外电子的
电量相等,但电性相反,所以整个原
子不显电性。以碳原子为例描述原子的构成 构成碳原子的粒子有6个质子,6
个中子和6个电子。其中6个质子和6个
中子构成了原子核作为原子的中心,
而6个电子在核外一定空间内绕核做高
速运动。
小试牛刀
1 .在 原 子 的 组 成 中, 带 正 电,
带 负 电, 不 带 电, 绕 着 做 高 速 运 动。 占 据 原 子 的 绝 大 部 分 体 积, 集 中原 子 的 主 要 质 量 。
电 子 质 子 中 子 电 子 原 子 核 电 子 原 子 核试一试:2 .下列关于原子的叙述正确的是 ( )
①一切原子都是由质子、中子和电子构成的
②原子在不停地运动
③原子是化学变化中的最小粒子
④原子由原子核和核外电子构成
⑤原子中不存在电荷.因而原子不带电
A.②③④ B.①②④ C.①③⑤ D.①②③④⑤ 二、相对原子质量 一 个 碳 原 子 的 质 量:
1.993×10-2 6 kg 1、原 子 的 实 际 质 量0.000000000000000
00 000000001993 kg
不同原子的质量各不相同,可以用现代科学仪器精确地测量出来。如:
一个氢原子的质量是:1.67×10-27㎏,
一个氧原子的质量是:2.657×10-26㎏,
一个铁原子的质量是:9.288×10-26㎏。 这样小的数字,书写、记忆和使用起来都很不方便,就像用吨做单位来表示一粒稻谷或小麦的质量一样,能不能用一种好写、好记、好用的方法来表示原子的质量呢?2、 相 对 原 子 质 量 原子的质量非常小,使用起来很繁琐,不方便,一般不采用。为方便使用确定了原子的相对质量──相对原子质量 (Ar)(1)定 义: 国 际 上 以 一 种 碳 原 子 质 量 的1/12作 为 标 准, 其 他 原 子 的 质 量 跟 它 比 较 所 得 的 值, 就 是 这 种 原 子 的 相 对 原 子 质 量。 碳12:是含有6个质子和6个中子的碳原子,质量是1.993×10-26 kg,它的质量的1/12等于 1.66×10-27 kg(2)计算公式2、 相 对 原 子 质 量实 质: 相 对 原 子 质 量 是 一 个 比 值, 其 国 际 单 位 为 一,一般不写出来。 (1)定 义: 国 际 上 一 致 同 意 以 一 种 碳 原 子 质 量 的1/12作 为 标 准, 其 他 原 子 的 质 量 跟 它 比 较 所 得 的 值, 就 是 这 种 原 子 的 相 对 原 子 质 量。 碳-12:是含有6个质子和6个中子的碳原子,它的质量的1/12等于1.66×10-27 kg 2、相 对 原 子 质 量 的计 算 公 式:实 质: 相 对 原 子 质 量 是 一 个 比 值, 其 国 际 单 位 为 一,一般不写出来。练习题 氢原子的质量= 1.6726×10- 27 kg
氢原子的相对原子质量
= 1.6726×10- 27 kg÷ 1.66×10- 27 kg ≈ 1碳12的十二分之一的质量练习题 氢原子的质量= 1.6726×10- 27 kg
氢原子的相对原子质量
= 1.6726×10- 27 kg÷ 1.66×10- 27 kg ≈ 1碳12的十二分之一的质量已知氧原子的质量是2.657×10- 26 kg,氮原子的质量是2.325×10- 26 kg,铁原子的质量是9.288×10- 26 kg,求它们的相对原子质量 ?
求一求碳原子的相对原子质量?
16121456原子的质量主要集中在原子的原子核上相 对 原 子 质 量 =M(质子)×质子数+M(中子)×中子数一种碳原子真实质量×1/12 =1.6726 ×10- 27 kg ×质子数+1.6748 ×10- 27 kg ×中子数 1.66×10- 27 kg=质子数+中子数2 .经测定某原子中共有40个粒子,其中14个粒子不显电性,则 它的相对原子质量为 ( )
A.40 B.54 C.26 D.271.据中央电视台2001年6月3日对云南抚仙湖湖底古城考古的现场报道,科学家曾通过对古生物遗骸中的碳-14含量来推断古城的年代。碳-14原子的核电荷数为6,相对原子质量为14。下列关于碳-14原子的说法中,错误的是(? )
A.中子数为6?? B.质子数为6
C.电子数为6?? D.质子数和中子数之和为14 练一练:思考:(1).碳-12与碳-14 原子有哪些不同之处?
(2).同种原子的质量和性质是否一定相同?3.英国科学家道尔顿(J.Dolton)于19世纪初提出了近代原子学说。他认为物质是由原子构成的,这些原子是微小不可分割的实心球体,同种原子的性质和质量都相同。请你指出道尔顿原子学说中现代科学实验证明的事实不相符的地方:
(1) ;
(2) ;
(3) 。 (1)原子只是构成物质的一种粒子,有些物质是由分子或离子构成的
(2)原子是化学变化中不可再分的粒子,并不是不可分割的粒子
(3)原子并不是实心球体,原子核只占原子体积的几千亿分之一,
在原子中,存在一个相对很大的空间 尝试查阅一下如下几种元素的相对原子质量:磷、铝、氮、钠、硫、镁
看谁查得又快又准! 磷——31 铝——27
氮——14 钠——23
硫——32 镁——24 1.原子(普通的氢除外)的原子核是( )
(A)由电子和质子构成(B)由质子和中子构成
(C)由电子和中子构成 (D)不能再分
2.在原子里质子数等于( )
(A)中子数(B)电子数 (C)中子数和电子数之和 (D)原子量
3.化学变化中的最小微粒是( ),在化学变化中可分的微粒是 ( )
(A)原子(B)分子 (C)电子 (D)原子核BAAB【心中有数】4.一个碳原子的质量是1.993×10千克, 碳的相对原子质量为 ( ) (A)12克(B)14 (C)12 (D)16 5.已知原子的核电荷数,可以确定它的( ) (A)相对原子质量 (B)质子数 (C)中子数 (D)电子数 6.原子中决定相对原子质量大小的主要微粒是( ) A.质子数和电子数 B.质子数和中子数 C.中子数和电子数 D.核电荷数 7、在同一原子里,其数目相同的是( ) A、中子数和质子数 B、电子数和质子数 C、中子数和电子数 D、质子数和原子质量 CBBB【开动脑筋】
1.某原子的质子数为26,中子数比质子数多4,则该原子中所含微粒总数为( )
A.26 B.56 C.82 D.86
2.构成氧原子的微粒有( )
A.8个质子,8个中子,16个电子
B.8个质子,8个电子
C.8个质子,8个中子,8个电子
D.8个原子核,8个中子,8个电子
CC3、贫铀弹的主要成分是低放射性的铀,铀原子的相对原子质量是238,核电荷数为92,中子数应为( )
A、146 B、92 C、136 D、238
4、道尔顿在著作中说:“一切物质都是由数量巨大的、极微小的粒子(原子)构成的,这些粒子间通过引力互相结合,我们不能创造原子,也不能分裂原子,我们能实验的变化,无非是把原先结合在一起的原子分开,或原先分开的原子结合起来。”有人对其观点作如下修正,你认为正确的是( )
①“一切物质”应改为“有的物质”;②“变化”只能指“化学变化”而不能指其他任何变化;③不能“创造”或“分裂”原子应指不能用物理或化学的方法“分裂”或“创造”原子
A、①② B、①③ C、②③ D、①②③
AD我知道。。。原子中,质子数=电子数,但不一定等于中子数;
电子在原子核外高速运动;
不同原子中,质子数不同;
原子分为原子核与核外电子,原子核分为质子和
中子;
电子带负电荷,质子带正电荷,中子不带电;
氢原子中,并没有中子;
这些原子中,氢原子体积最小;
。。。。
1.定义:原子是化学变化中的最小粒子。一、原子的构成 在化学反应里分子可以分为原子,原子不能再分,那么用其它方法能不能将原子再分呢?原子的结构究竟如何?请以“我想像中的原子”为题,提出你的想法。 1897年,在英国科学家汤姆生发现了电子以后,人们开始揭示了原子内部的秘密。经过20世纪整整一个世纪的努力,科学家不但打开了原子的大门,而且发现小小的原子内部结构十分复杂。播放:原子结构动画
课题1 原子结构模型.swf质子:一个质子带一个单位
的正电荷中子:中子不带电电子:一个电子带一个单位的负电荷2、 原子的构成原 子原 子 核 质子:一个质子带一个单位的正电荷中子:中子不带电电子:一个电子带一个单位的负电荷1、 原子的构成得出结论原子核所带的电荷数简称为核电荷数
原子是否显电性?为什么?构成原子的粒子的电性和质量从下表中你能总结出什么规律?知识梳理原子原子核核外电子质子中子(每个质子带一个单位正电荷)(不带电)(每个电子带一个单位的负电荷)原子整体不显电性说明什么?(带正电)(带负电)核电荷数=质子数=核外电子数要用心听课积极思考哦!为什么说原子的质量主要集中在原子核上?每个电子的质量约为质子质量的1/1836每个质子的质量是1.672×10-27kg每个中子的质量是1.674×10-27kg电子的质量很小,可忽略不计。原子构成中的规律:另:
⑴ 、质 子 数 不 一 定 等 于 中 子 数
⑵ 、原 子 中 不 一 定 含 有 中 子⑶ 、构成原子的必要粒子是质子、电子, ⑴粒子数量关系:核电荷数 = 质子数 = 核外电子数= 原子序数
(原子核所带的电荷数简称为核电荷数)
⑵质 量 关 系: 原子的质量主要集中在原子的原子核上
⑶电性、量关系: ……
⑷体 积 关 系: 原子核体积很小
⑸决定原子种类的是核内质子数(即:核电荷数)3、原子不显电性的原因: 由于原子核所带电量和核外电子的
电量相等,但电性相反,所以整个原
子不显电性。以碳原子为例描述原子的构成 构成碳原子的粒子有6个质子,6
个中子和6个电子。其中6个质子和6个
中子构成了原子核作为原子的中心,
而6个电子在核外一定空间内绕核做高
速运动。
小试牛刀
1 .在 原 子 的 组 成 中, 带 正 电,
带 负 电, 不 带 电, 绕 着 做 高 速 运 动。 占 据 原 子 的 绝 大 部 分 体 积, 集 中原 子 的 主 要 质 量 。
电 子 质 子 中 子 电 子 原 子 核 电 子 原 子 核试一试:2 .下列关于原子的叙述正确的是 ( )
①一切原子都是由质子、中子和电子构成的
②原子在不停地运动
③原子是化学变化中的最小粒子
④原子由原子核和核外电子构成
⑤原子中不存在电荷.因而原子不带电
A.②③④ B.①②④ C.①③⑤ D.①②③④⑤ 二、相对原子质量 一 个 碳 原 子 的 质 量:
1.993×10-2 6 kg 1、原 子 的 实 际 质 量0.000000000000000
00 000000001993 kg
不同原子的质量各不相同,可以用现代科学仪器精确地测量出来。如:
一个氢原子的质量是:1.67×10-27㎏,
一个氧原子的质量是:2.657×10-26㎏,
一个铁原子的质量是:9.288×10-26㎏。 这样小的数字,书写、记忆和使用起来都很不方便,就像用吨做单位来表示一粒稻谷或小麦的质量一样,能不能用一种好写、好记、好用的方法来表示原子的质量呢?2、 相 对 原 子 质 量 原子的质量非常小,使用起来很繁琐,不方便,一般不采用。为方便使用确定了原子的相对质量──相对原子质量 (Ar)(1)定 义: 国 际 上 以 一 种 碳 原 子 质 量 的1/12作 为 标 准, 其 他 原 子 的 质 量 跟 它 比 较 所 得 的 值, 就 是 这 种 原 子 的 相 对 原 子 质 量。 碳12:是含有6个质子和6个中子的碳原子,质量是1.993×10-26 kg,它的质量的1/12等于 1.66×10-27 kg(2)计算公式2、 相 对 原 子 质 量实 质: 相 对 原 子 质 量 是 一 个 比 值, 其 国 际 单 位 为 一,一般不写出来。 (1)定 义: 国 际 上 一 致 同 意 以 一 种 碳 原 子 质 量 的1/12作 为 标 准, 其 他 原 子 的 质 量 跟 它 比 较 所 得 的 值, 就 是 这 种 原 子 的 相 对 原 子 质 量。 碳-12:是含有6个质子和6个中子的碳原子,它的质量的1/12等于1.66×10-27 kg 2、相 对 原 子 质 量 的计 算 公 式:实 质: 相 对 原 子 质 量 是 一 个 比 值, 其 国 际 单 位 为 一,一般不写出来。练习题 氢原子的质量= 1.6726×10- 27 kg
氢原子的相对原子质量
= 1.6726×10- 27 kg÷ 1.66×10- 27 kg ≈ 1碳12的十二分之一的质量练习题 氢原子的质量= 1.6726×10- 27 kg
氢原子的相对原子质量
= 1.6726×10- 27 kg÷ 1.66×10- 27 kg ≈ 1碳12的十二分之一的质量已知氧原子的质量是2.657×10- 26 kg,氮原子的质量是2.325×10- 26 kg,铁原子的质量是9.288×10- 26 kg,求它们的相对原子质量 ?
求一求碳原子的相对原子质量?
16121456原子的质量主要集中在原子的原子核上相 对 原 子 质 量 =M(质子)×质子数+M(中子)×中子数一种碳原子真实质量×1/12 =1.6726 ×10- 27 kg ×质子数+1.6748 ×10- 27 kg ×中子数 1.66×10- 27 kg=质子数+中子数2 .经测定某原子中共有40个粒子,其中14个粒子不显电性,则 它的相对原子质量为 ( )
A.40 B.54 C.26 D.271.据中央电视台2001年6月3日对云南抚仙湖湖底古城考古的现场报道,科学家曾通过对古生物遗骸中的碳-14含量来推断古城的年代。碳-14原子的核电荷数为6,相对原子质量为14。下列关于碳-14原子的说法中,错误的是(? )
A.中子数为6?? B.质子数为6
C.电子数为6?? D.质子数和中子数之和为14 练一练:思考:(1).碳-12与碳-14 原子有哪些不同之处?
(2).同种原子的质量和性质是否一定相同?3.英国科学家道尔顿(J.Dolton)于19世纪初提出了近代原子学说。他认为物质是由原子构成的,这些原子是微小不可分割的实心球体,同种原子的性质和质量都相同。请你指出道尔顿原子学说中现代科学实验证明的事实不相符的地方:
(1) ;
(2) ;
(3) 。 (1)原子只是构成物质的一种粒子,有些物质是由分子或离子构成的
(2)原子是化学变化中不可再分的粒子,并不是不可分割的粒子
(3)原子并不是实心球体,原子核只占原子体积的几千亿分之一,
在原子中,存在一个相对很大的空间 尝试查阅一下如下几种元素的相对原子质量:磷、铝、氮、钠、硫、镁
看谁查得又快又准! 磷——31 铝——27
氮——14 钠——23
硫——32 镁——24 1.原子(普通的氢除外)的原子核是( )
(A)由电子和质子构成(B)由质子和中子构成
(C)由电子和中子构成 (D)不能再分
2.在原子里质子数等于( )
(A)中子数(B)电子数 (C)中子数和电子数之和 (D)原子量
3.化学变化中的最小微粒是( ),在化学变化中可分的微粒是 ( )
(A)原子(B)分子 (C)电子 (D)原子核BAAB【心中有数】4.一个碳原子的质量是1.993×10千克, 碳的相对原子质量为 ( ) (A)12克(B)14 (C)12 (D)16 5.已知原子的核电荷数,可以确定它的( ) (A)相对原子质量 (B)质子数 (C)中子数 (D)电子数 6.原子中决定相对原子质量大小的主要微粒是( ) A.质子数和电子数 B.质子数和中子数 C.中子数和电子数 D.核电荷数 7、在同一原子里,其数目相同的是( ) A、中子数和质子数 B、电子数和质子数 C、中子数和电子数 D、质子数和原子质量 CBBB【开动脑筋】
1.某原子的质子数为26,中子数比质子数多4,则该原子中所含微粒总数为( )
A.26 B.56 C.82 D.86
2.构成氧原子的微粒有( )
A.8个质子,8个中子,16个电子
B.8个质子,8个电子
C.8个质子,8个中子,8个电子
D.8个原子核,8个中子,8个电子
CC3、贫铀弹的主要成分是低放射性的铀,铀原子的相对原子质量是238,核电荷数为92,中子数应为( )
A、146 B、92 C、136 D、238
4、道尔顿在著作中说:“一切物质都是由数量巨大的、极微小的粒子(原子)构成的,这些粒子间通过引力互相结合,我们不能创造原子,也不能分裂原子,我们能实验的变化,无非是把原先结合在一起的原子分开,或原先分开的原子结合起来。”有人对其观点作如下修正,你认为正确的是( )
①“一切物质”应改为“有的物质”;②“变化”只能指“化学变化”而不能指其他任何变化;③不能“创造”或“分裂”原子应指不能用物理或化学的方法“分裂”或“创造”原子
A、①② B、①③ C、②③ D、①②③
AD我知道。。。原子中,质子数=电子数,但不一定等于中子数;
电子在原子核外高速运动;
不同原子中,质子数不同;
原子分为原子核与核外电子,原子核分为质子和
中子;
电子带负电荷,质子带正电荷,中子不带电;
氢原子中,并没有中子;
这些原子中,氢原子体积最小;
。。。。
同课章节目录
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的构成
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题1 质量守恒定律
- 课题2 如何正确书写化学方程式
- 课题3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动3 燃烧的条件
- 旧版目录
- 第五单元 物质组成的表示
- 课题2 燃料和热量
- 课题3 使用燃料对环境的影响
