初二升初三暑期集训(一)化学符号与计算 讲义+练习(无答案)
文档属性
| 名称 | 初二升初三暑期集训(一)化学符号与计算 讲义+练习(无答案) |
|
|
| 格式 | zip | ||
| 文件大小 | 318.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-07-07 00:00:00 | ||
图片预览



文档简介
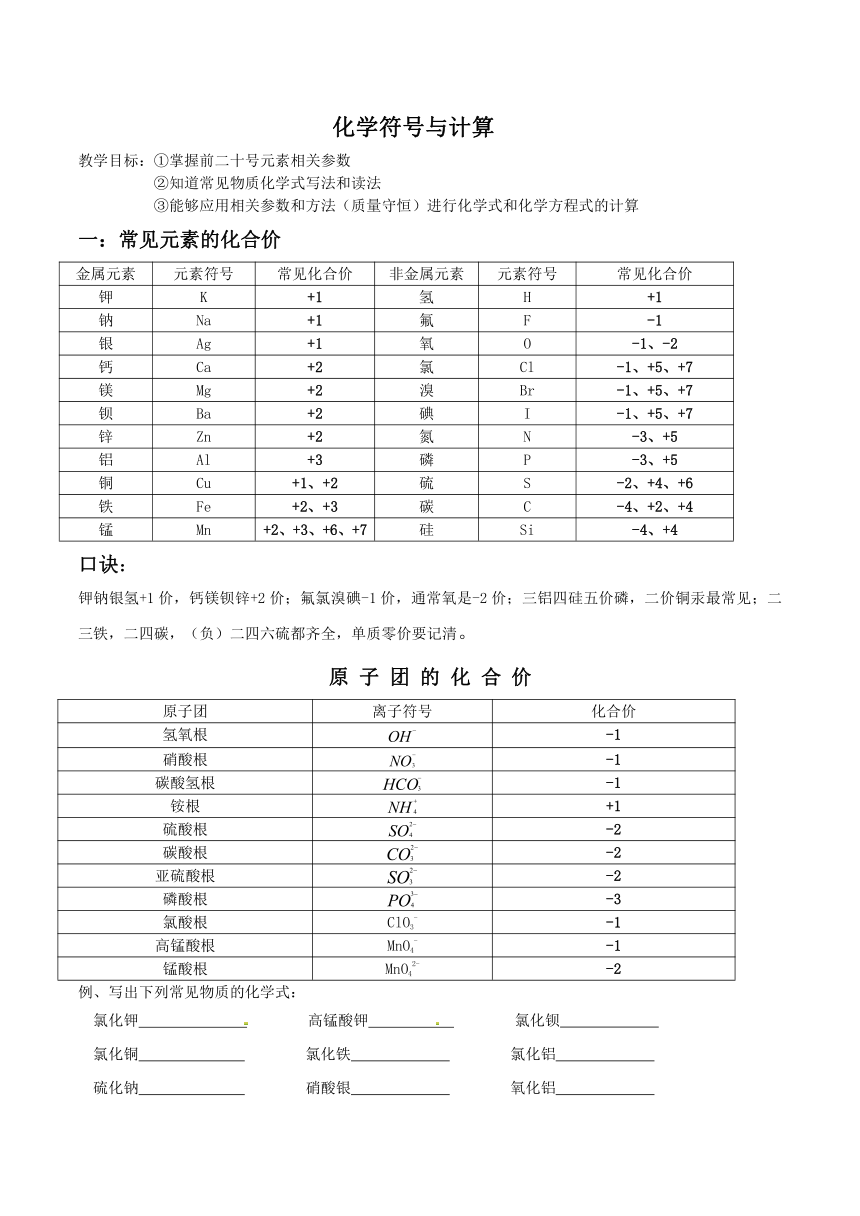
化学符号与计算
教学目标:①掌握前二十号元素相关参数
②知道常见物质化学式写法和读法
③能够应用相关参数和方法(质量守恒)进行化学式和化学方程式的计算
一:常见元素的化合价
金属元素 元素符号 常见化合价 非金属元素 元素符号 常见化合价
钾 K +1 氢 H +1
钠 Na +1 氟 F -1
银 Ag +1 氧 O -1、-2
钙 Ca +2 氯 Cl -1、+5、+7
镁 Mg +2 溴 Br -1、+5、+7
钡 Ba +2 碘 I -1、+5、+7
锌 Zn +2 氮 N -3、+5
铝 Al +3 磷 P -3、+5
铜 Cu +1、+2 硫 S -2、+4、+6
铁 Fe +2、+3 碳 C -4、+2、+4
锰 Mn +2、+3、+6、+7 硅 Si -4、+4
口诀:
钾钠银氢+1价,钙镁钡锌+2价;氟氯溴碘-1价,通常氧是-2价;三铝四硅五价磷,二价铜汞最常见;二三铁,二四碳,(负)二四六硫都齐全,单质零价要记清。
原 子 团 的 化 合 价
原子团 离子符号 化合价
氢氧根 -1
硝酸根 -1
碳酸氢根 -1
铵根 +1
硫酸根 -2
碳酸根 -2
亚硫酸根 -2
磷酸根 -3
氯酸根 ClO3- -1
高锰酸根 MnO4- -1
锰酸根 MnO42- -2
例、写出下列常见物质的化学式:
氯化钾 高锰酸钾 氯化钡
氯化铜 氯化铁 氯化铝
硫化钠 硝酸银 氧化铝
硝酸铜 硫化钾 硝酸铝
二氧化锰 二氧化氮 硫酸钡
硫酸铜 硫酸铁 氯化氢
碳酸钠 碳酸钾 碳酸钡
碳酸钙 氧化镁 氧化铁
质量守恒定律和化学方程式计算
(一)质量守恒定律的分析归纳:
(二)、化学方程式计算
理论依据:化学方程式中,反应物和生成物的相对分子(原子)质量之比,等于质量比
注意:相对分子质量计算质量比时,需要考虑分子间的化学计量数,
根据实际质量的质量比则不需要。
2.计算时常用的关系式
(1)分解百分率=×100%
(2)物质的纯度=×100%
(3)不纯物质的总质量=纯物质的质量+杂质的质量
3.计算某溶液(溶质)的质量分数
溶质质量分数=×100%
题型一:组成物质的元素
1.豆类、动物肝脏中含有丰富的铁和锌,这里的“铁”“锌”是指( )
A.原子 B.分子 C.元素 D.单质
2.日常生活中加碘食盐、高钙牛奶、含氟牙膏、富硒茶叶、加铁酱油中的碘、钙、氟、硒和铁指的是( )
A.单质 B.分子 C.原子 D.元素
3.车用乙醇汽油是将燃料乙醇和汽油以一定的比例混合而成的一种汽车燃料,那么乙醇汽油属于( )
A.单质 B.纯净物 C.混合物 D.化合物
4.20世纪20年代,就有人预言可能存在由4个氧原子构成的氧分子(O4),但一直没有得到证实。2001年,意大利的科学家使用普通氧分子和带正电的氧离子制造出了这种新型氧分子,并用质谱仪探测到了它的存在。下列叙述中正确的是( )
A.O4是一种新型的化合物 B.一个O4分子中含有2个O2分子
C.O4和O2的性质完全相同 D.O4和O2混合后形成的是混合物
5.现有A、B、C、D四种元素,A为地壳中含量最多的元素,B少量存在于煤中,它燃烧产生的气体是导致酸雨或大气污染的主要气体,C的原子核内,通常无中子,D的单质是一种黑色的固体,在空气中完全燃烧只生成二氧化碳气体。
请回答下列问题。
(1)写出元素名称。
A: ; B: ;
C: ; D: 。
(2)写出下列物质的名称: 由两种元素组成的、生活中不可缺少的、呈液态的化合物是 ,由两种元素组成的人体呼吸排出的气体是 。
(3)一瓶气体经过化验得知其中只有一种元素,则该气体是( )
A.一种单质 B.单质、化合物的混合物
C.一种化合物 D.既可能是一种单质,也可能是几种单质的混合物
题型二、元素符号及其周边数字含义
1. 下列化学用语与含义不相符的是( )
A. 02﹣2个氧原子 B. Ca2+﹣钙离子
C. P2O5﹣五氧化二磷 D. 2H2O﹣2个水分子
2.下列微粒符号中,对“2”含义的理解正确的是( )
A. 2Cu中的“2”表示2个铜元素
B. Fe2+中的“2”表示每个铁离子带有2个单位的正电荷
C. H2S中的“2”表示一个硫化氢分子中含有两个氢原子
D. Al2()3 中化学式上方的“2”表示硫元素为﹣2价
3. 下列关于“2”的含义解释中,正确的是( )
A. H2O中的“2”表示一个水分子中含有两个氢元素
B. 2NO中的“2”表示2个一氧化氮分子
C. Zn2+中的“2+”表示带有2个单位的正电子的锌原子
D. Al2S3中化学式上方的“2”表示硫的化合价为2价
4. 写出下列式子中特殊要求部分的含义.
(1)10Ag中“10”表示 ;(2)4CO2中“4”表示 ;
(3)SO3中“3”表示 ;(4)Al3+ 中“3+”表示 ;
(5)中“+3”表示 .
5. (1)用化学符号表示:2个氟原子 ;地壳中含量最高的金属元素 ;碳酸中氢元素化合价 ;硫酸亚铁溶液中的阳离子 .
(2)某化学反应的微观示意图如图所示:
①反应物中一种化合物,化学式为 ;②生成物中有 种氧化物.
题型三、化学式计算
1. 苏丹红一号(C16H12NO)和苏丹红二号(C18H16N2O)都是工业合成的红色染色剂,世界上多数国家都不允许把其作为食用色素使用。试回答:
(1)两种物质都是由 种元素组成
(2)苏丹红二号中的C.H.N.O的原子个数比是 。
(3)计算苏丹红二号的相对分子质量
(4)苏丹红二号中氮元素质量分数(计算结果精确到0.1%)
2. “湖林是个好地方,桑翠湖边渔米乡。四季鲜笋吃不断,高山白茶美名扬。”湖林学校距离 福鼎城关大约40公里,这里以山清水秀、空气清新而闻名,这里远离污染、原生态的环境足以让人留连忘返。(共16分)
(1)桑翠湖水属于 (填“纯净物”或“混合物”);
(2)你认为会对空气造成污染的有害气体是 (至少填一种)。
(3)每当秋高气爽时节,这里的方笋就破土而出,采摘回来,剥皮下锅,霎时清香四逸。请用分子的观点来解释“清香四逸” 。
(5)湖林高山白茶是福鼎白茶中的上好品种,叶中的化学成分极其丰富。主要有水分、多酚类化合物、蛋白质、氨基酸、酶、生物碱、糖类、维生素等。其中几大茶类中以福鼎白茶的多酚类化合物含量最高,是其它茶类的2-30倍。因此福鼎白茶的保健功能最好。其中茶多酚的化学式是(C22H18O11),请计算:
①茶多酚的相对分子质量为 。
②每个茶多酚分子中共有 个原子,其中碳、氧原子个数比为 。
③茶多酚中碳元素和氧元素的质量比是 (化为最简整数比)?
题型四、质量守恒定律与应用
1.在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化见下表.下列说法中不正确的是( )
物质 甲 乙 丙 丁
反应前物质质量/g 8 32 5 4
反应后物质质量/g 16 4 x 24
A.该反应为分解反应 B.丙可能是该反应的催化剂
C.甲、乙两物质间参加反应的质量比为1:4 D.乙、丁两种物质间反应的质量比为7:5
2.甲、乙、丙、丁四种物质,在一定的条件下充分反应,测得反应前后各物质的质量分数如图所示.下列说法正确的( )
A.丁一定是化合物 B.丙一定是这个反应的催化剂
C.该反应可能是碳酸钙分解
D.参加反应的甲的质量一定等于生成的丁和乙的质量之和
3.在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前及t1、t2时各物质质量如图所示,下列说法中不正确的是( )
A.该反应为化合反应 B.丙可能为该反应的催化剂
C.反应中,甲、乙的质量变化之比为1:4
D.该反应中,乙、丁的质量变化之比为7:5
4.《美国化学会志》报道了中国科学家以二氧化碳和钠在一定条件制得金刚石,其他化学方程式为3CO2+4Na═2X+C(金刚石),则X的化学式为( )
A.Na2O2 B.Na2CO3 C.Na2O D.Na4C2O6
5.交警通常用一种“酒精检测仪”检查司机呼出气体中的酒精含量,其反应原理为C2H5OH+4CrO3+6H2SO4=2R+2CO2↑+9H2O,反应中红色的CrO3转变为绿色的化合物R,则R的化学式应为( )
A.Cr2O3 B.CrSO3 C.Cr2(SO4)3 D.CrS
6.有机物R和足量氧气置于密闭容器中充分反应生成水和二氧化碳,实验前后物质反应物质质量如表,下列说法错误的是( )
R O2 CO2 H2O
反应前物质质量/g 46 128 0 0
反应后物质质量/g 0 32 X 54
A.x=88 B.参加反应质量比R:O2=23:64
C.R的化学式C2H5OH D.R是由C、H、O三种元素组成
7.在奥运比赛中,举重运动员举重前常用白色的“镁粉”搓手,是因为“镁粉”质轻、吸水性好,可作防滑剂.“镁粉”的有效成分是碱式碳酸镁,它不可燃,300℃即分解,其分解的化学方程式是:Mg5(OH)2(CO3)45MgO+H2O+4X↑,则X的化学式是( )
A.CO2 B.CO C.Mg(OH)2 D.O2
8.高锰酸钾是一种常用的化学试剂.
(1)电解K2MnO4溶液可获得高锰酸钾(反应Ⅰ)的化学方程式为:
2K2MnO4+2H2O2KMnO4+H2↑+2X,反应Ⅰ中,X的化学式为 .
(2)高锰酸钾制取氧气 (反应Ⅱ) 的化学方程式为:2KMnO4K2MnO4+MnO2+O2↑
KMnO4相对分子质量为 ,若取 15.8g KMnO4充分受热分解,产生 O2的质量最多为 g;
四、方程式计算题
1、某氯碱工厂排放的尾气里含有有毒的氯气(Cl2),为防止其污染空气,工厂用20%的NaOH溶液吸收氯气(反应的化学方程式为Cl2+2NaOH===NaClO+NaCl+H2O)。计算:4吨NaOH溶液,理论上可吸收氯气的质量为多少?得到的氯化钠溶液质量分数多少?(假设反应前后溶液的体积不变)
2、石灰石是生产石灰、水泥的主要原料.某兴趣小组摸仿化验室测定石灰石样品中碳酸钙的质量分数,进行了以下实验(假设杂质不参加反应):称取石灰石样品12g放入烧杯中;慢慢加入稀盐酸,不断搅拌,至不发生气泡为上,称得消耗稀盐酸73g;称量反应后烧杯中剩余物的质量为80.6g.
(1)试根据实验数据计算石灰石样品中碳酸钙的质量分数.
(2)试根据实验数据计算稀盐酸的质量分数.
3.科学实验提倡绿色环保,对实验装置进行微型化改进是一条很好的途径.图甲是实验室制取并检验CO2的装置,图乙是对图甲实验装置的“微型”化改进后的装置.
(1)图乙中微型塑料滴管在实验中的作用与图甲中的 仪器相同(填仪器名称).
(2)通常用甲装置完成该实验需要的盐酸是“微型”实验装置用量的10倍,“微型”实验装置具有的优点是 .
(3)用乙装置完成“制取并检验CO2”的实验,消耗了1.46g10%的盐酸.请计算实验过程中产生CO2的质量是多少克?
教学目标:①掌握前二十号元素相关参数
②知道常见物质化学式写法和读法
③能够应用相关参数和方法(质量守恒)进行化学式和化学方程式的计算
一:常见元素的化合价
金属元素 元素符号 常见化合价 非金属元素 元素符号 常见化合价
钾 K +1 氢 H +1
钠 Na +1 氟 F -1
银 Ag +1 氧 O -1、-2
钙 Ca +2 氯 Cl -1、+5、+7
镁 Mg +2 溴 Br -1、+5、+7
钡 Ba +2 碘 I -1、+5、+7
锌 Zn +2 氮 N -3、+5
铝 Al +3 磷 P -3、+5
铜 Cu +1、+2 硫 S -2、+4、+6
铁 Fe +2、+3 碳 C -4、+2、+4
锰 Mn +2、+3、+6、+7 硅 Si -4、+4
口诀:
钾钠银氢+1价,钙镁钡锌+2价;氟氯溴碘-1价,通常氧是-2价;三铝四硅五价磷,二价铜汞最常见;二三铁,二四碳,(负)二四六硫都齐全,单质零价要记清。
原 子 团 的 化 合 价
原子团 离子符号 化合价
氢氧根 -1
硝酸根 -1
碳酸氢根 -1
铵根 +1
硫酸根 -2
碳酸根 -2
亚硫酸根 -2
磷酸根 -3
氯酸根 ClO3- -1
高锰酸根 MnO4- -1
锰酸根 MnO42- -2
例、写出下列常见物质的化学式:
氯化钾 高锰酸钾 氯化钡
氯化铜 氯化铁 氯化铝
硫化钠 硝酸银 氧化铝
硝酸铜 硫化钾 硝酸铝
二氧化锰 二氧化氮 硫酸钡
硫酸铜 硫酸铁 氯化氢
碳酸钠 碳酸钾 碳酸钡
碳酸钙 氧化镁 氧化铁
质量守恒定律和化学方程式计算
(一)质量守恒定律的分析归纳:
(二)、化学方程式计算
理论依据:化学方程式中,反应物和生成物的相对分子(原子)质量之比,等于质量比
注意:相对分子质量计算质量比时,需要考虑分子间的化学计量数,
根据实际质量的质量比则不需要。
2.计算时常用的关系式
(1)分解百分率=×100%
(2)物质的纯度=×100%
(3)不纯物质的总质量=纯物质的质量+杂质的质量
3.计算某溶液(溶质)的质量分数
溶质质量分数=×100%
题型一:组成物质的元素
1.豆类、动物肝脏中含有丰富的铁和锌,这里的“铁”“锌”是指( )
A.原子 B.分子 C.元素 D.单质
2.日常生活中加碘食盐、高钙牛奶、含氟牙膏、富硒茶叶、加铁酱油中的碘、钙、氟、硒和铁指的是( )
A.单质 B.分子 C.原子 D.元素
3.车用乙醇汽油是将燃料乙醇和汽油以一定的比例混合而成的一种汽车燃料,那么乙醇汽油属于( )
A.单质 B.纯净物 C.混合物 D.化合物
4.20世纪20年代,就有人预言可能存在由4个氧原子构成的氧分子(O4),但一直没有得到证实。2001年,意大利的科学家使用普通氧分子和带正电的氧离子制造出了这种新型氧分子,并用质谱仪探测到了它的存在。下列叙述中正确的是( )
A.O4是一种新型的化合物 B.一个O4分子中含有2个O2分子
C.O4和O2的性质完全相同 D.O4和O2混合后形成的是混合物
5.现有A、B、C、D四种元素,A为地壳中含量最多的元素,B少量存在于煤中,它燃烧产生的气体是导致酸雨或大气污染的主要气体,C的原子核内,通常无中子,D的单质是一种黑色的固体,在空气中完全燃烧只生成二氧化碳气体。
请回答下列问题。
(1)写出元素名称。
A: ; B: ;
C: ; D: 。
(2)写出下列物质的名称: 由两种元素组成的、生活中不可缺少的、呈液态的化合物是 ,由两种元素组成的人体呼吸排出的气体是 。
(3)一瓶气体经过化验得知其中只有一种元素,则该气体是( )
A.一种单质 B.单质、化合物的混合物
C.一种化合物 D.既可能是一种单质,也可能是几种单质的混合物
题型二、元素符号及其周边数字含义
1. 下列化学用语与含义不相符的是( )
A. 02﹣2个氧原子 B. Ca2+﹣钙离子
C. P2O5﹣五氧化二磷 D. 2H2O﹣2个水分子
2.下列微粒符号中,对“2”含义的理解正确的是( )
A. 2Cu中的“2”表示2个铜元素
B. Fe2+中的“2”表示每个铁离子带有2个单位的正电荷
C. H2S中的“2”表示一个硫化氢分子中含有两个氢原子
D. Al2()3 中化学式上方的“2”表示硫元素为﹣2价
3. 下列关于“2”的含义解释中,正确的是( )
A. H2O中的“2”表示一个水分子中含有两个氢元素
B. 2NO中的“2”表示2个一氧化氮分子
C. Zn2+中的“2+”表示带有2个单位的正电子的锌原子
D. Al2S3中化学式上方的“2”表示硫的化合价为2价
4. 写出下列式子中特殊要求部分的含义.
(1)10Ag中“10”表示 ;(2)4CO2中“4”表示 ;
(3)SO3中“3”表示 ;(4)Al3+ 中“3+”表示 ;
(5)中“+3”表示 .
5. (1)用化学符号表示:2个氟原子 ;地壳中含量最高的金属元素 ;碳酸中氢元素化合价 ;硫酸亚铁溶液中的阳离子 .
(2)某化学反应的微观示意图如图所示:
①反应物中一种化合物,化学式为 ;②生成物中有 种氧化物.
题型三、化学式计算
1. 苏丹红一号(C16H12NO)和苏丹红二号(C18H16N2O)都是工业合成的红色染色剂,世界上多数国家都不允许把其作为食用色素使用。试回答:
(1)两种物质都是由 种元素组成
(2)苏丹红二号中的C.H.N.O的原子个数比是 。
(3)计算苏丹红二号的相对分子质量
(4)苏丹红二号中氮元素质量分数(计算结果精确到0.1%)
2. “湖林是个好地方,桑翠湖边渔米乡。四季鲜笋吃不断,高山白茶美名扬。”湖林学校距离 福鼎城关大约40公里,这里以山清水秀、空气清新而闻名,这里远离污染、原生态的环境足以让人留连忘返。(共16分)
(1)桑翠湖水属于 (填“纯净物”或“混合物”);
(2)你认为会对空气造成污染的有害气体是 (至少填一种)。
(3)每当秋高气爽时节,这里的方笋就破土而出,采摘回来,剥皮下锅,霎时清香四逸。请用分子的观点来解释“清香四逸” 。
(5)湖林高山白茶是福鼎白茶中的上好品种,叶中的化学成分极其丰富。主要有水分、多酚类化合物、蛋白质、氨基酸、酶、生物碱、糖类、维生素等。其中几大茶类中以福鼎白茶的多酚类化合物含量最高,是其它茶类的2-30倍。因此福鼎白茶的保健功能最好。其中茶多酚的化学式是(C22H18O11),请计算:
①茶多酚的相对分子质量为 。
②每个茶多酚分子中共有 个原子,其中碳、氧原子个数比为 。
③茶多酚中碳元素和氧元素的质量比是 (化为最简整数比)?
题型四、质量守恒定律与应用
1.在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化见下表.下列说法中不正确的是( )
物质 甲 乙 丙 丁
反应前物质质量/g 8 32 5 4
反应后物质质量/g 16 4 x 24
A.该反应为分解反应 B.丙可能是该反应的催化剂
C.甲、乙两物质间参加反应的质量比为1:4 D.乙、丁两种物质间反应的质量比为7:5
2.甲、乙、丙、丁四种物质,在一定的条件下充分反应,测得反应前后各物质的质量分数如图所示.下列说法正确的( )
A.丁一定是化合物 B.丙一定是这个反应的催化剂
C.该反应可能是碳酸钙分解
D.参加反应的甲的质量一定等于生成的丁和乙的质量之和
3.在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前及t1、t2时各物质质量如图所示,下列说法中不正确的是( )
A.该反应为化合反应 B.丙可能为该反应的催化剂
C.反应中,甲、乙的质量变化之比为1:4
D.该反应中,乙、丁的质量变化之比为7:5
4.《美国化学会志》报道了中国科学家以二氧化碳和钠在一定条件制得金刚石,其他化学方程式为3CO2+4Na═2X+C(金刚石),则X的化学式为( )
A.Na2O2 B.Na2CO3 C.Na2O D.Na4C2O6
5.交警通常用一种“酒精检测仪”检查司机呼出气体中的酒精含量,其反应原理为C2H5OH+4CrO3+6H2SO4=2R+2CO2↑+9H2O,反应中红色的CrO3转变为绿色的化合物R,则R的化学式应为( )
A.Cr2O3 B.CrSO3 C.Cr2(SO4)3 D.CrS
6.有机物R和足量氧气置于密闭容器中充分反应生成水和二氧化碳,实验前后物质反应物质质量如表,下列说法错误的是( )
R O2 CO2 H2O
反应前物质质量/g 46 128 0 0
反应后物质质量/g 0 32 X 54
A.x=88 B.参加反应质量比R:O2=23:64
C.R的化学式C2H5OH D.R是由C、H、O三种元素组成
7.在奥运比赛中,举重运动员举重前常用白色的“镁粉”搓手,是因为“镁粉”质轻、吸水性好,可作防滑剂.“镁粉”的有效成分是碱式碳酸镁,它不可燃,300℃即分解,其分解的化学方程式是:Mg5(OH)2(CO3)45MgO+H2O+4X↑,则X的化学式是( )
A.CO2 B.CO C.Mg(OH)2 D.O2
8.高锰酸钾是一种常用的化学试剂.
(1)电解K2MnO4溶液可获得高锰酸钾(反应Ⅰ)的化学方程式为:
2K2MnO4+2H2O2KMnO4+H2↑+2X,反应Ⅰ中,X的化学式为 .
(2)高锰酸钾制取氧气 (反应Ⅱ) 的化学方程式为:2KMnO4K2MnO4+MnO2+O2↑
KMnO4相对分子质量为 ,若取 15.8g KMnO4充分受热分解,产生 O2的质量最多为 g;
四、方程式计算题
1、某氯碱工厂排放的尾气里含有有毒的氯气(Cl2),为防止其污染空气,工厂用20%的NaOH溶液吸收氯气(反应的化学方程式为Cl2+2NaOH===NaClO+NaCl+H2O)。计算:4吨NaOH溶液,理论上可吸收氯气的质量为多少?得到的氯化钠溶液质量分数多少?(假设反应前后溶液的体积不变)
2、石灰石是生产石灰、水泥的主要原料.某兴趣小组摸仿化验室测定石灰石样品中碳酸钙的质量分数,进行了以下实验(假设杂质不参加反应):称取石灰石样品12g放入烧杯中;慢慢加入稀盐酸,不断搅拌,至不发生气泡为上,称得消耗稀盐酸73g;称量反应后烧杯中剩余物的质量为80.6g.
(1)试根据实验数据计算石灰石样品中碳酸钙的质量分数.
(2)试根据实验数据计算稀盐酸的质量分数.
3.科学实验提倡绿色环保,对实验装置进行微型化改进是一条很好的途径.图甲是实验室制取并检验CO2的装置,图乙是对图甲实验装置的“微型”化改进后的装置.
(1)图乙中微型塑料滴管在实验中的作用与图甲中的 仪器相同(填仪器名称).
(2)通常用甲装置完成该实验需要的盐酸是“微型”实验装置用量的10倍,“微型”实验装置具有的优点是 .
(3)用乙装置完成“制取并检验CO2”的实验,消耗了1.46g10%的盐酸.请计算实验过程中产生CO2的质量是多少克?
同课章节目录
