鲁科版 高中化学 选修3 3.3 原子晶体与分子晶体(共23张ppt)
文档属性
| 名称 | 鲁科版 高中化学 选修3 3.3 原子晶体与分子晶体(共23张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-09 18:48:12 | ||
图片预览








文档简介
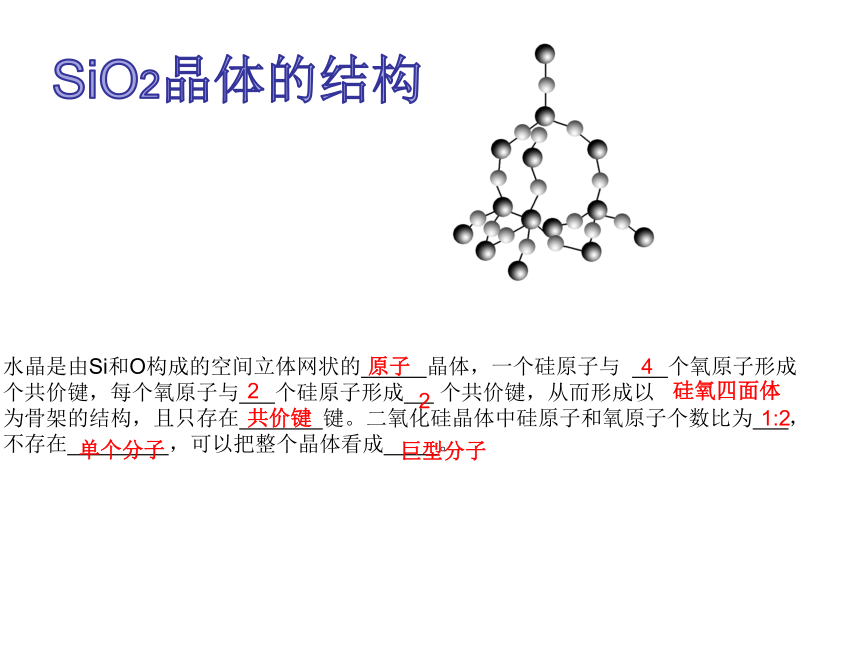
课件23张PPT。第3章 物质的聚集状态与物质性质第3节 原子晶体与分子晶体第2课时复习回顾原子晶体1.金刚石结构在晶体中,碳原子以sp3杂化轨道与周围 个碳原子以共价键相结合,C—C键间的夹角为 。因为中心原子周围排列的原子的数目是 的,所以这种比较 的排列与金属晶体和离子晶体中的 排列有很大的不同。4109.5o有限疏松紧密SiO2晶体的结构水晶是由Si和O构成的空间立体网状的 晶体,一个硅原子与 个氧原子形成 个共价键,每个氧原子与 个硅原子形成 个共价键,从而形成以 为骨架的结构,且只存在 键。二氧化硅晶体中硅原子和氧原子个数比为 ,不存在 ,可以把整个晶体看成 。原子422硅氧四面体共价键1:2单个分子巨型分子3.SiC晶体的结构SiC晶体的结构类似于金刚石晶体结构,其中C原子和Si原子的位置是 的,所以在整个晶体中Si原子与C原子个数比为 。交替1:1原子晶体熔、沸点高低的判断方法原子晶体熔、沸点高低主要看原子半径。因为原子晶体中原子间以较强的共价键相结合,原子半径越大,键长越长,共价键越不稳定,对应物质的熔、沸点越低。联想质疑你已经知道,冰容易融化,干冰容易气化,碘晶体容易升华。那么,你知道这些晶体为什么有上述特性吗?它们的结构是怎样的呢?
今天这节课我们就来解决这些问题。新授:二、分子晶体1. 分子晶体的构成[分子晶体]
分子间通过分子间作用力结合形成的晶体,称为分子晶体。或者说,只含分子的晶体叫做分子晶体。
[构成]
在分子晶体中,分子内的原子间以共价键结合,而相邻分子靠分子间作用力(又叫范德华力)相互吸引。结构特点方向性由于分子间作用力不具有________,所以分子晶体在堆积排列时尽可能的利用空间采取紧密堆积的方式。
碘晶体
碘晶体的晶胞是一个 ,碘分子除了占据长方体的每个 外,在每个 上还有一个碘分子长方体顶点面干冰干冰晶胞呈 型,其中二氧化碳分子因分子之间的相互作用,在晶胞中呈现 排列 立方体规律性[思考]为何冰的密度小于水的密度?为何水在4℃以下,热缩冷胀,在4℃以上热胀冷缩?冰晶体
冰晶体主要是水分子依靠 而形成的。由于 具有一定的方向性,中央的水分子与周围 个水分子结合,边缘的 个水分子也按照同样的规律再与其他水分子结合,每个氧原子周围都有 个氢原子。这种排列类似于蜂巢结构,比较松散。因此水由液态变成固态时,密度变小。氢键氢键444氢键具有方向性几种典型的分子晶体比较 2.分子晶体的特性分子晶体有低熔点
升华的特性
硬度很小。
表3-2某些分子晶体的熔点
物理性质
(1)分子晶体由于以比较弱的分子间作用力相结合,因此一般熔点_________,硬度______。
(2)对组成和结构______,晶体中又不含氢键的物质来说,随着相对分子质量的增大,分子间作用力______,熔、沸点_______。如卤素单质熔点:Cl2____Br2____I2。再如烷烃相对分子质量越大熔沸点越 。
较低较小相似增强升高<<高 哪些晶体属于分子晶体较典型的分子晶体有:
(1)所有非金属氢化物,如水、硫化氢、氨、氯化氢、甲烷,等等;
(2)部分非金属单质,如卤素(X2)、氧(O2)、硫(S8)、氮(N2)、白磷(P4)、碳60(C60),等等;
(3)部分非金属氧化物,如CO2、P4O6、P4O10、SO2,等等
(4)几乎所有的酸
(5)绝大多数有机物的晶体。 石墨晶体中既有共价键,又有范德华力,
同时还有金属键的特性,为混合型晶体开拓思考
石墨晶体不属于原子晶体,但石墨的熔点为什么高于金刚石?石墨晶体为层状结构,同层内碳原子以共价键结合成平面网状结构,C—C键的键长比金刚石中C—C键的键长短,键能大,所以石墨的熔、沸点高。练习1.分子晶体具有的本质特征是( )
A.组成晶体的基本构成微粒是分子
B.熔融时不导电
C.晶体内微粒间以分子间作用力相结合,这种作用很弱
D.熔点一般比原子晶体低C2.下列物质呈固态时,一定属于分子晶体的是( )
A.非金属单质 B.非金属氧化物
C.含氧酸 D.金属氧化物
解析:选C。要注意考虑一般规律与特例,非金属单质中金刚石、晶体硅、硼均为原子晶体,非金属氧化物中的二氧化硅为原子晶体,活泼金属氧化物为离子晶体,只有含氧酸为分子晶体。3.下列有关物质的熔点高低顺序不正确的是
( )
A.HF>HCl,HCl<HBr
B.CF4<CCl4<CBr4
C.I2>SiO2
D.H2O>H2S,SO2<SeO2
解析:选C。HCl、HBr;CF4、CCl4、CBr4;SO2、SeO2均为组成和结构相似的分子,相对分子质量越大,熔点越高。HF,H2O分子中均存在氢键,所以熔点出现“反常”现象。4.分子晶体在通常情况下不具有的性质是( )
A.晶体构成微粒是分子
B.干燥或熔化时均能导电
C.微粒间以范德华力结合
D.熔点、沸点一般低于原子晶体和离子晶体
B【解析】 分子一般含有共价键,所以干燥或熔化时不能电离出离子,故不能导电。分子间以范德华力结合成晶体,熔点、沸点较低,一般低于原子晶体和离子晶体。
今天这节课我们就来解决这些问题。新授:二、分子晶体1. 分子晶体的构成[分子晶体]
分子间通过分子间作用力结合形成的晶体,称为分子晶体。或者说,只含分子的晶体叫做分子晶体。
[构成]
在分子晶体中,分子内的原子间以共价键结合,而相邻分子靠分子间作用力(又叫范德华力)相互吸引。结构特点方向性由于分子间作用力不具有________,所以分子晶体在堆积排列时尽可能的利用空间采取紧密堆积的方式。
碘晶体
碘晶体的晶胞是一个 ,碘分子除了占据长方体的每个 外,在每个 上还有一个碘分子长方体顶点面干冰干冰晶胞呈 型,其中二氧化碳分子因分子之间的相互作用,在晶胞中呈现 排列 立方体规律性[思考]为何冰的密度小于水的密度?为何水在4℃以下,热缩冷胀,在4℃以上热胀冷缩?冰晶体
冰晶体主要是水分子依靠 而形成的。由于 具有一定的方向性,中央的水分子与周围 个水分子结合,边缘的 个水分子也按照同样的规律再与其他水分子结合,每个氧原子周围都有 个氢原子。这种排列类似于蜂巢结构,比较松散。因此水由液态变成固态时,密度变小。氢键氢键444氢键具有方向性几种典型的分子晶体比较 2.分子晶体的特性分子晶体有低熔点
升华的特性
硬度很小。
表3-2某些分子晶体的熔点
物理性质
(1)分子晶体由于以比较弱的分子间作用力相结合,因此一般熔点_________,硬度______。
(2)对组成和结构______,晶体中又不含氢键的物质来说,随着相对分子质量的增大,分子间作用力______,熔、沸点_______。如卤素单质熔点:Cl2____Br2____I2。再如烷烃相对分子质量越大熔沸点越 。
较低较小相似增强升高<<高 哪些晶体属于分子晶体较典型的分子晶体有:
(1)所有非金属氢化物,如水、硫化氢、氨、氯化氢、甲烷,等等;
(2)部分非金属单质,如卤素(X2)、氧(O2)、硫(S8)、氮(N2)、白磷(P4)、碳60(C60),等等;
(3)部分非金属氧化物,如CO2、P4O6、P4O10、SO2,等等
(4)几乎所有的酸
(5)绝大多数有机物的晶体。 石墨晶体中既有共价键,又有范德华力,
同时还有金属键的特性,为混合型晶体开拓思考
石墨晶体不属于原子晶体,但石墨的熔点为什么高于金刚石?石墨晶体为层状结构,同层内碳原子以共价键结合成平面网状结构,C—C键的键长比金刚石中C—C键的键长短,键能大,所以石墨的熔、沸点高。练习1.分子晶体具有的本质特征是( )
A.组成晶体的基本构成微粒是分子
B.熔融时不导电
C.晶体内微粒间以分子间作用力相结合,这种作用很弱
D.熔点一般比原子晶体低C2.下列物质呈固态时,一定属于分子晶体的是( )
A.非金属单质 B.非金属氧化物
C.含氧酸 D.金属氧化物
解析:选C。要注意考虑一般规律与特例,非金属单质中金刚石、晶体硅、硼均为原子晶体,非金属氧化物中的二氧化硅为原子晶体,活泼金属氧化物为离子晶体,只有含氧酸为分子晶体。3.下列有关物质的熔点高低顺序不正确的是
( )
A.HF>HCl,HCl<HBr
B.CF4<CCl4<CBr4
C.I2>SiO2
D.H2O>H2S,SO2<SeO2
解析:选C。HCl、HBr;CF4、CCl4、CBr4;SO2、SeO2均为组成和结构相似的分子,相对分子质量越大,熔点越高。HF,H2O分子中均存在氢键,所以熔点出现“反常”现象。4.分子晶体在通常情况下不具有的性质是( )
A.晶体构成微粒是分子
B.干燥或熔化时均能导电
C.微粒间以范德华力结合
D.熔点、沸点一般低于原子晶体和离子晶体
B【解析】 分子一般含有共价键,所以干燥或熔化时不能电离出离子,故不能导电。分子间以范德华力结合成晶体,熔点、沸点较低,一般低于原子晶体和离子晶体。
