鲁科版 高中化学 选修3 物质的聚集状态与物质性质复习课(共36张ppt)
文档属性
| 名称 | 鲁科版 高中化学 选修3 物质的聚集状态与物质性质复习课(共36张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 962.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-09 00:00:00 | ||
图片预览









文档简介
课件36张PPT。物质的聚集状态与物质性质
复习课
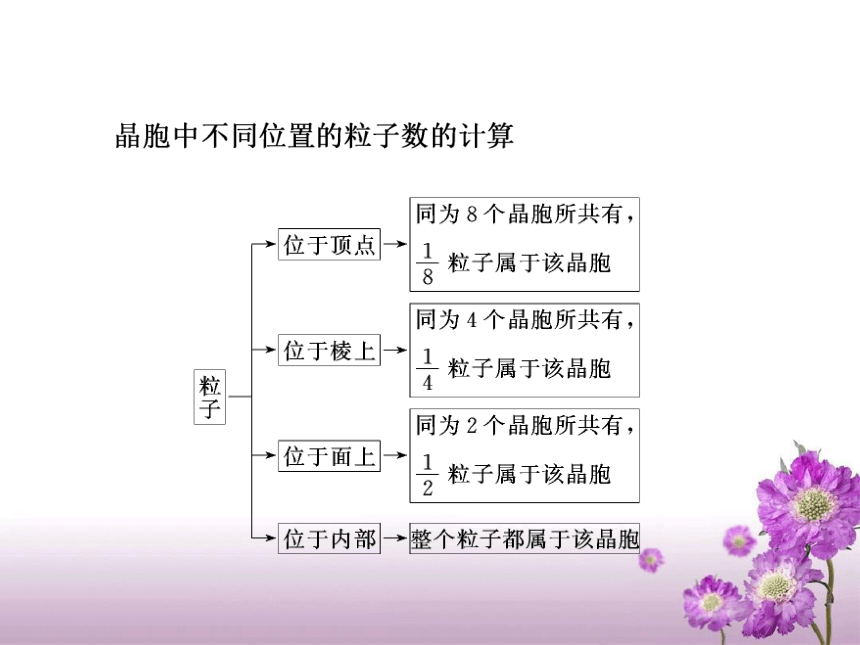
考纲要求:*晶 体定义: 内部微粒(原子、离子、分子)在空间按一定规律做周期性重复排列构成的固体物质。一般晶体有固定的熔沸点。注
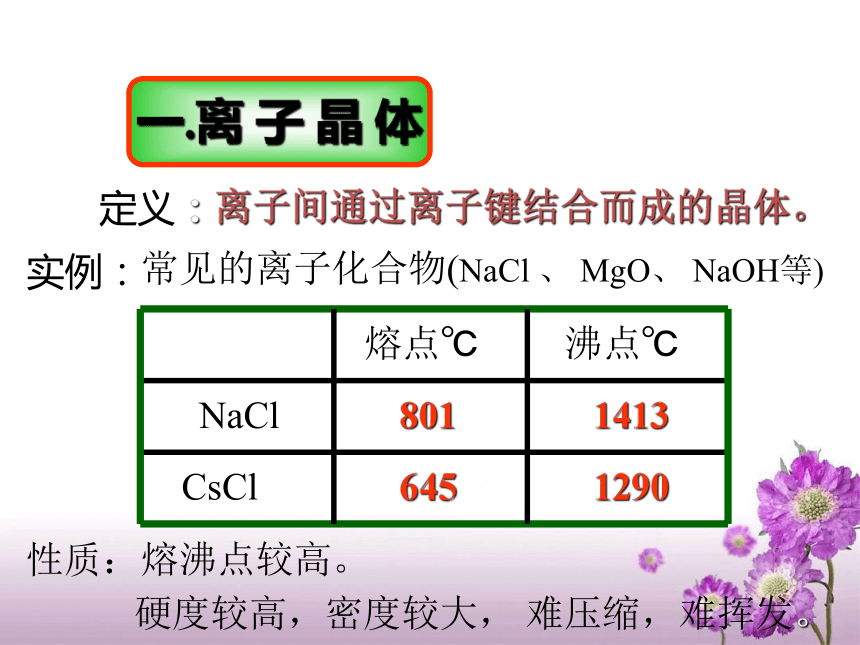
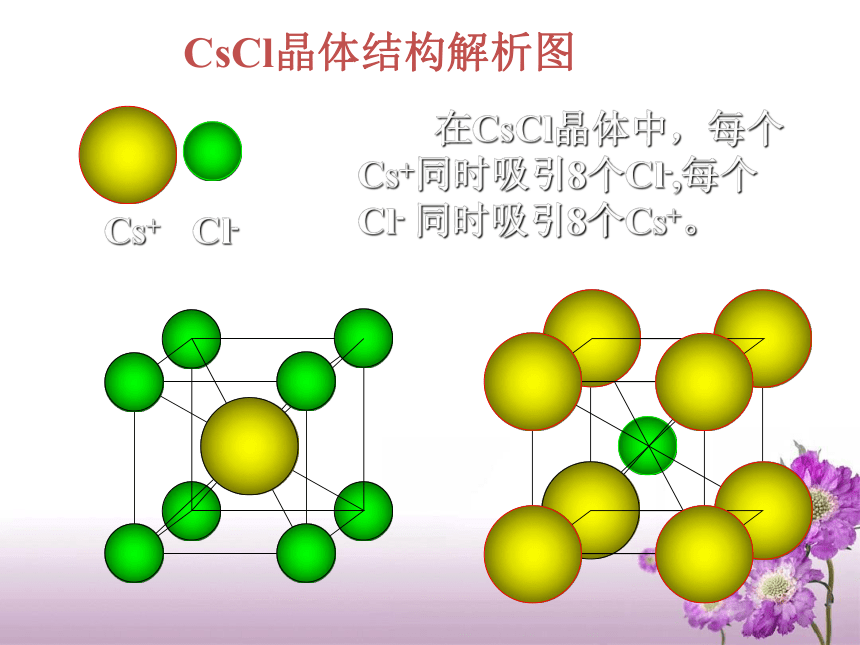
意微粒间的结合力决定晶体的物理性质:特点: 晶体中的微粒(分子、原子或离子)按一定规则排列,微粒间存在作用力。结合力越强,晶体的熔沸点越高, 硬度越大。 晶体之所以具有规则的几何外形,是因其内部的质点作规则的排列,实际上是晶体中最基本的结构单元重复出现的结果。 我们把晶体中重复出现的最基本的结构单元叫晶体的基本单位—— 晶胞对组成晶胞的各质点(晶格点)的占有率如何呢(以立方体形晶胞为例)?晶胞AB练习1:根据离子晶体的晶胞结构,判断下列离子晶体的化学式:(A表示阳离子)化学式:AB一.离 子 晶 体定义:离子间通过离子键结合而成的晶体。硬度较高,密度较大, 难压缩,难挥发。实例:常见的离子化合物(NaCl 、 MgO、 NaOH等)熔沸点较高。性质:CsCl晶体结构示意图CsCl晶体结构解析图 在CsCl晶体中,每个Cs+同时吸引8个Cl-,每个Cl- 同时吸引8个Cs+。离子晶体中,均无单个分子存在,NaCl和CsCl不是分子式。*离子晶体的化学式并不能代表
其真实组成。离子晶体的性质:
1 熔沸点较高
2 一般易溶于水,难溶于非极
性溶剂
3固体不导电,熔融态水溶液
中一般导电 怎样证明分子间存在作用力?说明了物质的分子间存在着作用力。*这种分子间的作用力又叫做范德华力。气态液态固态降温加压降温分子距离缩短分子距离缩短分子无规则运动分子有规则排列二.分子晶 体分子与分子
间的作用力相邻原子间
的相互作用弱(几到几十
kJ/mol)强( 120~
800 kJ/mol)HCl分子中,H-Cl 键能为 431kJ/mol , HCl 分子间的作用力为 21kJ/mol 。氢键范德华力? 氢键 ?? 化学键定义: 分子间通过分子间作用力结合而成的晶体。特点:实例:多数非金属单质(如卤素,氧气)稀有气体(如氦,氖,氩)氢化物(如氨,氯化氢)非金属氧化物(如一氧化碳,二氧化硫)熔沸点较低,硬度较小。有单个分子存在,化学式就是分子式。干冰晶体结构示意图CO2 分子Na+Cl-每个二氧化碳分子周围有12个二氧化碳分子。 分子组成和结构相似时,相对分子质量越大,分子间作用力越大。请解释,卤素单质熔沸点变化规律。 氟、氯、溴、碘的单质均是分子晶体,
双原子分子,每个分子都是通过一个单键结
合而成,随着分子量的增大,分子间作用力
增大,故熔沸点递升。熔、沸点的比较 分子晶体:(一般来说)
A、相对分子质量越大,熔沸点越高
B、相对分子质量相同:
1、分子极性越大,熔沸点越高
如:CO 〉N2
2、支链越多,熔沸点越低
如:正戊烷〉异戊烷〉新戊烷
3、芳香族化合物:邻〉间〉对位化合物
三.原子晶体定义:原子间以共价键相结合而形成的空间网状结构的晶体。性质:熔沸点高,硬度大,难溶于一般溶剂。 实例:金刚石、晶体硅、SiO2、金刚砂( SiC )石墨晶体结构示意图C原子正六边形结构单元每一层是正六边形平面网状结构,相邻碳原子以共价键结合石墨晶体是层状结构金属原子自由电子四.金属晶体有的熔沸点很高(钨) ,有的熔沸点却很低(汞)物质熔沸点比较的规律 ⑴ 不同晶体熔沸点比较 ⑵ 组成相似的离子晶体,离子半径越小,离子电荷越大,离
子键越强,晶体的熔沸点越高。 ⑷ 组成和结构相似的分子晶体,式量越大,熔沸点越高。⑶ 原子晶体:原子半径越小,键长越短,键能越大,键越强 原子晶体 > 离子晶体 > 分子晶体 KF KCl KBr Al2O3 MgO 如 金刚石 碳化硅 晶体硅 F2 Cl2 Br2 I2 HCl HBr HI晶体熔沸点越高。 > >> >>< < << <2(上海)下列化学式既能表示物质的组成,又能表示物质的分子式的是( )
(A)NH4NO3
(B) SiO2
(C) C6H5NO2
(D) CuC 离子晶体 离子晶体、原子晶体、金属晶体中,实际不存在单个的分子,只有分子晶体的化学式才可以代表其真实组成。 原子晶体分子晶体金属晶体解析:选C。A、B项属于无氢键存在的分子结构相似的情况,相对分子质量大的熔、沸点高;C项属于分子结构相似的情况,但存在氢键的熔、沸点高;D项属于相对分子质量相同,但分子结构不同的情况,支链少的熔、沸点高。
复习课
考纲要求:*晶 体定义: 内部微粒(原子、离子、分子)在空间按一定规律做周期性重复排列构成的固体物质。一般晶体有固定的熔沸点。注
意微粒间的结合力决定晶体的物理性质:特点: 晶体中的微粒(分子、原子或离子)按一定规则排列,微粒间存在作用力。结合力越强,晶体的熔沸点越高, 硬度越大。 晶体之所以具有规则的几何外形,是因其内部的质点作规则的排列,实际上是晶体中最基本的结构单元重复出现的结果。 我们把晶体中重复出现的最基本的结构单元叫晶体的基本单位—— 晶胞对组成晶胞的各质点(晶格点)的占有率如何呢(以立方体形晶胞为例)?晶胞AB练习1:根据离子晶体的晶胞结构,判断下列离子晶体的化学式:(A表示阳离子)化学式:AB一.离 子 晶 体定义:离子间通过离子键结合而成的晶体。硬度较高,密度较大, 难压缩,难挥发。实例:常见的离子化合物(NaCl 、 MgO、 NaOH等)熔沸点较高。性质:CsCl晶体结构示意图CsCl晶体结构解析图 在CsCl晶体中,每个Cs+同时吸引8个Cl-,每个Cl- 同时吸引8个Cs+。离子晶体中,均无单个分子存在,NaCl和CsCl不是分子式。*离子晶体的化学式并不能代表
其真实组成。离子晶体的性质:
1 熔沸点较高
2 一般易溶于水,难溶于非极
性溶剂
3固体不导电,熔融态水溶液
中一般导电 怎样证明分子间存在作用力?说明了物质的分子间存在着作用力。*这种分子间的作用力又叫做范德华力。气态液态固态降温加压降温分子距离缩短分子距离缩短分子无规则运动分子有规则排列二.分子晶 体分子与分子
间的作用力相邻原子间
的相互作用弱(几到几十
kJ/mol)强( 120~
800 kJ/mol)HCl分子中,H-Cl 键能为 431kJ/mol , HCl 分子间的作用力为 21kJ/mol 。氢键范德华力? 氢键 ?? 化学键定义: 分子间通过分子间作用力结合而成的晶体。特点:实例:多数非金属单质(如卤素,氧气)稀有气体(如氦,氖,氩)氢化物(如氨,氯化氢)非金属氧化物(如一氧化碳,二氧化硫)熔沸点较低,硬度较小。有单个分子存在,化学式就是分子式。干冰晶体结构示意图CO2 分子Na+Cl-每个二氧化碳分子周围有12个二氧化碳分子。 分子组成和结构相似时,相对分子质量越大,分子间作用力越大。请解释,卤素单质熔沸点变化规律。 氟、氯、溴、碘的单质均是分子晶体,
双原子分子,每个分子都是通过一个单键结
合而成,随着分子量的增大,分子间作用力
增大,故熔沸点递升。熔、沸点的比较 分子晶体:(一般来说)
A、相对分子质量越大,熔沸点越高
B、相对分子质量相同:
1、分子极性越大,熔沸点越高
如:CO 〉N2
2、支链越多,熔沸点越低
如:正戊烷〉异戊烷〉新戊烷
3、芳香族化合物:邻〉间〉对位化合物
三.原子晶体定义:原子间以共价键相结合而形成的空间网状结构的晶体。性质:熔沸点高,硬度大,难溶于一般溶剂。 实例:金刚石、晶体硅、SiO2、金刚砂( SiC )石墨晶体结构示意图C原子正六边形结构单元每一层是正六边形平面网状结构,相邻碳原子以共价键结合石墨晶体是层状结构金属原子自由电子四.金属晶体有的熔沸点很高(钨) ,有的熔沸点却很低(汞)物质熔沸点比较的规律 ⑴ 不同晶体熔沸点比较 ⑵ 组成相似的离子晶体,离子半径越小,离子电荷越大,离
子键越强,晶体的熔沸点越高。 ⑷ 组成和结构相似的分子晶体,式量越大,熔沸点越高。⑶ 原子晶体:原子半径越小,键长越短,键能越大,键越强 原子晶体 > 离子晶体 > 分子晶体 KF KCl KBr Al2O3 MgO 如 金刚石 碳化硅 晶体硅 F2 Cl2 Br2 I2 HCl HBr HI晶体熔沸点越高。 > >> >>< < << <2(上海)下列化学式既能表示物质的组成,又能表示物质的分子式的是( )
(A)NH4NO3
(B) SiO2
(C) C6H5NO2
(D) CuC 离子晶体 离子晶体、原子晶体、金属晶体中,实际不存在单个的分子,只有分子晶体的化学式才可以代表其真实组成。 原子晶体分子晶体金属晶体解析:选C。A、B项属于无氢键存在的分子结构相似的情况,相对分子质量大的熔、沸点高;C项属于分子结构相似的情况,但存在氢键的熔、沸点高;D项属于相对分子质量相同,但分子结构不同的情况,支链少的熔、沸点高。
