鲁科版 高中化学 选修3 1.1 原子结构模型(共32张ppt)
文档属性
| 名称 | 鲁科版 高中化学 选修3 1.1 原子结构模型(共32张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 960.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-09 00:00:00 | ||
图片预览











文档简介
课件32张PPT。 物质结构理论是现代化学的重要组成部分,也是医学、生命科学、材料科学、环境科学、能源科学、信息科学的重要基础。
它揭示了物质构成的奥秘、物质结构与性质的关系,有助于人们理解物质变化的本质,预测物质的性质,为分子设计提供科学依据。
本教材分为三章:原子结构、微粒间的相互作用和物质的聚集状态与物质性质。第一章 原子结构第一节 原子结构模型第二节 原子结构与元素周期表第三节 原子结构与元素性质教学目标:
1、知道核外电子的运动不同于宏观物体,不能同时准确测定它的位置和速度;初步认识原子结构的量子力学模型,知道原子中单个电子的空间运动状态用原子轨道来描述;认识到原子轨道的能量是量子化的,原子轨道的能量用能级来描述;知道电子云是对电子在空间单位体积里出现概率大小的形象化描述。
2、知道科学假说模型在原子结构建立中的重要作用。
3、通过原子结构量子力学模型建立的历史,感受科学家在科学创造中的丰功伟绩。
知识与技能:了解核外电子空间运动状态的描述方法,从能级和概率统计两个视角认识核外电子运动的特点。
过程与方法:知道科学假说模型在原子结构建立中的重要作用。第一节 原子结构模型不同时期的原子结构模型: 庄子:一尺之棰,日取其半,
万世不竭。
墨子:非半弗斫,则不动,
说在端。 1、公元前400多年前,希腊哲学家德谟克利特等人认为 :把构成物质的最小单位叫原子。但这是一种很懵懂的认识。2、道尔顿实心球模型 1803年英国自然科学家约翰·道尔顿提出了世界上第一个原子的理论模型。 道尔顿的理论主要有以下三点:
①原子都是不能再分的粒子
②同种元素的原子的各种性质和质量都相同
③原子是微小的实心球体
按照道尔顿的理论,原子是既不能创造,也不能毁灭,又不能再分割的最最基本的物质粒子。那么,放电管中的“射线”是什么呢?汤姆逊用实验回答说:是电子,并且在各种元素的原子中都有电子。这样看来,原子就不是不可再分的了!也就是说,原子不是最最基本的物质粒子了! 3、1903年汤姆逊在发现电子的基础上 提出了原子的“葡萄干布丁模型”。汤姆逊认为:
①电子是平均的分布在整个原子上的,就如同散布在一个均匀的正电荷的海洋之中,它们的负电荷与那些正电荷相互抵消。
②在受到激发时,电子会离开原子,产生阴极射线。
汤姆逊的学生卢瑟福完成的α粒子轰击金箔实验(散射实验),否认了葡萄干布丁模型的正确性。 葡萄干布丁
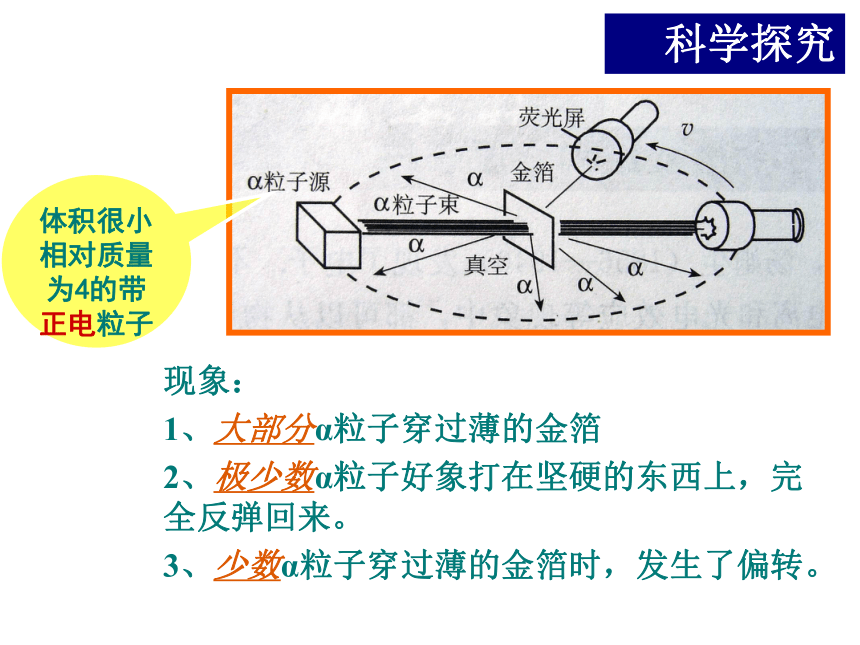
模型4、卢瑟福原子模型根据Α粒子散射实验原子的“核式模型”体积很小相对质量为4的带正电粒子现象:
1、大部分α粒子穿过薄的金箔
2、极少数α粒子好象打在坚硬的东西上,完全反弹回来。
3、少数α粒子穿过薄的金箔时,发生了偏转。科学探究卢瑟福通过实验推断出:
1、原子大部分是空的。
2、中间有一个几乎集中了所有原子的质量且体积很小的粒子——原子核。
3、原子的全部正电荷在原子核内,且几乎全部质量均集中在原子核内部。带负电的电子在核空间进行绕核运动。
5、玻尔原子模型6、原子结构的量子力学模型
(电子云模型)【小结】人类对原子结构的认识历史:德谟克利特:朴素原子观道尔顿:原子学说汤姆逊:“葡萄干布丁” 模型卢瑟福:核式原子结构模型玻尔:原子轨道模型现代量子力学模型:两组物理学家建立的[知识支持] 教材P3
连续光谱(continuous spectrum):线状光谱(原子光谱)(line spectrum): 若由光谱仪获得的光谱是由各种波长的光所组成,且相近的波长差别极小而不能分辨,则所得光谱为连续光谱。如阳光等。 若由光谱仪获得的光谱是由具有特定波长的、彼此分立的谱线所组成的,则所得光谱为线状光谱。如氢原子光谱等。教材P3 图1-1-21、氢原子光谱狭义的光:波长400~700nm之间的电磁波;广义的光:即电磁波,包括可见光、红外光、紫外光、X射线等。氢原子的线状光谱太阳光的连续光谱 [质疑]
根据卢瑟福的原子结构模型和经典的电磁学观点,围绕原子核高速运动的电子一定会自动且连续地辐射能量,其光谱应是连续光谱而不应是线状光谱。那么,氢原子的光谱为什么是线性光谱而不是连续光谱呢? 2、在卢瑟福的原子
结构模型的基础上提出
玻尔(Bohr)的原子结构
模型 (玻尔理论的
三个假设)。玻尔原子结构模型的基本观点(1) 原子中的电子在具有确定半径的圆周轨道上绕原子核运动,并且不辐射能量。(2)不同轨道上运动的电子具有不同能量,而且能量是量子化的, 即能量是“一份一份”的,不能连续变化而只能取某些不连续的数值,轨道能量依n值(1、2、3、·····)的增大而升高,n称为量子数。通俗说法:核外电子分层排布, n表示电子层数
对氢原子而言,电子处在n=1的轨道是能量最低,称为基态,能量高于基态的状态,称为激发态;(3)只有当电子从一个轨道(能量为Ei)跃迁到另一个轨道(能量为Ej)时,才会辐射或吸收能量。如果辐射或吸收的能量以光的形式表现并被记录下来,就形成了光谱。2、电子处于能量最低的状态,称为基态。电子能量处于高于基态的状态,称为激发态。【小结】1、玻尔原子结构模型要点:
(1)电子在具有能量轨道上运动,不辐射能量;
(2)电子的能量是量子化的。(电子分层排布)
(3)电子发生跃迁时,才会不连续的辐射或吸收能量。拓宽应用
1、依据玻尔原子结构模型基本观点解释氢原子光谱是怎样产生的?为什么会有多条谱线?参照课本P3——4页“追根寻源” 电子从一个轨道跃迁到另一轨道时,就要吸收或放出能量,两个定态的能量差为?E。如能量以光辐射的形式表现出来,就形成了光谱。?E = E2- E1= h? (?=c/?)为什么氢光谱是线状光谱?n=4
n=3
n=2
n=1
吸收能量释放能量
发射光谱氢原子从一个电子
层跃迁到另一个电
子层时,吸收或释
放一定的能量,就
会吸收或释放一定
波长的光,
所以得到线状光谱[身边的化学] 阅读教材P4
了解“霓虹灯为什么能够发出五颜六色的光?” 电子在发生跃迁时辐射或吸收能量是量子化的,对霓虹灯而言,灯管中装载的气体不同,在高电压的激发下发出的光的颜色就不同。玻尔理论的局限:
A. 多电子原子光谱
B. 氢原子的精细光谱原子核外电子运动描述方法:电子云本节小结1、氢原子光谱
连续光谱
线状光谱
2、玻尔(Bohr)的原子结构模型
(玻尔理论的三个假设)。
3、解释、应用:
追根寻源、身边的化学等
它揭示了物质构成的奥秘、物质结构与性质的关系,有助于人们理解物质变化的本质,预测物质的性质,为分子设计提供科学依据。
本教材分为三章:原子结构、微粒间的相互作用和物质的聚集状态与物质性质。第一章 原子结构第一节 原子结构模型第二节 原子结构与元素周期表第三节 原子结构与元素性质教学目标:
1、知道核外电子的运动不同于宏观物体,不能同时准确测定它的位置和速度;初步认识原子结构的量子力学模型,知道原子中单个电子的空间运动状态用原子轨道来描述;认识到原子轨道的能量是量子化的,原子轨道的能量用能级来描述;知道电子云是对电子在空间单位体积里出现概率大小的形象化描述。
2、知道科学假说模型在原子结构建立中的重要作用。
3、通过原子结构量子力学模型建立的历史,感受科学家在科学创造中的丰功伟绩。
知识与技能:了解核外电子空间运动状态的描述方法,从能级和概率统计两个视角认识核外电子运动的特点。
过程与方法:知道科学假说模型在原子结构建立中的重要作用。第一节 原子结构模型不同时期的原子结构模型: 庄子:一尺之棰,日取其半,
万世不竭。
墨子:非半弗斫,则不动,
说在端。 1、公元前400多年前,希腊哲学家德谟克利特等人认为 :把构成物质的最小单位叫原子。但这是一种很懵懂的认识。2、道尔顿实心球模型 1803年英国自然科学家约翰·道尔顿提出了世界上第一个原子的理论模型。 道尔顿的理论主要有以下三点:
①原子都是不能再分的粒子
②同种元素的原子的各种性质和质量都相同
③原子是微小的实心球体
按照道尔顿的理论,原子是既不能创造,也不能毁灭,又不能再分割的最最基本的物质粒子。那么,放电管中的“射线”是什么呢?汤姆逊用实验回答说:是电子,并且在各种元素的原子中都有电子。这样看来,原子就不是不可再分的了!也就是说,原子不是最最基本的物质粒子了! 3、1903年汤姆逊在发现电子的基础上 提出了原子的“葡萄干布丁模型”。汤姆逊认为:
①电子是平均的分布在整个原子上的,就如同散布在一个均匀的正电荷的海洋之中,它们的负电荷与那些正电荷相互抵消。
②在受到激发时,电子会离开原子,产生阴极射线。
汤姆逊的学生卢瑟福完成的α粒子轰击金箔实验(散射实验),否认了葡萄干布丁模型的正确性。 葡萄干布丁
模型4、卢瑟福原子模型根据Α粒子散射实验原子的“核式模型”体积很小相对质量为4的带正电粒子现象:
1、大部分α粒子穿过薄的金箔
2、极少数α粒子好象打在坚硬的东西上,完全反弹回来。
3、少数α粒子穿过薄的金箔时,发生了偏转。科学探究卢瑟福通过实验推断出:
1、原子大部分是空的。
2、中间有一个几乎集中了所有原子的质量且体积很小的粒子——原子核。
3、原子的全部正电荷在原子核内,且几乎全部质量均集中在原子核内部。带负电的电子在核空间进行绕核运动。
5、玻尔原子模型6、原子结构的量子力学模型
(电子云模型)【小结】人类对原子结构的认识历史:德谟克利特:朴素原子观道尔顿:原子学说汤姆逊:“葡萄干布丁” 模型卢瑟福:核式原子结构模型玻尔:原子轨道模型现代量子力学模型:两组物理学家建立的[知识支持] 教材P3
连续光谱(continuous spectrum):线状光谱(原子光谱)(line spectrum): 若由光谱仪获得的光谱是由各种波长的光所组成,且相近的波长差别极小而不能分辨,则所得光谱为连续光谱。如阳光等。 若由光谱仪获得的光谱是由具有特定波长的、彼此分立的谱线所组成的,则所得光谱为线状光谱。如氢原子光谱等。教材P3 图1-1-21、氢原子光谱狭义的光:波长400~700nm之间的电磁波;广义的光:即电磁波,包括可见光、红外光、紫外光、X射线等。氢原子的线状光谱太阳光的连续光谱 [质疑]
根据卢瑟福的原子结构模型和经典的电磁学观点,围绕原子核高速运动的电子一定会自动且连续地辐射能量,其光谱应是连续光谱而不应是线状光谱。那么,氢原子的光谱为什么是线性光谱而不是连续光谱呢? 2、在卢瑟福的原子
结构模型的基础上提出
玻尔(Bohr)的原子结构
模型 (玻尔理论的
三个假设)。玻尔原子结构模型的基本观点(1) 原子中的电子在具有确定半径的圆周轨道上绕原子核运动,并且不辐射能量。(2)不同轨道上运动的电子具有不同能量,而且能量是量子化的, 即能量是“一份一份”的,不能连续变化而只能取某些不连续的数值,轨道能量依n值(1、2、3、·····)的增大而升高,n称为量子数。通俗说法:核外电子分层排布, n表示电子层数
对氢原子而言,电子处在n=1的轨道是能量最低,称为基态,能量高于基态的状态,称为激发态;(3)只有当电子从一个轨道(能量为Ei)跃迁到另一个轨道(能量为Ej)时,才会辐射或吸收能量。如果辐射或吸收的能量以光的形式表现并被记录下来,就形成了光谱。2、电子处于能量最低的状态,称为基态。电子能量处于高于基态的状态,称为激发态。【小结】1、玻尔原子结构模型要点:
(1)电子在具有能量轨道上运动,不辐射能量;
(2)电子的能量是量子化的。(电子分层排布)
(3)电子发生跃迁时,才会不连续的辐射或吸收能量。拓宽应用
1、依据玻尔原子结构模型基本观点解释氢原子光谱是怎样产生的?为什么会有多条谱线?参照课本P3——4页“追根寻源” 电子从一个轨道跃迁到另一轨道时,就要吸收或放出能量,两个定态的能量差为?E。如能量以光辐射的形式表现出来,就形成了光谱。?E = E2- E1= h? (?=c/?)为什么氢光谱是线状光谱?n=4
n=3
n=2
n=1
吸收能量释放能量
发射光谱氢原子从一个电子
层跃迁到另一个电
子层时,吸收或释
放一定的能量,就
会吸收或释放一定
波长的光,
所以得到线状光谱[身边的化学] 阅读教材P4
了解“霓虹灯为什么能够发出五颜六色的光?” 电子在发生跃迁时辐射或吸收能量是量子化的,对霓虹灯而言,灯管中装载的气体不同,在高电压的激发下发出的光的颜色就不同。玻尔理论的局限:
A. 多电子原子光谱
B. 氢原子的精细光谱原子核外电子运动描述方法:电子云本节小结1、氢原子光谱
连续光谱
线状光谱
2、玻尔(Bohr)的原子结构模型
(玻尔理论的三个假设)。
3、解释、应用:
追根寻源、身边的化学等
