鲁科版 高中化学 选修4 第2章 第1 节化学反应的方向(共18张ppt)
文档属性
| 名称 | 鲁科版 高中化学 选修4 第2章 第1 节化学反应的方向(共18张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 165.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-09 00:00:00 | ||
图片预览



文档简介
课件18张PPT。第一节化学反应中的热效应(第三课时)焓变的计算
——盖斯定律的应用
教学目标:知识与技能
1.理解盖斯定律的本质,了解其在科学研究中的意义
2.掌握有关盖斯定律的应用(本课时的重、难点)
过程与方法
通过运用盖斯定律求有关物质的焓变,进一步理解焓变的概念
情感态度与价值观
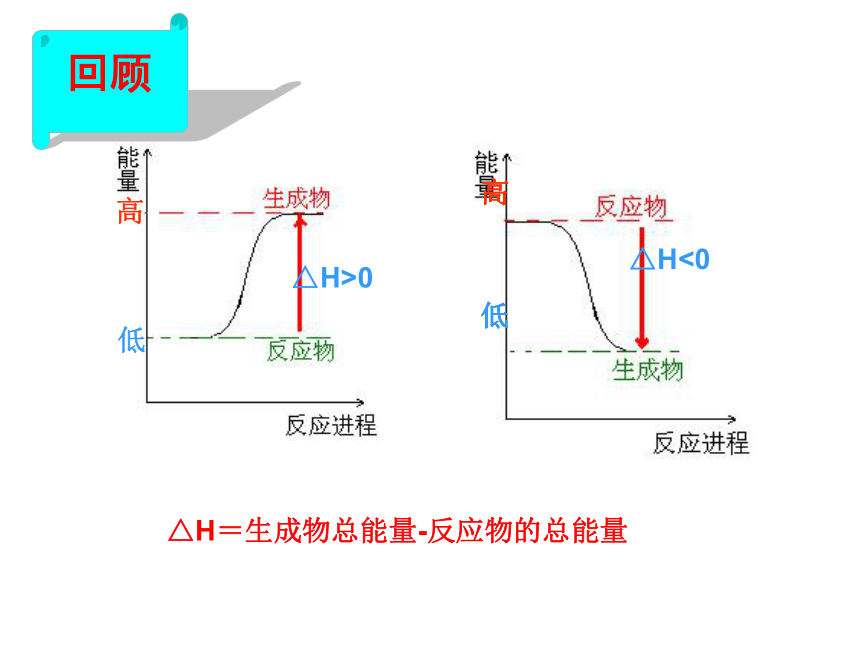
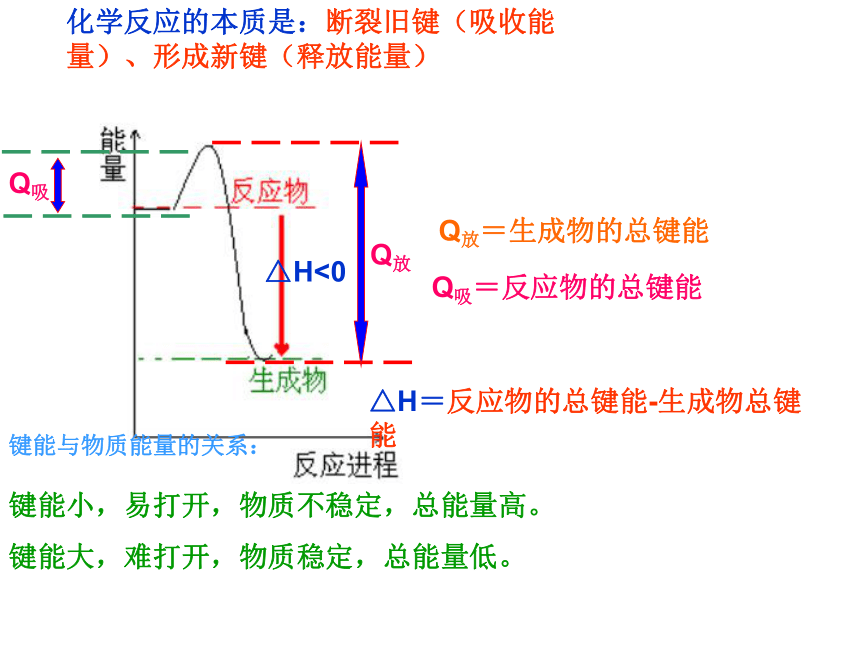
通过实例感受盖斯定律的应用,并以此说明盖斯定律在科学研究中的重要贡献△H<0高低△H>0△H=生成物总能量-反应物的总能量回顾高低化学反应的本质是:断裂旧键(吸收能量)、形成新键(释放能量)Q吸=反应物的总键能Q放=生成物的总键能键能与物质能量的关系:键能小,易打开,物质不稳定,总能量高。
键能大,难打开,物质稳定,总能量低。△H=反应物的总键能-生成物总键能如何测定C(s)+1/2O2(g)=CO(g)的焓变△H1①能直接测定吗?如何测?
②若不能直接测,怎么办?不能很好的控制反应进行的程度,故不能直接通过实验测得△H1问题
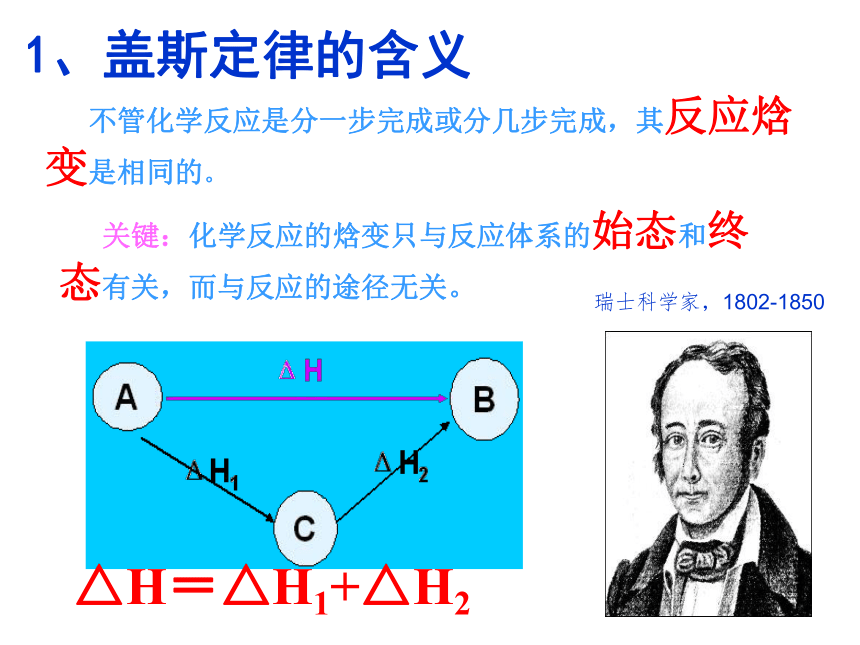
情景1、盖斯定律的含义
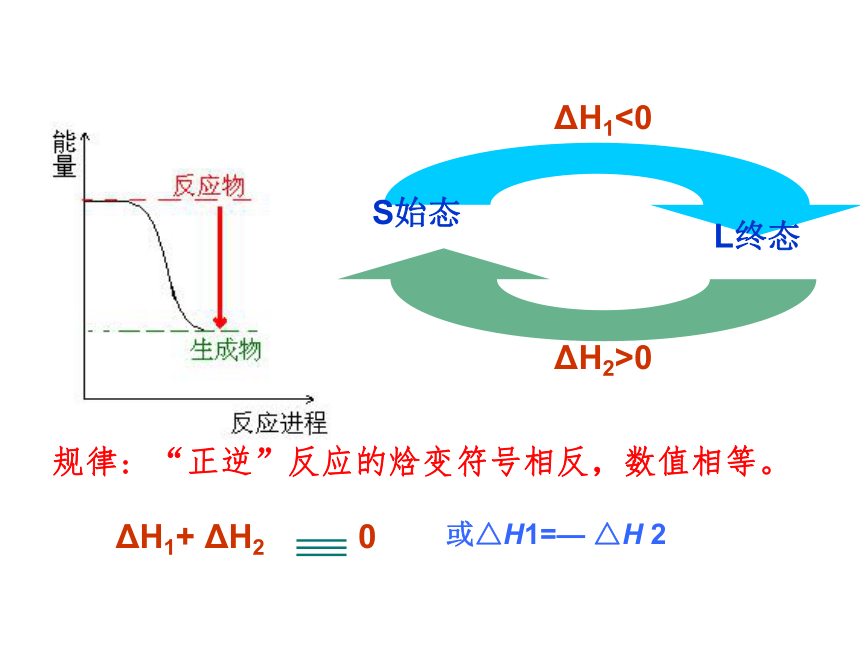
△H=△H1+△H2 不管化学反应是分一步完成或分几步完成,其反应焓变是相同的。 关键:化学反应的焓变只与反应体系的始态和终态有关,而与反应的途径无关。 瑞士科学家,1802-1850或△H1=— △H 2请把下面生活实例与盖斯定律进行类比登山:登山的高度(300m)与上山的途径无关,只与起点和终点的相对高度有关
坐缆车
或步行如何测定C(s)+1/2O2(g)=CO(g)的焓变△H1不能很好的控制反应的程度,故不能直接通过实验测得△H1问题
情景CO(g)+1/2O2(g) = CO2(g) △H2=-283.0 kJ/molC(s)+O2(g) = CO2(g) △H3=-393.5 kJ/mol CO(g)C(s)CO2(g)分析:C(s)+1/2O2(g) = CO(g) △H1=?CO(g)+1/2O2(g) = CO2(g) △H2=-283.0 kJ/molC(s)+O2(g) = CO2(g) △H3=-393.5 kJ/mol—)△H1 + △H2 = △H3 ∴△H1 = △H3 - △H2
= -393.5 kJ/mol -(-283.0 kJ/mol)
= -110.5 kJ/mol2、盖斯定律的应用---求焓变方法(消元法)
写出目标方程式确定“多余物质”(要消去的物质)然后用消元法逐一消去“多余物质”,导出“四则运算式”ΔH3=ΔH1+ΔH2
ΔH1=ΔH3-ΔH2应用:有些化学反应进行很慢或不易直接发生,很难直接测得这些反应的焓变,可通过盖斯定律获得它们的焓变数据。【例题1】已知
① CO(g) + 1/2 O2(g) =CO2(g) ΔH1= -283.0 kJ/mol
② H2(g) + 1/2 O2(g) = H2O(l) ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3 O2(g) = 2 CO2(g) + 3 H2O(l) ΔH3= —1370 kJ/mol
试计算④2CO(g)+ 4 H2(g) = H2O(l)+ C2H5OH(l) 的ΔH【解法一:消元法】:根据盖斯定律,不论是一步完成还是分几步完成,其反应焓变都是相同的。反应④是否由①②③三个反应通过加减乘除消去O2而成,也就是说,反应④看做分成①②③几步完成。①×2 + ②×4 - ③ = ④ ?? 所以,ΔH=ΔH1×2 +ΔH2×4 -ΔH3 ?????=-283.2×2 -285.8×4 +1370 =-339.2 kJ/mol【解法二:唯一法】:对于比较复杂的几步反应,可以换个角度:
找唯一,调方向,改倍数,不多余,目标反应中的CO、H2、
C2H5OH都只在一个方程式中出现, ① ×2+ ② ×4 - ③
即:ΔH=ΔH1×2 +ΔH2×4 -ΔH3 ?????=-283.2×2 -285.8×4 +1370 =-339.2 kJ/mol练习:1、已知下列各反应的焓变
①Ca(s)+C(s,石墨)+3/2O2(g)=CaCO3(s)
△H = -1206.8 kJ/mol
②Ca(s)+1/2O2(g)=CaO(s)
△H = -635.1 kJ/mol
③C(s,石墨)+O2(g)=CO2(g)
△H = -393.5 kJ/mol
试求④CaCO3(s)=CaO(s)+CO2(g)的焓变△H=+178.2 kJ/mol④=②+③-① 若多步化学反应相加减可得到新的化学反应,则新反应的焓变即为上述多步反应的焓变之代数和。总结规律:注意:
计量数的变化与焓变数值及正负号的变化要对应
总结思考:
在用方程式叠加计算焓变时要注意哪些问题?2、如下图所示,△H1=-393.5 kJ?mol-1,△H2=-395.4 kJ?mol-1,下列说法或表示式正确的是( )
A.石墨和金刚石的转化是物理变化
B. C(s、石墨)=C(s、金刚石) △H= +1.9 kJ?mol-1
C. 金刚石的稳定性强于石墨
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJB巩固提升1、已知25℃、101kPa条件下:
4Al (s) + 3O2 (g) == 2Al2O3 (s) △H = -2834.9 kJ·mol-1
4Al (s) +2O3 (g) == 2Al2O3 (s) △H = -3119.9 kJ·mol-1
由此得出的结论正确的是 ( )
A.等质量的O2比O3能量低,由O2变O3 为放热反应
B.等质量的O2比O3能量低,由O2变O3 为吸热反应
C.O3比O2稳定,由O2变O3 为吸热反应
D.O2比O3稳定,由O2变O3 为放热反应B2、由金红石?TiO2?制取单质Ti,涉及到的步骤为::TiCl4
已知:① C?s?+O2?g?=CO2?g? ?H=?393?5 kJ·mol?1
② 2CO?g?+O2?g?=2CO2?g? ?H=?566 kJ·mol?1
③ TiO2?s?+2Cl2?g?=TiCl4?s?+O2?g? ?H=+141 kJ·mol?1
则TiO2?s?+2Cl2?g?+2C?s?=TiCl4?s?+2CO?g?的?H= TiO2Ti—80kJ.mol-11.盖斯定律
不管化学反应是分一步完成或分几步完成,其焓变是相同的。化学反应的焓变只与反应体系的始态和终态有关,而与反应的途径无关。 2、盖斯定律的应用关键:目标方程式的“四则运算式”的导出。方法:消元法(简单的反应):消去多余物质
唯一法(复杂的反应):寻找唯一物质小结
——盖斯定律的应用
教学目标:知识与技能
1.理解盖斯定律的本质,了解其在科学研究中的意义
2.掌握有关盖斯定律的应用(本课时的重、难点)
过程与方法
通过运用盖斯定律求有关物质的焓变,进一步理解焓变的概念
情感态度与价值观
通过实例感受盖斯定律的应用,并以此说明盖斯定律在科学研究中的重要贡献△H<0高低△H>0△H=生成物总能量-反应物的总能量回顾高低化学反应的本质是:断裂旧键(吸收能量)、形成新键(释放能量)Q吸=反应物的总键能Q放=生成物的总键能键能与物质能量的关系:键能小,易打开,物质不稳定,总能量高。
键能大,难打开,物质稳定,总能量低。△H=反应物的总键能-生成物总键能如何测定C(s)+1/2O2(g)=CO(g)的焓变△H1①能直接测定吗?如何测?
②若不能直接测,怎么办?不能很好的控制反应进行的程度,故不能直接通过实验测得△H1问题
情景1、盖斯定律的含义
△H=△H1+△H2 不管化学反应是分一步完成或分几步完成,其反应焓变是相同的。 关键:化学反应的焓变只与反应体系的始态和终态有关,而与反应的途径无关。 瑞士科学家,1802-1850或△H1=— △H 2请把下面生活实例与盖斯定律进行类比登山:登山的高度(300m)与上山的途径无关,只与起点和终点的相对高度有关
坐缆车
或步行如何测定C(s)+1/2O2(g)=CO(g)的焓变△H1不能很好的控制反应的程度,故不能直接通过实验测得△H1问题
情景CO(g)+1/2O2(g) = CO2(g) △H2=-283.0 kJ/molC(s)+O2(g) = CO2(g) △H3=-393.5 kJ/mol CO(g)C(s)CO2(g)分析:C(s)+1/2O2(g) = CO(g) △H1=?CO(g)+1/2O2(g) = CO2(g) △H2=-283.0 kJ/molC(s)+O2(g) = CO2(g) △H3=-393.5 kJ/mol—)△H1 + △H2 = △H3 ∴△H1 = △H3 - △H2
= -393.5 kJ/mol -(-283.0 kJ/mol)
= -110.5 kJ/mol2、盖斯定律的应用---求焓变方法(消元法)
写出目标方程式确定“多余物质”(要消去的物质)然后用消元法逐一消去“多余物质”,导出“四则运算式”ΔH3=ΔH1+ΔH2
ΔH1=ΔH3-ΔH2应用:有些化学反应进行很慢或不易直接发生,很难直接测得这些反应的焓变,可通过盖斯定律获得它们的焓变数据。【例题1】已知
① CO(g) + 1/2 O2(g) =CO2(g) ΔH1= -283.0 kJ/mol
② H2(g) + 1/2 O2(g) = H2O(l) ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3 O2(g) = 2 CO2(g) + 3 H2O(l) ΔH3= —1370 kJ/mol
试计算④2CO(g)+ 4 H2(g) = H2O(l)+ C2H5OH(l) 的ΔH【解法一:消元法】:根据盖斯定律,不论是一步完成还是分几步完成,其反应焓变都是相同的。反应④是否由①②③三个反应通过加减乘除消去O2而成,也就是说,反应④看做分成①②③几步完成。①×2 + ②×4 - ③ = ④ ?? 所以,ΔH=ΔH1×2 +ΔH2×4 -ΔH3 ?????=-283.2×2 -285.8×4 +1370 =-339.2 kJ/mol【解法二:唯一法】:对于比较复杂的几步反应,可以换个角度:
找唯一,调方向,改倍数,不多余,目标反应中的CO、H2、
C2H5OH都只在一个方程式中出现, ① ×2+ ② ×4 - ③
即:ΔH=ΔH1×2 +ΔH2×4 -ΔH3 ?????=-283.2×2 -285.8×4 +1370 =-339.2 kJ/mol练习:1、已知下列各反应的焓变
①Ca(s)+C(s,石墨)+3/2O2(g)=CaCO3(s)
△H = -1206.8 kJ/mol
②Ca(s)+1/2O2(g)=CaO(s)
△H = -635.1 kJ/mol
③C(s,石墨)+O2(g)=CO2(g)
△H = -393.5 kJ/mol
试求④CaCO3(s)=CaO(s)+CO2(g)的焓变△H=+178.2 kJ/mol④=②+③-① 若多步化学反应相加减可得到新的化学反应,则新反应的焓变即为上述多步反应的焓变之代数和。总结规律:注意:
计量数的变化与焓变数值及正负号的变化要对应
总结思考:
在用方程式叠加计算焓变时要注意哪些问题?2、如下图所示,△H1=-393.5 kJ?mol-1,△H2=-395.4 kJ?mol-1,下列说法或表示式正确的是( )
A.石墨和金刚石的转化是物理变化
B. C(s、石墨)=C(s、金刚石) △H= +1.9 kJ?mol-1
C. 金刚石的稳定性强于石墨
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJB巩固提升1、已知25℃、101kPa条件下:
4Al (s) + 3O2 (g) == 2Al2O3 (s) △H = -2834.9 kJ·mol-1
4Al (s) +2O3 (g) == 2Al2O3 (s) △H = -3119.9 kJ·mol-1
由此得出的结论正确的是 ( )
A.等质量的O2比O3能量低,由O2变O3 为放热反应
B.等质量的O2比O3能量低,由O2变O3 为吸热反应
C.O3比O2稳定,由O2变O3 为吸热反应
D.O2比O3稳定,由O2变O3 为放热反应B2、由金红石?TiO2?制取单质Ti,涉及到的步骤为::TiCl4
已知:① C?s?+O2?g?=CO2?g? ?H=?393?5 kJ·mol?1
② 2CO?g?+O2?g?=2CO2?g? ?H=?566 kJ·mol?1
③ TiO2?s?+2Cl2?g?=TiCl4?s?+O2?g? ?H=+141 kJ·mol?1
则TiO2?s?+2Cl2?g?+2C?s?=TiCl4?s?+2CO?g?的?H= TiO2Ti—80kJ.mol-11.盖斯定律
不管化学反应是分一步完成或分几步完成,其焓变是相同的。化学反应的焓变只与反应体系的始态和终态有关,而与反应的途径无关。 2、盖斯定律的应用关键:目标方程式的“四则运算式”的导出。方法:消元法(简单的反应):消去多余物质
唯一法(复杂的反应):寻找唯一物质小结
