鲁科版 高中化学 选修4 1.2 电能转化为化学能——电解(共20张ppt)
文档属性
| 名称 | 鲁科版 高中化学 选修4 1.2 电能转化为化学能——电解(共20张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-09 18:57:25 | ||
图片预览








文档简介
课件20张PPT。第二节 电能转化为化学能--电解
第三课时
电解原理的应用学习目标:
1.理解铜的电解精炼涉及电解原理,能分析粗铜中各物质的变化
2.掌握电镀的实验设计,实验操作,在电解应用的基础上掌握电解原理知识
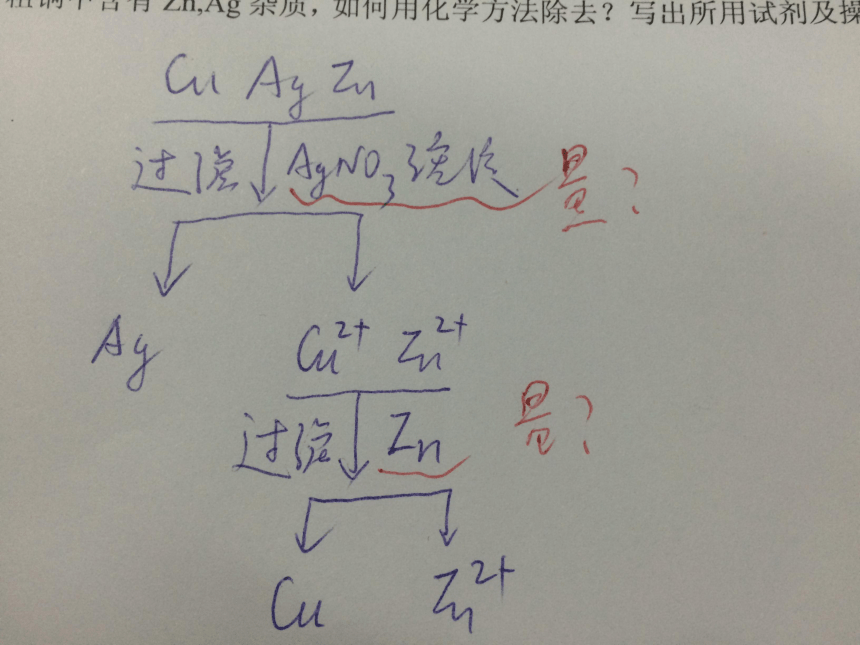
粗铜中含有Zn,Ag杂质,如何用化学方法除去?写出所用试剂及操作。探究活动一:
铜的电解精炼实验目的:利用电解的方法提纯铜
实验仪器:电解池,直流电源,导线
实验试剂:粗铜,精铜,CuSO4溶液请设计实验,画出电解池,分析电极材料及电极反应知识支持:
粗铜中含有锌,铁,镍,银,金和铂等杂质,镍在金属活动性顺序中排在铁和锡之间。铜的电解精炼原理讨论一:
粗铜中杂质金属是如何除去的?
Zn - 2e- == Zn2+
Fe - 2e- == Fe2+
Ni - 2e- == Ni2+-
Cu- 2e- == Cu2+
Zn Fe Ni
CuAg Au
Pt阳极泥阳极:Cu - 2e- == Cu2+
(粗铜)
阴极:Cu2+ + 2e- == Cu
(精铜)讨论二:
电解精炼后,CuSO4溶液的浓度有何变化?
略有下降Zn - 2e- == Zn2+
Fe - 2e- == Fe2+
Ni - 2e- == Ni2+-
Cu- 2e- == Cu2+
Cu2+ + 2e- == Cu
巩固练习:
比较铜的电解精炼和用惰性电极电解CuSO4溶液探究活动二: 电镀探究活动二: 电镀
材料:铁钉,铜片,石墨棒,CuSO4溶液, 导线,电源。
任务:镀铜。
1.请根据电解原理,设计一个给铁钉镀铜的实验方案,确定用什么电极材料,用什么电镀液,镀件做什么极。
2.请实施你的实验方案并进行总结。
阳极:Cu - 2e- == Cu2+
阴极:Cu2+ + 2e- == Cu
(在镀件上析出)讨论一:该实验电镀后,CuSO4溶液的浓度是否有变化?
不变讨论二:电镀池与电解池的区别 电镀池是特殊的电解池,电镀液为含有镀层金属离子的盐溶液,阳极一般为镀层金属。1.下列描述中,不符合生产实际的是 ( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极A练习:2.许多金属都可以通过电解的方法达到精炼的目的。下列有关该方法的叙述中,正确的是 ( )
A.含杂质的粗金属做阳极,与直流电源的正极相连
B.阴极只要是一种导体即可,与精炼过程无关
C.电解质溶液中除了含有精炼的金属的阳离子之外,绝对不能含有其他金属阳离子
D.在精炼过程中,电解质溶液的成分不发生任何变化A
第三课时
电解原理的应用学习目标:
1.理解铜的电解精炼涉及电解原理,能分析粗铜中各物质的变化
2.掌握电镀的实验设计,实验操作,在电解应用的基础上掌握电解原理知识
粗铜中含有Zn,Ag杂质,如何用化学方法除去?写出所用试剂及操作。探究活动一:
铜的电解精炼实验目的:利用电解的方法提纯铜
实验仪器:电解池,直流电源,导线
实验试剂:粗铜,精铜,CuSO4溶液请设计实验,画出电解池,分析电极材料及电极反应知识支持:
粗铜中含有锌,铁,镍,银,金和铂等杂质,镍在金属活动性顺序中排在铁和锡之间。铜的电解精炼原理讨论一:
粗铜中杂质金属是如何除去的?
Zn - 2e- == Zn2+
Fe - 2e- == Fe2+
Ni - 2e- == Ni2+-
Cu- 2e- == Cu2+
Zn Fe Ni
CuAg Au
Pt阳极泥阳极:Cu - 2e- == Cu2+
(粗铜)
阴极:Cu2+ + 2e- == Cu
(精铜)讨论二:
电解精炼后,CuSO4溶液的浓度有何变化?
略有下降Zn - 2e- == Zn2+
Fe - 2e- == Fe2+
Ni - 2e- == Ni2+-
Cu- 2e- == Cu2+
Cu2+ + 2e- == Cu
巩固练习:
比较铜的电解精炼和用惰性电极电解CuSO4溶液探究活动二: 电镀探究活动二: 电镀
材料:铁钉,铜片,石墨棒,CuSO4溶液, 导线,电源。
任务:镀铜。
1.请根据电解原理,设计一个给铁钉镀铜的实验方案,确定用什么电极材料,用什么电镀液,镀件做什么极。
2.请实施你的实验方案并进行总结。
阳极:Cu - 2e- == Cu2+
阴极:Cu2+ + 2e- == Cu
(在镀件上析出)讨论一:该实验电镀后,CuSO4溶液的浓度是否有变化?
不变讨论二:电镀池与电解池的区别 电镀池是特殊的电解池,电镀液为含有镀层金属离子的盐溶液,阳极一般为镀层金属。1.下列描述中,不符合生产实际的是 ( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极A练习:2.许多金属都可以通过电解的方法达到精炼的目的。下列有关该方法的叙述中,正确的是 ( )
A.含杂质的粗金属做阳极,与直流电源的正极相连
B.阴极只要是一种导体即可,与精炼过程无关
C.电解质溶液中除了含有精炼的金属的阳离子之外,绝对不能含有其他金属阳离子
D.在精炼过程中,电解质溶液的成分不发生任何变化A
