沪教版九年级上册化学 3.1.3 原子结构示意图、相对原子质量 课件(22张PPT)
文档属性
| 名称 | 沪教版九年级上册化学 3.1.3 原子结构示意图、相对原子质量 课件(22张PPT) | 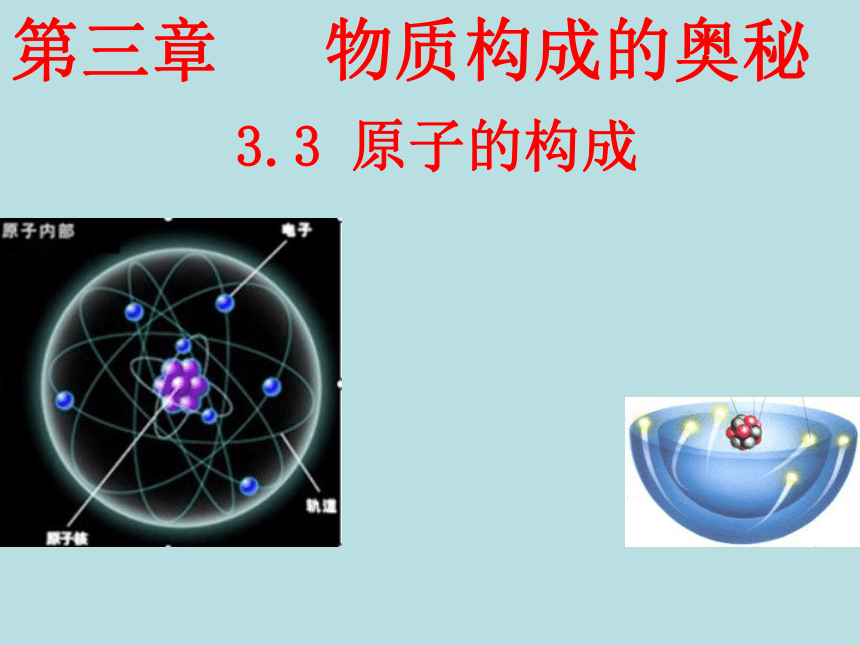 | |
| 格式 | zip | ||
| 文件大小 | 279.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-11 16:20:33 | ||
图片预览



文档简介
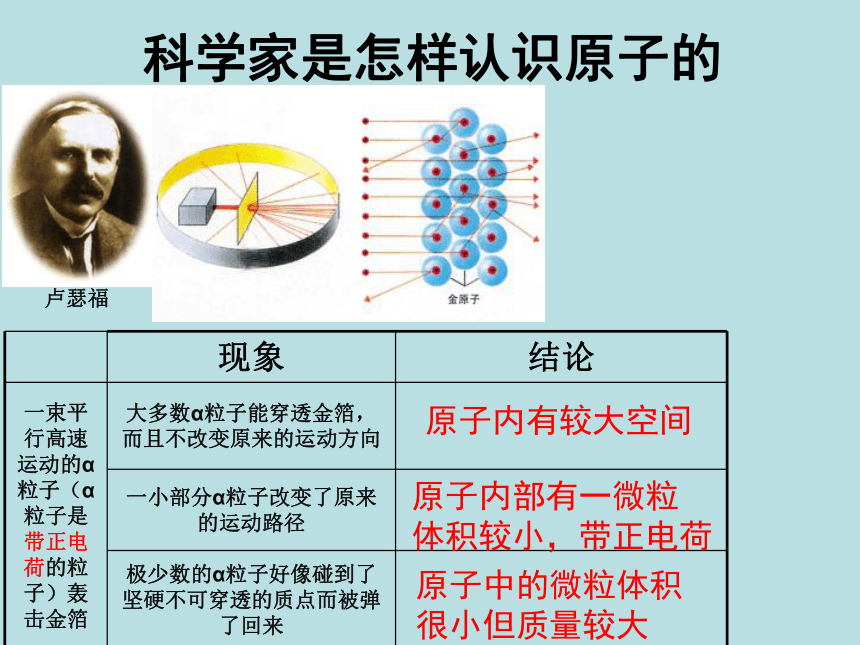
课件22张PPT。3.3 原子的构成第三章 物质构成的奥秘 科学家是怎样认识原子的19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。1897年,英国科学家汤姆生发现了电子。确认了所有原子都含有带负电荷的电子,这表明原子内部结构比较复杂,原子并不是构成物质的最小微粒。科学家是怎样认识原子的科学家是怎样认识原子的卢瑟福原子内有较大空间原子内部有一微粒
体积较小,带正电荷原子中的微粒体积
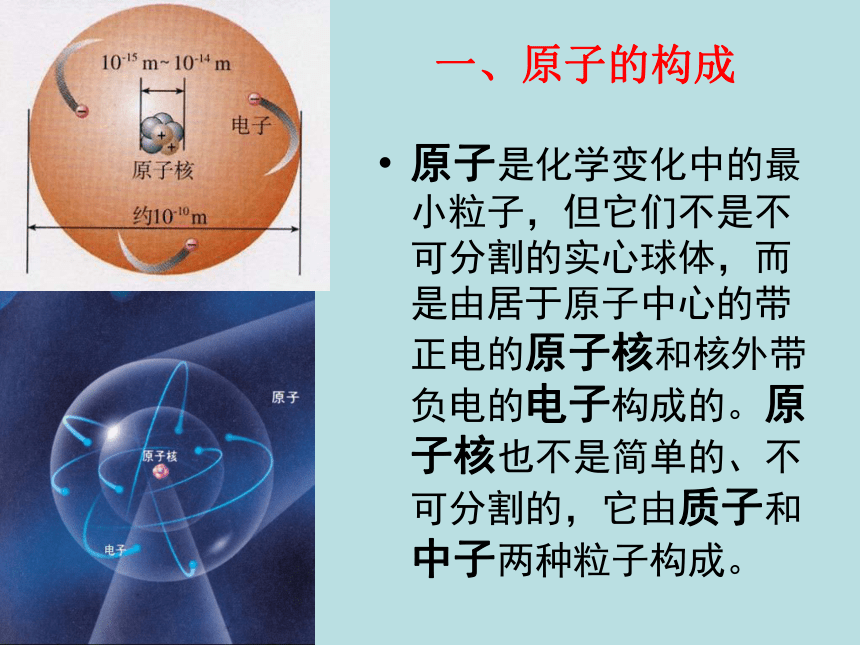
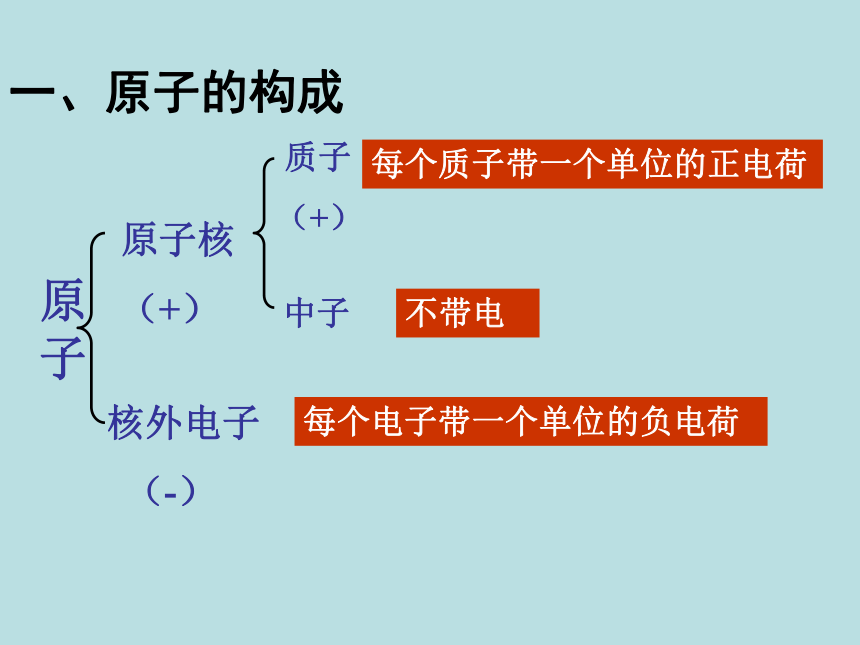
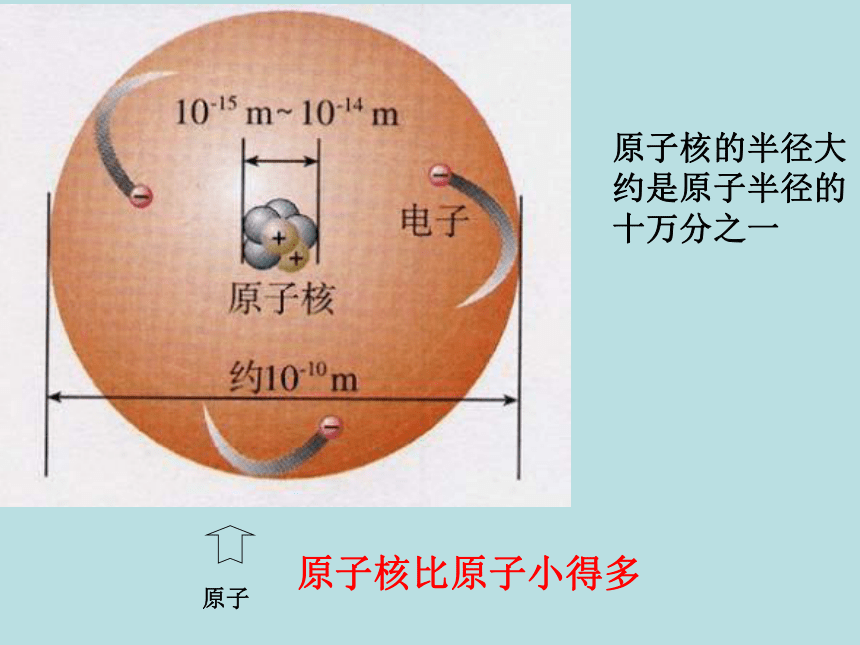
很小但质量较大一、原子的构成原子是化学变化中的最小粒子,但它们不是不可分割的实心球体,而是由居于原子中心的带正电的原子核和核外带负电的电子构成的。原子核也不是简单的、不可分割的,它由质子和中子两种粒子构成。 一、原子的构成原子
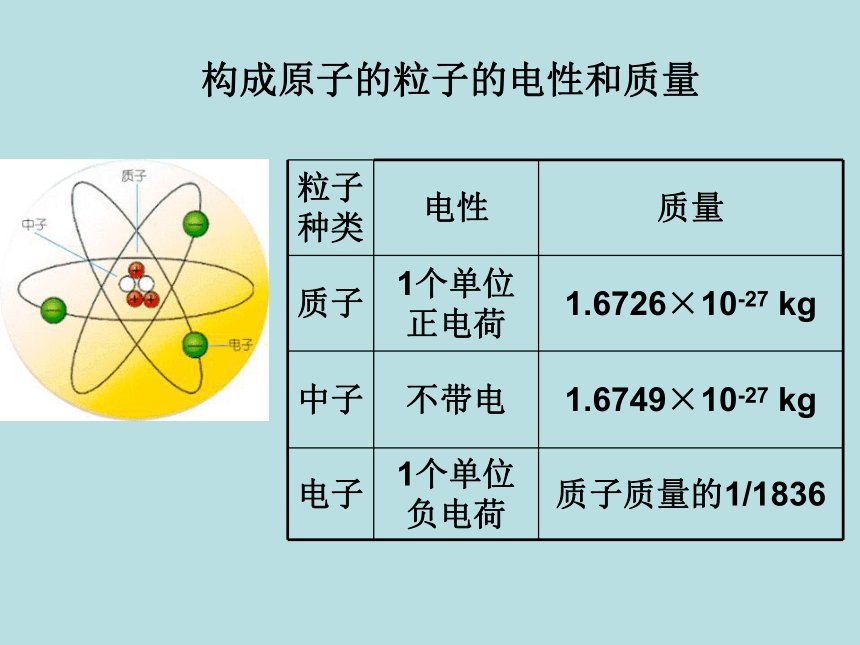
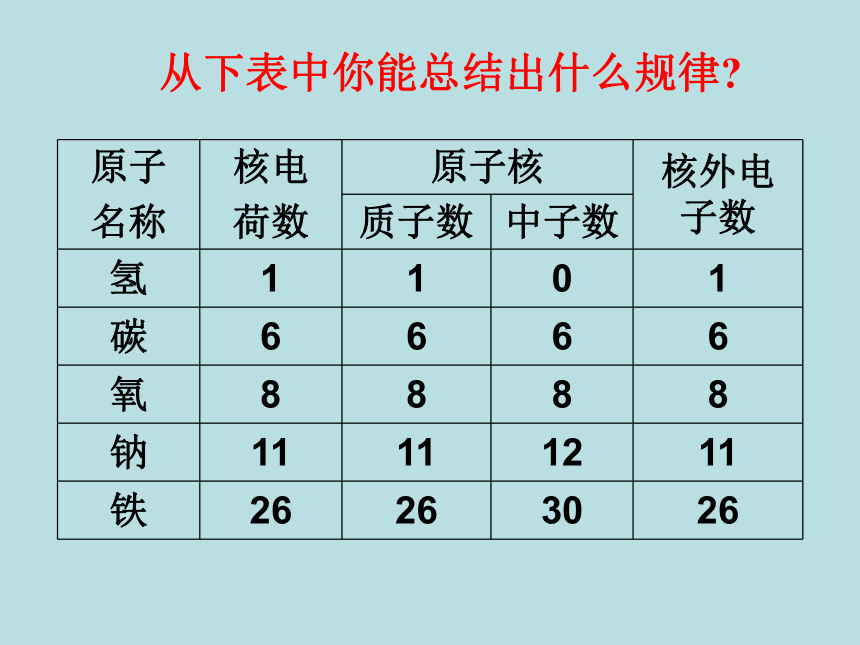
每个质子带一个单位的正电荷不带电每个电子带一个单位的负电荷原子核的半径大约是原子半径的十万分之一原子原子核比原子小得多构成原子的粒子的电性和质量 从下表中你能总结出什么规律?原子构成中的规律:1、质子数 = 核外电子数 = 核电荷数
(原子核所带的电荷数简称为核电荷数)
3、质子数不一定等于中子数;
原子中不一定含有中子
2、整个原子不显电性。
一、原子的构成1.原子由 两部分:(原子核、核外电子)
三种微粒(质子、中子、电子)构成
2.原子中:质子数 = 核电荷数= 核外电子数
3.在原子中,由于原子核(质子)与电子所带电荷数相等且电性相反,因而原子中虽有带电粒子,但整个原子不显电性。说明:由于原子的质量数值太小,书写和使用都不方便,所以采用相对原子质量.几种原子的质量:二、相对原子量二、相对原子量2.657×10-26 kg
1.993×10-26 kg ×1/12练习一:氢原子的质量 = 1.67×10-27 kg
铁原子的质量 = 9.288×10-26 kg
碳原子质量的1/12 = 1.66×10-27kg
求:氢原子和铁原子的相对原子质量。练习二: 尝试查阅一下如下几种元素原子的 相对原子质量:磷、铝、氮、钠、硫、镁 磷——31 铝——27
氮——14 钠——23
硫——32 镁——24 注意:
相对原子质量只是一个比值,单位是“1”
不是原子的实际质量。找规律:相对原子质量的近似值与该原子的质子数,中子数的关系规律:
(近似)相对原子质量=质子数+中子数相对分子质量(Mr):
构成分子的各原子的相对原子质量之和水(H2O)、二氧化碳(CO2)、氧气( O2 )
的相对分子质量。试计算:Mr(H2O)=
Ar(H) +Ar(O)
×2 =1 × 2+16=18学完本课题你知道什么1.原子的构成3.相对原子质量:以一种碳原子质量的1/12作为标准,其它原子的质量跟它相比较所得的比,就是这种原子的相对原子质量。2.原子里:质子数=核电荷数=核外电子数相对原子质量(近似)=质子数+中子数反馈练习BC1 我国计划在2007年发射一颗饶月探测卫星,其任务之一是寻找一种新能源——氢-3,氢-3原子核是由一个中子和两个质子构成的,其原子核外电子数为 ( )
A、1 B、2 C、3 D、6
2 有关原子的相对质量说法正确的是 ( )
A、相对原子质量的单位是g
B、相对原子质量就是原子的质量
C、相对原子质量是以一种碳原子[C-12]的质量的1/12为标准,
其它原子的质量跟它比较所得的值。
D、相对原子质量是质子数加中子数
3.完成下表,可总结出“在原子中质子数等于电子数”。还能总结出(至少写出两条) 1) ;
2)—————————————————————;
3) 。相对原子质量等于质子数加中子数不是所有的原子都含有中子082326质子数不一定等于中子数练习4. 在分子、原子、原子核、质子、中子、电子等微粒中
找出符合下列条件的微粒,填空。
能直接构成物质的是( )
一定能保持物质化学性质的是( )
化学变化中的最小粒子是( )
带正电荷的是( )
带负电荷的是( )
不显电性的是( )
质量与氢原子大约相等的是( )
决定相对原子质量大小的是( )
氢原子不含( )分子、原子中子分子、原子、中子质子、中子原子核电子质子原子分子
体积较小,带正电荷原子中的微粒体积
很小但质量较大一、原子的构成原子是化学变化中的最小粒子,但它们不是不可分割的实心球体,而是由居于原子中心的带正电的原子核和核外带负电的电子构成的。原子核也不是简单的、不可分割的,它由质子和中子两种粒子构成。 一、原子的构成原子
每个质子带一个单位的正电荷不带电每个电子带一个单位的负电荷原子核的半径大约是原子半径的十万分之一原子原子核比原子小得多构成原子的粒子的电性和质量 从下表中你能总结出什么规律?原子构成中的规律:1、质子数 = 核外电子数 = 核电荷数
(原子核所带的电荷数简称为核电荷数)
3、质子数不一定等于中子数;
原子中不一定含有中子
2、整个原子不显电性。
一、原子的构成1.原子由 两部分:(原子核、核外电子)
三种微粒(质子、中子、电子)构成
2.原子中:质子数 = 核电荷数= 核外电子数
3.在原子中,由于原子核(质子)与电子所带电荷数相等且电性相反,因而原子中虽有带电粒子,但整个原子不显电性。说明:由于原子的质量数值太小,书写和使用都不方便,所以采用相对原子质量.几种原子的质量:二、相对原子量二、相对原子量2.657×10-26 kg
1.993×10-26 kg ×1/12练习一:氢原子的质量 = 1.67×10-27 kg
铁原子的质量 = 9.288×10-26 kg
碳原子质量的1/12 = 1.66×10-27kg
求:氢原子和铁原子的相对原子质量。练习二: 尝试查阅一下如下几种元素原子的 相对原子质量:磷、铝、氮、钠、硫、镁 磷——31 铝——27
氮——14 钠——23
硫——32 镁——24 注意:
相对原子质量只是一个比值,单位是“1”
不是原子的实际质量。找规律:相对原子质量的近似值与该原子的质子数,中子数的关系规律:
(近似)相对原子质量=质子数+中子数相对分子质量(Mr):
构成分子的各原子的相对原子质量之和水(H2O)、二氧化碳(CO2)、氧气( O2 )
的相对分子质量。试计算:Mr(H2O)=
Ar(H) +Ar(O)
×2 =1 × 2+16=18学完本课题你知道什么1.原子的构成3.相对原子质量:以一种碳原子质量的1/12作为标准,其它原子的质量跟它相比较所得的比,就是这种原子的相对原子质量。2.原子里:质子数=核电荷数=核外电子数相对原子质量(近似)=质子数+中子数反馈练习BC1 我国计划在2007年发射一颗饶月探测卫星,其任务之一是寻找一种新能源——氢-3,氢-3原子核是由一个中子和两个质子构成的,其原子核外电子数为 ( )
A、1 B、2 C、3 D、6
2 有关原子的相对质量说法正确的是 ( )
A、相对原子质量的单位是g
B、相对原子质量就是原子的质量
C、相对原子质量是以一种碳原子[C-12]的质量的1/12为标准,
其它原子的质量跟它比较所得的值。
D、相对原子质量是质子数加中子数
3.完成下表,可总结出“在原子中质子数等于电子数”。还能总结出(至少写出两条) 1) ;
2)—————————————————————;
3) 。相对原子质量等于质子数加中子数不是所有的原子都含有中子082326质子数不一定等于中子数练习4. 在分子、原子、原子核、质子、中子、电子等微粒中
找出符合下列条件的微粒,填空。
能直接构成物质的是( )
一定能保持物质化学性质的是( )
化学变化中的最小粒子是( )
带正电荷的是( )
带负电荷的是( )
不显电性的是( )
质量与氢原子大约相等的是( )
决定相对原子质量大小的是( )
氢原子不含( )分子、原子中子分子、原子、中子质子、中子原子核电子质子原子分子
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
