鲁科版高中 化学 选修3 第一章 第二节 原子结构与元素周期表(共19张ppt)
文档属性
| 名称 | 鲁科版高中 化学 选修3 第一章 第二节 原子结构与元素周期表(共19张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-10 20:59:44 | ||
图片预览





文档简介
课件19张PPT。 第3课时 核外电子排布与原子半径学习目标
1.了解原子半径的周期性变化
2.能用原子结构的知识解释其周期性变化的原因。
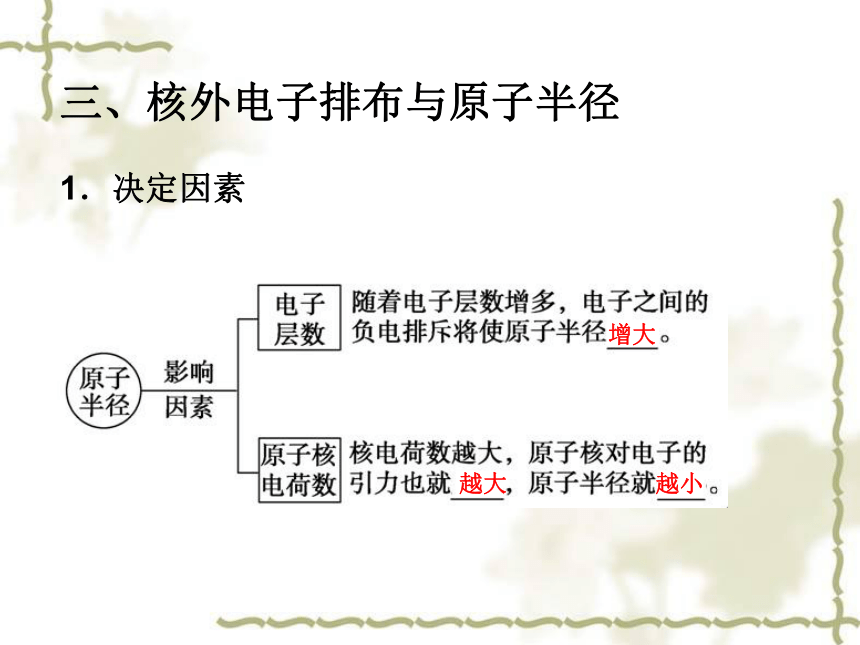
3.能熟练解决有关微粒半径大小比较问题↓↓学与问 元素周期表中的同周期主族元素从左到右,原子半径的变化趋势如何?应如何理解这种趋势?周期表中的同主族元素从上到下,原子半径的变化趋势如何?应如何理解这种趋势?原子半径的周期性变化三、核外电子排布与原子半径
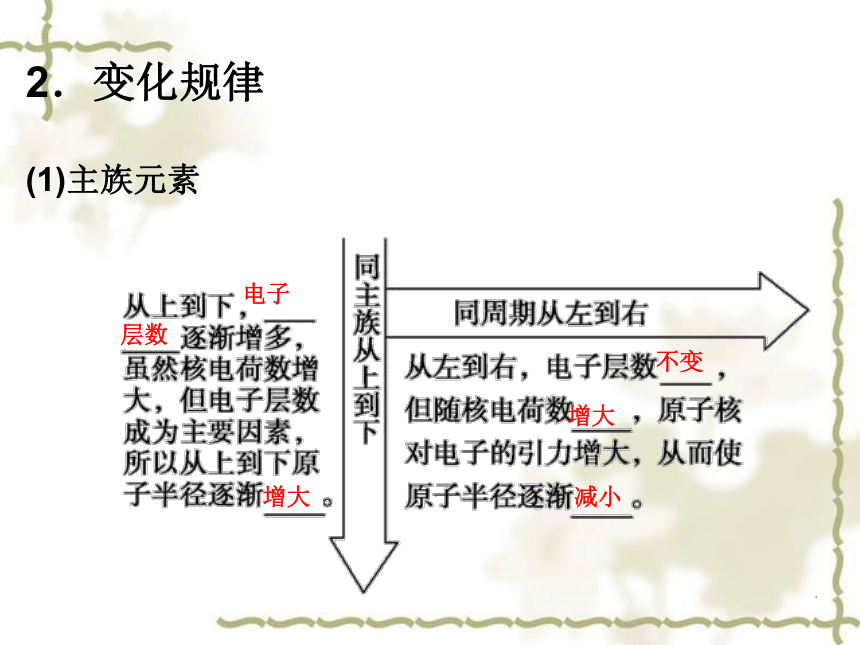
1.决定因素增大越大越小2.变化规律
(1)主族元素电子层数增大不变增大减小(2)过渡元素:同一周期自左至右原子半径逐渐______,但变化幅度______。
增加的电子都分布在 (n-1)d 轨道上,电子间的排斥作用与核对电子的 吸引作用 大致相当。
减小不大微体验1.原子半径就是最外层电子到原子核的实际距离。
2.同周期从左到右原子半径逐渐增大。
3.同主族元素从上到下,原子半径递增的主要因素是其核外电子增多,其排斥作用增大。
4.同周期的过渡元素,从左至右原子半径一定减小。×××√ [特别提醒] 微粒半径大小比较3原则:
一层:先看电子层,一般层数多的半径大;
二核:若电子层数相同,则看核电荷数,核电荷数大的半径小;
三电子:若电子层数、核电荷数均相同,则看核外电子数,电子数多的,半径大。变式训练1 下列微粒半径大小比较正确的是( )
A.Na+B.S2->Cl->Na+>Al3+
C.NaD.CscY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A.质子数c>d
B.离子的还原性Y2-C.氢化物的稳定性H2Y>HZ
D.原子半径X>WD【思路点拨】 解答本题要注意以下两点:
(1)据电子层结构相同推测三种元素在周期表中的位置关系,进而进行原子序数和原子特点的推断。
(2)分析微粒特点,选择合理的方法比较半径大小。
【解析】 因四种离子的电子层结构相同,所以质子数a、b、c、d的大小关系应为a>b>d>c,所以氢化物稳定性应为HZ>H2Y,离子的还原性Y2->Z-,故选D。
【答案】 D 三、核外电子排布与原子半径
1.原子半径
依据量子力学理论,人们假定原子是一个 ,并用统计的方法来测定它的半径。
2.原子半径的周期性变化
(1)同周期:
①规律:自左至右逐渐 。
②原因:增加电子所产生的电子间的 小于核电荷数增加导致的核对外层电子的有效 。 球体减小排斥作用吸引作用知识小结 (2)同主族:
①规律:自上而下逐渐 。
②原因:电子层数依次增加,电子间 的影响大于核对外层电子的 的影响。
(3)过渡元素:
①规律:同一周期自左至右逐渐 ,但变化幅度 。
②原因:增加的电子都分布在 轨道上,电子间的
与核对电子的 大致相当。增大排斥作用吸引作用减小不大(n-1)d排斥作用吸引作用
1.了解原子半径的周期性变化
2.能用原子结构的知识解释其周期性变化的原因。
3.能熟练解决有关微粒半径大小比较问题↓↓学与问 元素周期表中的同周期主族元素从左到右,原子半径的变化趋势如何?应如何理解这种趋势?周期表中的同主族元素从上到下,原子半径的变化趋势如何?应如何理解这种趋势?原子半径的周期性变化三、核外电子排布与原子半径
1.决定因素增大越大越小2.变化规律
(1)主族元素电子层数增大不变增大减小(2)过渡元素:同一周期自左至右原子半径逐渐______,但变化幅度______。
增加的电子都分布在 (n-1)d 轨道上,电子间的排斥作用与核对电子的 吸引作用 大致相当。
减小不大微体验1.原子半径就是最外层电子到原子核的实际距离。
2.同周期从左到右原子半径逐渐增大。
3.同主族元素从上到下,原子半径递增的主要因素是其核外电子增多,其排斥作用增大。
4.同周期的过渡元素,从左至右原子半径一定减小。×××√ [特别提醒] 微粒半径大小比较3原则:
一层:先看电子层,一般层数多的半径大;
二核:若电子层数相同,则看核电荷数,核电荷数大的半径小;
三电子:若电子层数、核电荷数均相同,则看核外电子数,电子数多的,半径大。变式训练1 下列微粒半径大小比较正确的是( )
A.Na+
C.Na
A.质子数c>d
B.离子的还原性Y2-
D.原子半径X>WD【思路点拨】 解答本题要注意以下两点:
(1)据电子层结构相同推测三种元素在周期表中的位置关系,进而进行原子序数和原子特点的推断。
(2)分析微粒特点,选择合理的方法比较半径大小。
【解析】 因四种离子的电子层结构相同,所以质子数a、b、c、d的大小关系应为a>b>d>c,所以氢化物稳定性应为HZ>H2Y,离子的还原性Y2->Z-,故选D。
【答案】 D 三、核外电子排布与原子半径
1.原子半径
依据量子力学理论,人们假定原子是一个 ,并用统计的方法来测定它的半径。
2.原子半径的周期性变化
(1)同周期:
①规律:自左至右逐渐 。
②原因:增加电子所产生的电子间的 小于核电荷数增加导致的核对外层电子的有效 。 球体减小排斥作用吸引作用知识小结 (2)同主族:
①规律:自上而下逐渐 。
②原因:电子层数依次增加,电子间 的影响大于核对外层电子的 的影响。
(3)过渡元素:
①规律:同一周期自左至右逐渐 ,但变化幅度 。
②原因:增加的电子都分布在 轨道上,电子间的
与核对电子的 大致相当。增大排斥作用吸引作用减小不大(n-1)d排斥作用吸引作用
