鲁科版高中 化学 选修1 主题3 课题1 电池探秘(共31张ppt)
文档属性
| 名称 | 鲁科版高中 化学 选修1 主题3 课题1 电池探秘(共31张ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-11 22:07:12 | ||
图片预览







文档简介
(共31张PPT)
主题三 合理利用化学能源
课题1 电池探秘
学习目标
1.了解原电池的组成及工作原理。
2.了解生活中常用化学电源,能根据需要
合理选择电池。
3.了解电池对环境的影响及电池的发展方向。
用途广泛的电池
太阳能电池
手机专用电池
纽扣电池
锌锰干电池
铅蓄电池
燃料电池
一、原电池的组成
仪器和药品:灵敏电流计、铜线、铁线、导线、培养皿、橘子
注意:铜线、铁线较尖锐,使用时小心。
利用所给材料设计橘子电池,观察实验现象并总结出原电池的组成条件。
演示实验:橘子电池
实验1:两个相同电极插入单瓣橘子
实验2:两个不同电极插入单瓣橘子
实验3:两不同电极插入两瓣分开的橘子
两瓣分开的橘子不能产生电流,如何改进才能产生电流?
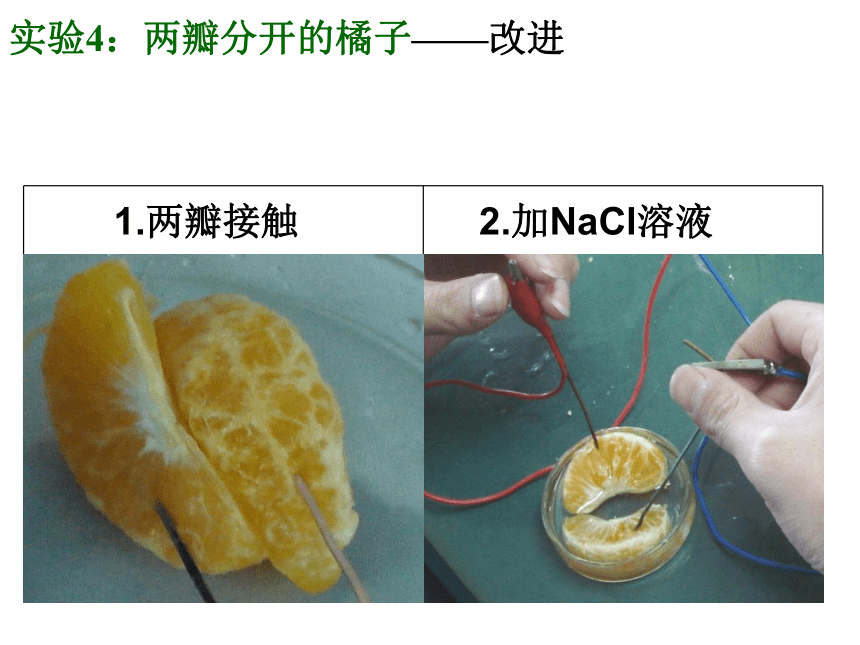
实验4:两瓣分开的橘子——改进
1.两瓣接触
2.加NaCl溶液
小结:
1 有两种活动性不同的电极
分组讨论总结:原电池形成条件
2 电极材料均插入电解质溶
液中,形成闭合回路
3 有一个能自发进行的氧化还原反应
实验1:两相同电极插入单瓣橘子—
实验2:两不同电极插入单瓣橘子—
实验3:两不同电极插入两瓣分开的橘子—
实验4:两瓣分开的橘子改进
1.两瓣接触—
2.加NaCI溶液—
无电流
有电流
无电流
有电流
有电流
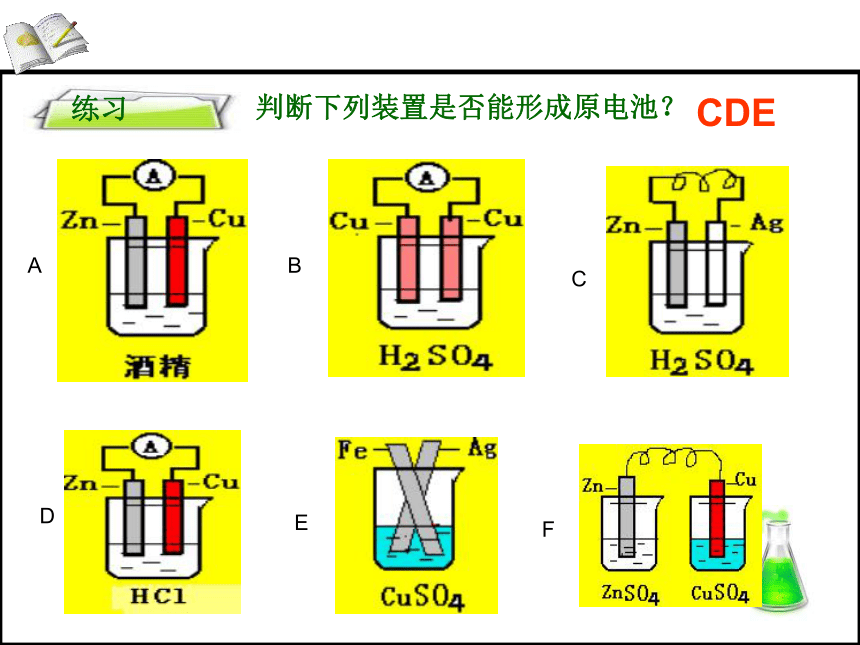
练习
判断下列装置是否能形成原电池?
A
B
C
D
E
F
CDE
提炼模型
稀H2SO4
Zn
Cu
G
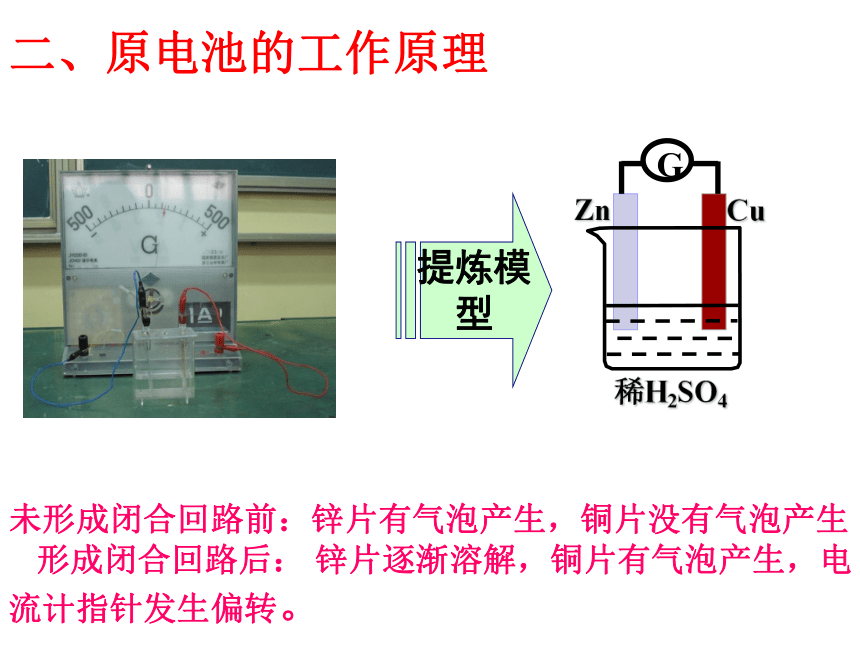
二、原电池的工作原理
未形成闭合回路前:锌片有气泡产生,铜片没有气泡产生
形成闭合回路后: 锌片逐渐溶解,铜片有气泡产生,电 流计指针发生偏转。
稀H2SO4
Zn
Cu
G
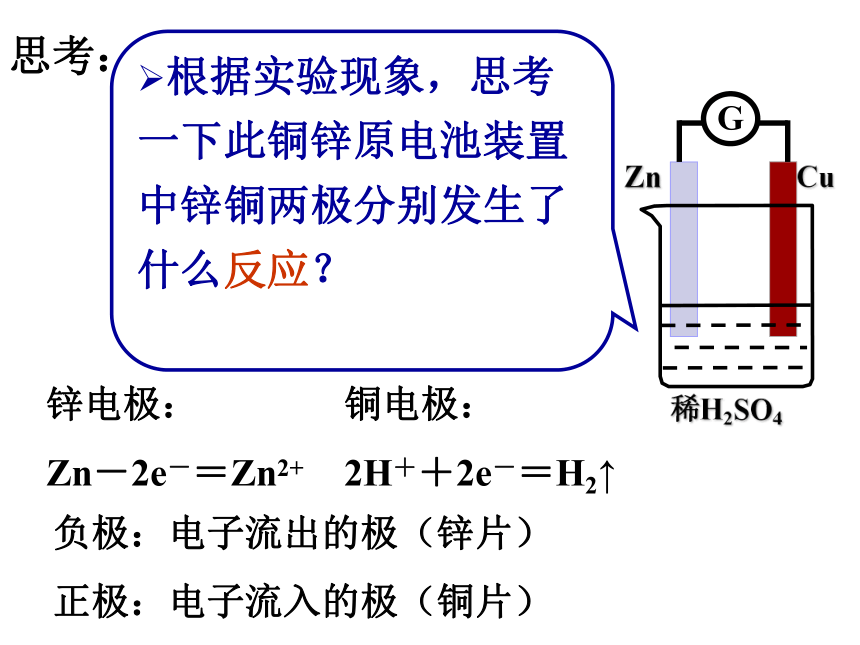
根据实验现象,思考一下此铜锌原电池装置中锌铜两极分别发生了什么反应?
思考:
锌电极:
Zn-2e-=Zn2+
铜电极:
2H++2e-=H2↑
负极:电子流出的极(锌片)
正极:电子流入的极(铜片)
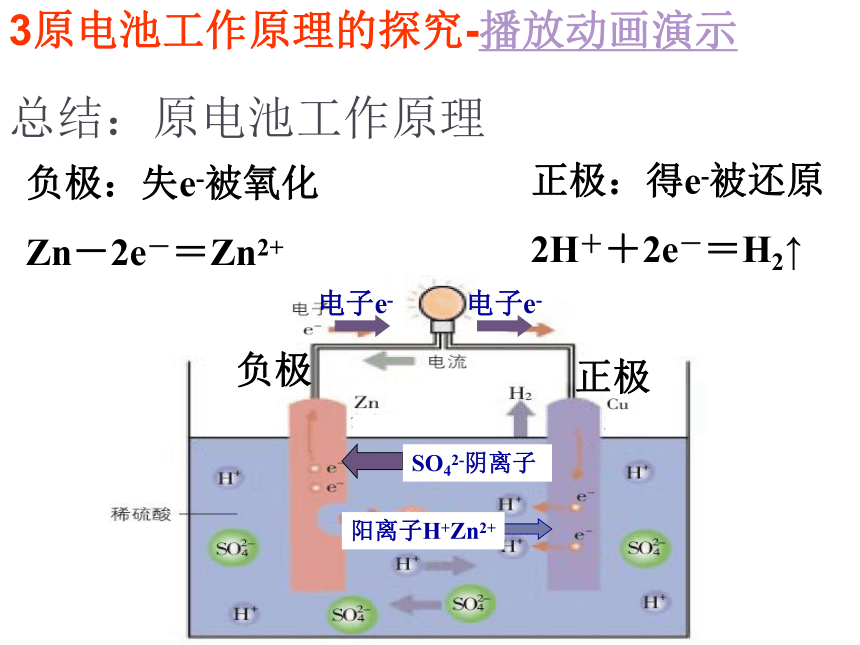
总结:原电池工作原理
正极:得e-被还原
2H++2e-=H2↑
负极:失e-被氧化
Zn-2e-=Zn2+
电子e-
SO42-阴离子
阳离子H+Zn2+
负极
正极
电子e-
3原电池工作原理的探究-播放动画演示
练习
1.某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,则该金属可能为( )
A.铝 B.铜 C.锡 D.硅
2.已知空气-锌电池的电极反应为:
锌片:Zn+20H--2e- =ZnO+H20
石墨:02+2H20+4e- =40H-
根据此判断,锌片是( )
A.负极,并被氧化 B.负极,并被还原
C.正极,并被氧化 D.正极,并被还原
C
A
三、化学电源
小型高性能燃料电池
负极:
正极:
电解质溶液:
1普通锌锰干电池
普通锌-锰干电池的结构
NH4Cl、ZnCl2 和 H2O等
锌筒
石墨棒
MnO2和C
普通锌锰电池
优点:制作简单、价格便宜。
缺点:1放电时间短,电压下降快,不能提供稳定电压。
2随着电池的使用,锌皮不断消耗,电解质溶液会流出腐蚀电器
锌失电子,电子通过外电路、金属帽流向石墨棒,电池内部的MnO2从石墨棒上得电子,电池内部填充的石墨不参与反应,仅起导电作用。
锌筒
石墨棒和金属帽
NH4CI和ZnCI2
糊状混合溶液
原理:
碱性锌锰干电池
电解质:
KOH
缺点:多数只能一次使用,不能充电;价格较贵
优点:比能量和储存时间有所提高, 适用于大电流和连续放电
碱性电池
改进:用KOH代替NH4CI做电解质,把锌以锌屑的形态压在钢壳里,明显改善了电池的工作性能
钮扣电池:不锈钢制成一个由正极壳和负极盖组成的小圆盒,盒内靠正极一端填充由HgO或Ag2O和少量石墨组成的正极活性材料,负极盖一端填充锌汞合金作负极活性材料,电解质溶液为浓KOH溶液
2纽扣电池
优点:体积小,寿命长,电流稳定。
应用:可以为小型、精密电子产品如计算器、手表、助听器提供电能。
H2O + Zn + HgO = Zn(OH)2 + Hg
(1)纽扣电池—锌氧化汞电池
Zn为负极, HgO为正极
电解液: KOH溶液
(2)纽扣电池--锌氧化银电池
Zn为负极, Ag2O为正极
电解液: KOH溶液
Zn+Ag2O+H2O=2Ag+Zn(OH)2
3铅酸蓄电池
铅酸蓄电池用两组铅板作为电极材料,其中,一组铅板的孔穴中填充PbO2做正极,另一组铅板的孔穴中填充海绵状的金属铅做负极,两极浸在H2SO4溶液中。
放电过程总反应:
Pb+PbO2+2H2SO4=2PbSO4+2H2O
铅蓄电池充电的反应则是上述反应的逆过程
缺点:
一个蓄电池需要使用几十千克铅,体积大十分笨重,使用不方便,使用寿命较短且污染环境。
优点:
充放电方便、稳定性强,安全可靠、价格低廉,是汽车、小型电动机车及实验室的常用电源
铅蓄电池的优缺点
4锂电池
锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。
特点:
用途:
高能电池,质量轻,贮存时间长等。
现已成为笔记本电脑、移动电话、摄像机、手表、心脏起搏器等低功耗电器的主流。
电池总反应:Li + MnO2 = LiMnO2
锂电池是新一代高能电池,目前已研究成功多种锂电池,其中一种用廉价的MnO2作正极活性材料,电解质溶液是有机溶剂
其它二次电池
镍镉电池、镍氢电池
资料:对自然环境威胁最大的五种物质即铬、镉、铜、铅、汞。电池包含三种镉,汞,铅
综上所述:这些电池有什么缺陷呢?
电池中含有大量的重金属如锌、铅、镉、汞、锰等。据专家测试,一节纽扣电池能污染60万升水;一节一号电池烂在地里,能使一平方米的土地失去利用价值。若将废旧电池混入生活垃圾一起填埋,渗出的重金属物质就会渗透土壤、污染地下水,进而进入鱼类、农作物等,破坏人类的生存环境,间接威胁到人类的健康,有的还能致癌。所以我们不要乱扔电池,要及时回收。
废旧电池的回收利用
有机汞中毒,患者手足失调,步行困难,运动障碍,听力及言语障碍,肢端麻木,感觉障碍,视野缩小,重者神经错乱,痉挛,最终死亡
痛痛病:镉进入人体导致骨骼中钙流失,造成骨骼软化,萎缩,四肢弯曲,脊柱变形,连咳嗽都会引起骨折。而且患者不能进食,会疼痛无比,因此又称骨痛病
减 少 污 染
节 约 资 源
什么燃料最清洁呢
5、燃料电池—高效、环境友好的化学电池
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。
可供选择的燃料很多,如:氢气、烃类、肼、甲醇、氨、煤气等液态或气态的燃料。
甲醇燃料电池
6太阳能电池
原电池的定义
1、两个活泼性不同的电极
2、电极插入电解质溶液形成闭合回路
3、能自发发生氧化还原反应
原电池的构成条件
原电池的工作原理
将化学能转变为电能的装置
负极:失电子发生氧化应
正极:得电子发生还原,
电子流向:从负极通过外电 路流向正极.
课堂小结
1、银锌电池广泛用作各种电子仪器的电源,其充电和放电过程可以表示为:2Ag+Zn(OH)2 Ag2O+Zn+H2O ,则此电
池放电时,负极上发生反应的物质是( ) (A)Ag (B)Zn (OH)2
(C)Ag2O (D)Zn
D
课堂达标
2. X,Y,Z都是金属,把X浸 Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y为负极。X,Y,Z三种金属的活动性顺序为( )
A.X>Y>Z B.X>Z>Y
C.Y>X>Z D.Y>Z>X
3.对于锌一铜一稀硫酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是( )
①锌片溶解了32.5 g②锌片增重32.5 g③铜片上析出l g H2 ④铜片上析出1 mol H2
A.①和③ B.①和④
C.②和③ D.②和④
C
A
主题三 合理利用化学能源
课题1 电池探秘
学习目标
1.了解原电池的组成及工作原理。
2.了解生活中常用化学电源,能根据需要
合理选择电池。
3.了解电池对环境的影响及电池的发展方向。
用途广泛的电池
太阳能电池
手机专用电池
纽扣电池
锌锰干电池
铅蓄电池
燃料电池
一、原电池的组成
仪器和药品:灵敏电流计、铜线、铁线、导线、培养皿、橘子
注意:铜线、铁线较尖锐,使用时小心。
利用所给材料设计橘子电池,观察实验现象并总结出原电池的组成条件。
演示实验:橘子电池
实验1:两个相同电极插入单瓣橘子
实验2:两个不同电极插入单瓣橘子
实验3:两不同电极插入两瓣分开的橘子
两瓣分开的橘子不能产生电流,如何改进才能产生电流?
实验4:两瓣分开的橘子——改进
1.两瓣接触
2.加NaCl溶液
小结:
1 有两种活动性不同的电极
分组讨论总结:原电池形成条件
2 电极材料均插入电解质溶
液中,形成闭合回路
3 有一个能自发进行的氧化还原反应
实验1:两相同电极插入单瓣橘子—
实验2:两不同电极插入单瓣橘子—
实验3:两不同电极插入两瓣分开的橘子—
实验4:两瓣分开的橘子改进
1.两瓣接触—
2.加NaCI溶液—
无电流
有电流
无电流
有电流
有电流
练习
判断下列装置是否能形成原电池?
A
B
C
D
E
F
CDE
提炼模型
稀H2SO4
Zn
Cu
G
二、原电池的工作原理
未形成闭合回路前:锌片有气泡产生,铜片没有气泡产生
形成闭合回路后: 锌片逐渐溶解,铜片有气泡产生,电 流计指针发生偏转。
稀H2SO4
Zn
Cu
G
根据实验现象,思考一下此铜锌原电池装置中锌铜两极分别发生了什么反应?
思考:
锌电极:
Zn-2e-=Zn2+
铜电极:
2H++2e-=H2↑
负极:电子流出的极(锌片)
正极:电子流入的极(铜片)
总结:原电池工作原理
正极:得e-被还原
2H++2e-=H2↑
负极:失e-被氧化
Zn-2e-=Zn2+
电子e-
SO42-阴离子
阳离子H+Zn2+
负极
正极
电子e-
3原电池工作原理的探究-播放动画演示
练习
1.某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,则该金属可能为( )
A.铝 B.铜 C.锡 D.硅
2.已知空气-锌电池的电极反应为:
锌片:Zn+20H--2e- =ZnO+H20
石墨:02+2H20+4e- =40H-
根据此判断,锌片是( )
A.负极,并被氧化 B.负极,并被还原
C.正极,并被氧化 D.正极,并被还原
C
A
三、化学电源
小型高性能燃料电池
负极:
正极:
电解质溶液:
1普通锌锰干电池
普通锌-锰干电池的结构
NH4Cl、ZnCl2 和 H2O等
锌筒
石墨棒
MnO2和C
普通锌锰电池
优点:制作简单、价格便宜。
缺点:1放电时间短,电压下降快,不能提供稳定电压。
2随着电池的使用,锌皮不断消耗,电解质溶液会流出腐蚀电器
锌失电子,电子通过外电路、金属帽流向石墨棒,电池内部的MnO2从石墨棒上得电子,电池内部填充的石墨不参与反应,仅起导电作用。
锌筒
石墨棒和金属帽
NH4CI和ZnCI2
糊状混合溶液
原理:
碱性锌锰干电池
电解质:
KOH
缺点:多数只能一次使用,不能充电;价格较贵
优点:比能量和储存时间有所提高, 适用于大电流和连续放电
碱性电池
改进:用KOH代替NH4CI做电解质,把锌以锌屑的形态压在钢壳里,明显改善了电池的工作性能
钮扣电池:不锈钢制成一个由正极壳和负极盖组成的小圆盒,盒内靠正极一端填充由HgO或Ag2O和少量石墨组成的正极活性材料,负极盖一端填充锌汞合金作负极活性材料,电解质溶液为浓KOH溶液
2纽扣电池
优点:体积小,寿命长,电流稳定。
应用:可以为小型、精密电子产品如计算器、手表、助听器提供电能。
H2O + Zn + HgO = Zn(OH)2 + Hg
(1)纽扣电池—锌氧化汞电池
Zn为负极, HgO为正极
电解液: KOH溶液
(2)纽扣电池--锌氧化银电池
Zn为负极, Ag2O为正极
电解液: KOH溶液
Zn+Ag2O+H2O=2Ag+Zn(OH)2
3铅酸蓄电池
铅酸蓄电池用两组铅板作为电极材料,其中,一组铅板的孔穴中填充PbO2做正极,另一组铅板的孔穴中填充海绵状的金属铅做负极,两极浸在H2SO4溶液中。
放电过程总反应:
Pb+PbO2+2H2SO4=2PbSO4+2H2O
铅蓄电池充电的反应则是上述反应的逆过程
缺点:
一个蓄电池需要使用几十千克铅,体积大十分笨重,使用不方便,使用寿命较短且污染环境。
优点:
充放电方便、稳定性强,安全可靠、价格低廉,是汽车、小型电动机车及实验室的常用电源
铅蓄电池的优缺点
4锂电池
锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。
特点:
用途:
高能电池,质量轻,贮存时间长等。
现已成为笔记本电脑、移动电话、摄像机、手表、心脏起搏器等低功耗电器的主流。
电池总反应:Li + MnO2 = LiMnO2
锂电池是新一代高能电池,目前已研究成功多种锂电池,其中一种用廉价的MnO2作正极活性材料,电解质溶液是有机溶剂
其它二次电池
镍镉电池、镍氢电池
资料:对自然环境威胁最大的五种物质即铬、镉、铜、铅、汞。电池包含三种镉,汞,铅
综上所述:这些电池有什么缺陷呢?
电池中含有大量的重金属如锌、铅、镉、汞、锰等。据专家测试,一节纽扣电池能污染60万升水;一节一号电池烂在地里,能使一平方米的土地失去利用价值。若将废旧电池混入生活垃圾一起填埋,渗出的重金属物质就会渗透土壤、污染地下水,进而进入鱼类、农作物等,破坏人类的生存环境,间接威胁到人类的健康,有的还能致癌。所以我们不要乱扔电池,要及时回收。
废旧电池的回收利用
有机汞中毒,患者手足失调,步行困难,运动障碍,听力及言语障碍,肢端麻木,感觉障碍,视野缩小,重者神经错乱,痉挛,最终死亡
痛痛病:镉进入人体导致骨骼中钙流失,造成骨骼软化,萎缩,四肢弯曲,脊柱变形,连咳嗽都会引起骨折。而且患者不能进食,会疼痛无比,因此又称骨痛病
减 少 污 染
节 约 资 源
什么燃料最清洁呢
5、燃料电池—高效、环境友好的化学电池
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。
可供选择的燃料很多,如:氢气、烃类、肼、甲醇、氨、煤气等液态或气态的燃料。
甲醇燃料电池
6太阳能电池
原电池的定义
1、两个活泼性不同的电极
2、电极插入电解质溶液形成闭合回路
3、能自发发生氧化还原反应
原电池的构成条件
原电池的工作原理
将化学能转变为电能的装置
负极:失电子发生氧化应
正极:得电子发生还原,
电子流向:从负极通过外电 路流向正极.
课堂小结
1、银锌电池广泛用作各种电子仪器的电源,其充电和放电过程可以表示为:2Ag+Zn(OH)2 Ag2O+Zn+H2O ,则此电
池放电时,负极上发生反应的物质是( ) (A)Ag (B)Zn (OH)2
(C)Ag2O (D)Zn
D
课堂达标
2. X,Y,Z都是金属,把X浸 Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y为负极。X,Y,Z三种金属的活动性顺序为( )
A.X>Y>Z B.X>Z>Y
C.Y>X>Z D.Y>Z>X
3.对于锌一铜一稀硫酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是( )
①锌片溶解了32.5 g②锌片增重32.5 g③铜片上析出l g H2 ④铜片上析出1 mol H2
A.①和③ B.①和④
C.②和③ D.②和④
C
A
