人教版 化学 选修4 电化学及其应用(共17张ppt)
文档属性
| 名称 | 人教版 化学 选修4 电化学及其应用(共17张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 6.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-12 07:35:06 | ||
图片预览




文档简介
课件17张PPT。1、从氧化还原的角度理解化学能
与电能之间的相互转化;
2、用对比的方法,加深理解原电
池和电解池的工作原理;
3、掌握电极反应式的书写方法;
4、能顺利应用电化学知识来综合
解题。近几年高考呈现的形式选择题角度:
1.判断电子、离子移动的方向、电极反应式书写的正误 。
2.电池原理在金属腐蚀与防护方面应用。
非选择题角度:
1.电极反应式、电池反应方程式的书写。
2.电子转移、两极产物、pH等的计算。
3.原电池、电解池原理在工业生产中应用。以新型化学电源为载体!自发的氧化还原反应将化学能转化为电能的装置。在通电条件下,可以使非自发的氧化还原反应得以进行,把电能转化为化学能的装置。主题一:原电池、电解池的判断自发进行氧化还原反应可以设计— ________________;
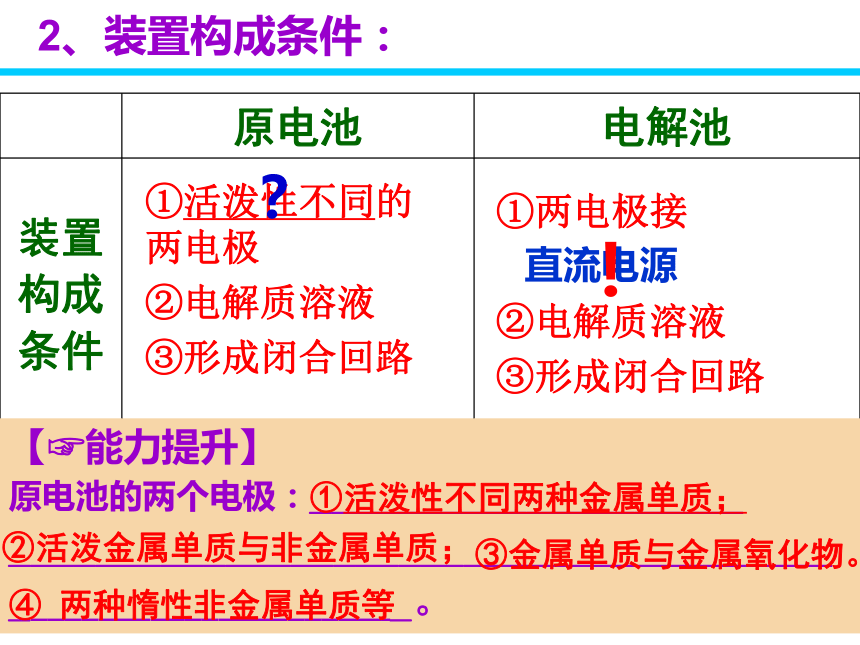
不能自发氧化还原反应只能设计成—_________。1、反应原理电解池原电池或电解池①活泼性不同的 两电极
②电解质溶液
③形成闭合回路①两电极接
②电解质溶液
③形成闭合回路直流电源【?能力提升】
原电池的两个电极:____________________
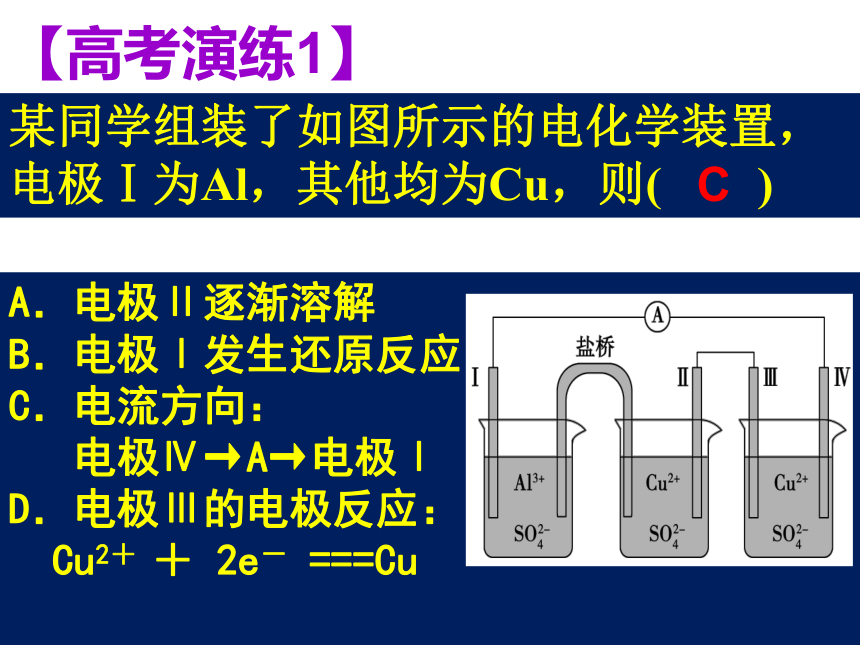
_____________________________________________________________。 ?①活泼性不同两种金属单质;②活泼金属单质与非金属单质;③金属单质与金属氧化物。④ 两种惰性非金属单质等2、装置构成条件:!A.电极Ⅱ逐渐溶解
B.电极Ⅰ发生还原反应
C.电流方向:
电极Ⅳ→A→电极Ⅰ
D.电极Ⅲ的电极反应:
Cu2+ + 2e- ===Cu
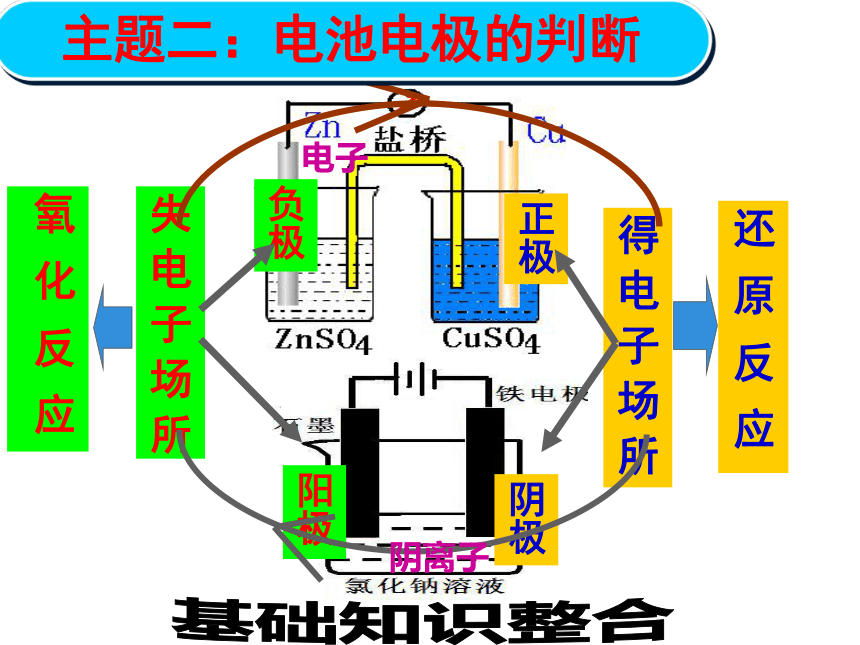
某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他均为Cu,则( )【高考演练1】C 失 电 子 场 所得 电 子 场 所主题二:电池电极的判断基础知识整合已知:锂离子电池的总反应为:LixC+Li(1-x)CoO2 C+LiCoO2,锂硫电池的总反应为2Li+S Li2S有关上述两种电池说法正确的是( )
A.锂离子电池放电时,Li+向负极迁移
B.锂硫电池充电时,锂电极
发生还原反应
C.理论上两种电池的比
能量相同
D.右图表示用锂离子电
池给锂硫电池充电
B【高考演练2】(1) CH3OH—O2— KOH溶液
(2) C2H5OH—O2— H2SO4溶液
(3) Al—Mg—NaOH溶液
(4) Cu—Fe—浓HNO3溶液
(5)设计完成Cu+2Fe3+===Cu2++2Fe2+该反应,并画出装置图。
(6) 把氯碱工业的惰性电极换成Fe做电极。
主题三:电池电极反应式的书写【高考演练3】请按下列要求完成下列各题,并写出相应的电极反应和电解质溶液中的全反应方程式:
(2) C2H5OH—O2— H2SO4溶液(1) CH3OH—O2— KOH溶液负极:___________________________________;
正极:___________________________________;
全反应:_________________________________.2CH3OH + 16OH- -12e- = 2CO32- + 12H2O
3O2 + 6H2O + 12e- = 12OH-
2CH3OH + 4OH- +3O2 = 2CO32- + 6H2O
负极:______________________________;
正极:______________________________;
全反应:___________________________.C2H5OH+3H2O-12e- =2CO2+12H+
O2+4H++4e-=2H2O
C2H5OH+3O2=2CO2+3H2O(3) Al—Mg—NaOH溶液组成的原电池 负极:______________________________;
正极:______________________________;
全反应:___________________________.(4) Cu—Fe—浓HNO3溶液
负极:______________________________;
正极:______________________________;
全反应:___________________________.Al + 4OH- -3e- =[Al(OH)4]- 2H+ + 2e- = H2 ↑
2Al+2OH-+ 6H2O=2[Al(OH)4]- +3H2 ↑
Cu-2e- = Cu2+
NO3- +e- +2H+ = NO2 ↑ +H2O
Cu+2NO3-+4H+ = Cu2++2NO2 ↑ +2H2O(5)设计完成Cu+2Fe3+===Cu2++2Fe2+该反应,并画出装置图。阳极:____________________;
阴极:____________________;
全反应:____________________.通电(6) 把氯碱工业的惰性电极换成Fe做电极。阳极:____________________;
阴极:____________________;
全反应:_____________________________.还可能发生的化学反应方程式为:
______________________________
_______________________________.4Fe(OH)2+ O2+ 2H2O=== 4 Fe(OH)3
2Fe(OH)3===Fe2O3·nH2O+(3-n)H2OCu-2e- =Cu2+
Fe3+ +e- =Fe2+
Cu+2Fe3+===Cu2++2Fe2+
电池电极反应式的书写方法:1、先定池再定极;
2、再写电极反应式;
3、还要介质与放电生成的离子能否大量;
4、若是水电离出来的H+或OH-在电极
放电,则此电极反应式可以写H+或
OH-放电,也可以写成H2O放电。
5、也可以根据题目所给的总方程式,
与其中 一电极式相减即得另一电极
反应式。
离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl7- 和AlCl4- 组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品应接电源的____极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 _____________________________。若改用AlCl3溶液作电解液, 阴极上的产物为___.负4 Al2Cl7- +3e- ==Al+7AlCl4-H2【高考演练4】【高考演练5】某原电池装置如图所示,电池总反应为2Ag+Cl2 ==2AgCl。下列说法正确的是( )A.正极反应为AgCl+e-
== Ag+Cl- 。
B.放电时,交换膜右侧溶液
中有大量白色沉淀生成。
C.若用NaCl溶液代替盐酸,则D 电池总反应随之改变。
D.当电路中转移0.01 mol e- 时,交换膜左侧溶液中约减少0.02 mol离子。
电化学问题解题思路:
2.抓好四池
1.抓好核心问题,理顺解题思路。3.抓好四极。化学反应氧化还原反应非氧化还原自发反应非自发反应学科思想 特点产生电能电解、电镀、粗铜的提成等广泛应用 分 类 应用造福社会化学是最具有应用价值的学科
与电能之间的相互转化;
2、用对比的方法,加深理解原电
池和电解池的工作原理;
3、掌握电极反应式的书写方法;
4、能顺利应用电化学知识来综合
解题。近几年高考呈现的形式选择题角度:
1.判断电子、离子移动的方向、电极反应式书写的正误 。
2.电池原理在金属腐蚀与防护方面应用。
非选择题角度:
1.电极反应式、电池反应方程式的书写。
2.电子转移、两极产物、pH等的计算。
3.原电池、电解池原理在工业生产中应用。以新型化学电源为载体!自发的氧化还原反应将化学能转化为电能的装置。在通电条件下,可以使非自发的氧化还原反应得以进行,把电能转化为化学能的装置。主题一:原电池、电解池的判断自发进行氧化还原反应可以设计— ________________;
不能自发氧化还原反应只能设计成—_________。1、反应原理电解池原电池或电解池①活泼性不同的 两电极
②电解质溶液
③形成闭合回路①两电极接
②电解质溶液
③形成闭合回路直流电源【?能力提升】
原电池的两个电极:____________________
_____________________________________________________________。 ?①活泼性不同两种金属单质;②活泼金属单质与非金属单质;③金属单质与金属氧化物。④ 两种惰性非金属单质等2、装置构成条件:!A.电极Ⅱ逐渐溶解
B.电极Ⅰ发生还原反应
C.电流方向:
电极Ⅳ→A→电极Ⅰ
D.电极Ⅲ的电极反应:
Cu2+ + 2e- ===Cu
某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他均为Cu,则( )【高考演练1】C 失 电 子 场 所得 电 子 场 所主题二:电池电极的判断基础知识整合已知:锂离子电池的总反应为:LixC+Li(1-x)CoO2 C+LiCoO2,锂硫电池的总反应为2Li+S Li2S有关上述两种电池说法正确的是( )
A.锂离子电池放电时,Li+向负极迁移
B.锂硫电池充电时,锂电极
发生还原反应
C.理论上两种电池的比
能量相同
D.右图表示用锂离子电
池给锂硫电池充电
B【高考演练2】(1) CH3OH—O2— KOH溶液
(2) C2H5OH—O2— H2SO4溶液
(3) Al—Mg—NaOH溶液
(4) Cu—Fe—浓HNO3溶液
(5)设计完成Cu+2Fe3+===Cu2++2Fe2+该反应,并画出装置图。
(6) 把氯碱工业的惰性电极换成Fe做电极。
主题三:电池电极反应式的书写【高考演练3】请按下列要求完成下列各题,并写出相应的电极反应和电解质溶液中的全反应方程式:
(2) C2H5OH—O2— H2SO4溶液(1) CH3OH—O2— KOH溶液负极:___________________________________;
正极:___________________________________;
全反应:_________________________________.2CH3OH + 16OH- -12e- = 2CO32- + 12H2O
3O2 + 6H2O + 12e- = 12OH-
2CH3OH + 4OH- +3O2 = 2CO32- + 6H2O
负极:______________________________;
正极:______________________________;
全反应:___________________________.C2H5OH+3H2O-12e- =2CO2+12H+
O2+4H++4e-=2H2O
C2H5OH+3O2=2CO2+3H2O(3) Al—Mg—NaOH溶液组成的原电池 负极:______________________________;
正极:______________________________;
全反应:___________________________.(4) Cu—Fe—浓HNO3溶液
负极:______________________________;
正极:______________________________;
全反应:___________________________.Al + 4OH- -3e- =[Al(OH)4]- 2H+ + 2e- = H2 ↑
2Al+2OH-+ 6H2O=2[Al(OH)4]- +3H2 ↑
Cu-2e- = Cu2+
NO3- +e- +2H+ = NO2 ↑ +H2O
Cu+2NO3-+4H+ = Cu2++2NO2 ↑ +2H2O(5)设计完成Cu+2Fe3+===Cu2++2Fe2+该反应,并画出装置图。阳极:____________________;
阴极:____________________;
全反应:____________________.通电(6) 把氯碱工业的惰性电极换成Fe做电极。阳极:____________________;
阴极:____________________;
全反应:_____________________________.还可能发生的化学反应方程式为:
______________________________
_______________________________.4Fe(OH)2+ O2+ 2H2O=== 4 Fe(OH)3
2Fe(OH)3===Fe2O3·nH2O+(3-n)H2OCu-2e- =Cu2+
Fe3+ +e- =Fe2+
Cu+2Fe3+===Cu2++2Fe2+
电池电极反应式的书写方法:1、先定池再定极;
2、再写电极反应式;
3、还要介质与放电生成的离子能否大量;
4、若是水电离出来的H+或OH-在电极
放电,则此电极反应式可以写H+或
OH-放电,也可以写成H2O放电。
5、也可以根据题目所给的总方程式,
与其中 一电极式相减即得另一电极
反应式。
离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl7- 和AlCl4- 组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品应接电源的____极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 _____________________________。若改用AlCl3溶液作电解液, 阴极上的产物为___.负4 Al2Cl7- +3e- ==Al+7AlCl4-H2【高考演练4】【高考演练5】某原电池装置如图所示,电池总反应为2Ag+Cl2 ==2AgCl。下列说法正确的是( )A.正极反应为AgCl+e-
== Ag+Cl- 。
B.放电时,交换膜右侧溶液
中有大量白色沉淀生成。
C.若用NaCl溶液代替盐酸,则D 电池总反应随之改变。
D.当电路中转移0.01 mol e- 时,交换膜左侧溶液中约减少0.02 mol离子。
电化学问题解题思路:
2.抓好四池
1.抓好核心问题,理顺解题思路。3.抓好四极。化学反应氧化还原反应非氧化还原自发反应非自发反应学科思想 特点产生电能电解、电镀、粗铜的提成等广泛应用 分 类 应用造福社会化学是最具有应用价值的学科
