沪教版九年级上册化学 第5章 金属的冶炼与利用 作业 课件(22张ppt)
文档属性
| 名称 | 沪教版九年级上册化学 第5章 金属的冶炼与利用 作业 课件(22张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 278.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-13 08:12:37 | ||
图片预览








文档简介
课件22张PPT。 —金属与金属矿物身边的化学物质
1. 知道金属的物理特征,能识别常见的金属和非金属 ;
了解合金的特性及应用,认识金属材料在生产、生活和 社会发展中的重要作用.
2.认识常见金属的化学性质,了解常见金属与氧气、酸(盐酸、稀硫酸)的反应和与某些盐(硫酸铜溶液,硝酸银溶液)的反应
3.知道一些常见金属(铁、铝等)矿物,了解从铁矿石中将铁 还原出来的原理
4.能进行钢铁锈蚀条件的探究实验,了解防止金属腐蚀的简单方法
5.认识废弃金属对环境的污染,知道回收金属的重要性
6.能进行金属的物理性质和某些化学性质的探究实验考纲要求 细心解读考点1 金属材料、 金属的物理性质
1、金属的物理性质
(1)在常温下除汞 以外,金属单质都是_____,都具有金属光泽,具有良好的______和______,因此可以制成导线和炊具;同时具有_____可以拉成丝,展成片 。
(2)物质的性质在很大程度上决定物质的用途 ,但这不是唯一的决定因素,还要考虑到______________________________,以废料是否易于回收和对环境的影响等多种因素。
知识梳理 针对练习 固体导电性导热性延展性价格、资源、是否美观、使用是否便利
2、合金
(1)概念:
合金是指___________融合某些金属或非金属而成的具有金属特性的物质
(合金属于混合物;合金中至少含有一种金属;制合金的 过程属于物理变化)
(2)特性:
合金与组成它的金属相比_____低、_____大,具有更优良的机械性能
(3)铁合金:_____和____在金属中加热熔点硬度生铁钢考点2 金属的化学性质1.与氧气反应:
4Al+3O2=2Al2O3 3Fe+2O2 = Fe3O4 2Cu+O2=2CuO
2.与酸反应:
规律:金属+酸 = 盐+氢气
Fe+2HCl = FeCl2+H2↑
Zn+H2SO4= ZnSO4+H2↑
该反应发生的条件:①金属必须是排在金属活动性顺序氢之前
②酸指盐酸和稀硫酸不能是浓硫酸和硝酸
点燃 3.与盐反应
规律: 金属+盐 =新盐+新金属
Cu+ 2AgNO3 = Cu(NO3)2+2Ag
Fe+CuSO4 = FeSO4+Cu
该反应发生的条件:
①金属的活动性排在盐中金属的活动性之前
②盐必为可溶性盐
注意:①并不是所有的排在前面的金属都能把排在后面的 金属从其盐溶液中置换出来,如K 、Ca 、 Na
②该类反应现象的叙述
置换反应:单质+化合物=单质+化合物
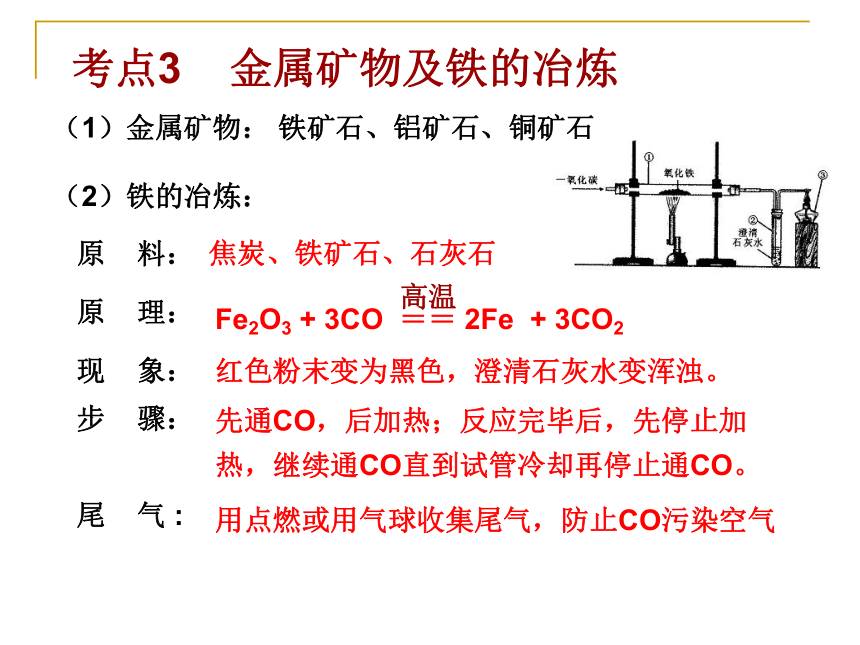
考点3 金属矿物及铁的冶炼(1)金属矿物: 铁矿石、铝矿石、铜矿石
(2)铁的冶炼:
原 料:
原 理:
现 象:
步 骤:
尾 气 :
红色粉末变为黑色,澄清石灰水变浑浊。先通CO,后加热;反应完毕后,先停止加热,继续通CO直到试管冷却再停止通CO。焦炭、铁矿石、石灰石 用点燃或用气球收集尾气,防止CO污染空气考点4 铁的防锈、金属资源的保护 (1)生锈的条件:(2)防锈的方法:(3)金属资源的保护措施:与水和氧气同时接触。 例1. (10河南)请回答下列有关金属的问题。
铝是活泼金属,为什么通常铝锅却很耐腐蚀?
答案:铝与氧气反应,其表面生成致密的氧化铝薄膜起保护作用。
例2.下列物质能由金属和酸反应直接制取的是( )
A. AgCl B . FeCl3 C. CuCl2 D . AlCl3
例3.(12滨州)工人师傅切割铁板时,常用硫酸铜溶液在铁板上画线即可留下红色印迹,此过程发生反应的方程式是__________________
DFe+CuSO4=Cu+FeSO4 例4.钢铁是人类生活和生产中非常重要的材料,但全世界每年都有约四分之一的钢铁因生锈损失。某化学课外活动小组,对钢铁制品锈蚀的条件进行如下探究,设计了如图所示的实验,据此回答下列有关问题: (1)一周后,观察到编号为______的试管中的铁钉锈蚀严重。B (2)常温下,铁生锈的条件是铁跟______和______ 等物质相互作用的结果,铁锈的主要成分是__________(用化学式表示)。
(3)欲除去铁锈,同学们提出了三种不同的实验方
法:①用砂布擦;②用稀盐酸洗;③用稀碱液泡。你认为最有效的方法是____________(填序号)。
(4)如何防止家庭中常用的铁制品生锈,简单易行的方法有(列举一种方法)_____________________。
氧气水Fe2O3②刷漆、涂油有关金属活动性顺序的应用: 1.判断金属的活动性强弱;
2.判断金属能否与酸反应;
3.判断金属能否与盐反应。
重点突破 能力提升 题型一 、判断金属的活动性顺序方法:
1.能否与酸溶液反应。若能则排在氢之前,若不能则排在氢之后
2. 能否发生“前置后”的反应。若A能把B从它的盐溶液中置换出来,则A比B活泼。例1(10河南)X、Y、Z是三种金属固体,将X和Y浸入稀硫酸中,Y溶解并产生氢气,X无变化;将X和Z浸入硝酸银溶液中,X表面有银析出而Z无变化
①判断X、Y、Z和银四种金属的活动性由强到弱的顺序。
答案:Y、x、Ag、z
②具体确定一种X后,写出X与硝酸银溶液反应的化学方程式.
Cu+2AgN03=Cu(N03)2+2Ag
题型二、验证金属的活动性顺序例2(06河南)请设计两个实验证明Zn、 Cu 、 Ag三种金属的活动性顺序。(写出所需试剂即可)
方法:
先将金属按其活动性顺序排序: Zn、 Cu 、 Ag 。
试剂一:“ 盐、金、盐”(两边盐中间金属)
如: Zn(NO3)2溶液、Cu、AgNO3溶液。
试剂二: “金、盐、金”(两边金属中间盐)
如:Zn、 CuSO4溶液、Ag。
试剂三:用酸验证氢前和氢后金属,再选另一种金属的盐溶 液。如:Zn、Cu、稀盐酸、 AgNO3 溶液。
例3(11河南)在Cu(NO3) 2﹑Al(NO3)3和AgNO3的混合溶液中加入一定量的铁粉,充分反应后过滤。向滤出的固体上滴加稀硫酸时有气泡产生。则反应后所得溶液中含有的金属离子有_____;反应后溶液的质量比原来混合溶液的质量_____(填“大”或“小”);有关的化学反应方程式为_______________(写出一个即可)。 题型三、滤液、滤渣问题方法:
1.先判断溶液中哪些反应可以发生,写出化学反应方程式
Fe+2AgNO3=Fe(NO3)2+2Ag
Fe+ Cu(NO3)2=Fe(NO3)2+Cu Fe和Al(NO3)3不反应2.根据题中给出的信息判断加入物质是否过量
Ag、Cu不与稀硫酸反应
Fe+H2SO4=FeSO4+H2
3.再结合化学反应方程式,比较反应前后溶液中溶质的相对分子质量大小
340 180188 180规 律 :
(1)若将两种(或多种)金属单质同时放入某金属的盐溶液中,最活泼的金属优先与盐发生置换反应(如:把Fe 、 Cu 放入 AgNO3溶液中)
(2)若将某金属的单质放入多种金属的盐溶液中,该金属优先置换最不活泼的金属。(如Fe 放入 Cu(NO3)2和 AgNO3溶液中)“距离产生美” 1.(10河南)右边是某探究实验装置图。一段时间后,能观察到什么现象?
(装置气密性良好,且开始时U型管两端的红墨水液面相平) 答案:铁钉生锈,U型管液面变为左高右低。冲刺中考 仿真模拟2.小莹同学向过量的稀硫酸中加入一定质量的镁条后,绘制了如下表示其变化过程的坐标曲线图,其中不正确的是( ? )C 3.(12河南)某化学小组用一定量AgNO3和Cu(NO3)2混合溶液进行了下图实验,?并对溶液A和固体B的成分进行了分析和实验探究。
【提出问题】溶液A中的溶质可能有哪些?
【作出猜想】①只有Zn(NO3)2
② Zn (NO3)2、AgNO3 ③ Zn (NO3)2、Cu(NO3)2
④Zn (NO3)2、AgNO3、Cu(NO3)2
【交流讨论】不合理的猜想是____(填标号),其理由是_____________________________________
________________________________________。
② Zn应先与AgNO3反应后与Cu(NO3)2反应,当有AgNO3剩余时,溶质中一定含有Cu(NO3)2【实验探究】若猜想①成立,通过以下实验可确定固体B的成分,请将下表填写完整。
稀盐酸(或稀硫酸等)Zn+2HCl=ZnCl2+H2↑
(Zn+H2SO4=ZnSO4+H2↑) 金
属
材
料合 金金 属物理性质(铁、铝、铜等的相似性和差异性)色、态、延展性、导电性、
传热性、硬度、密度、熔沸点化学 性 质与氧气的反应与酸的反应与盐的反应置换反应金属活动
性顺序(铁、铝、铜、镁)(铁、铝与铜盐、铜与银盐、汞盐)金属资源的利用金属资源的保护铁的冶炼:原料、原理
⒈防止金属锈蚀(铁锈蚀
条件和防止方法),⒉回
收利用废旧金属,⒊合
理、有计划开采矿物,
⒋寻找金属的代用品铁合金(不锈钢、生铁、钢),铜、铝、钛合金两
者
性
质
上
不
同(镁、锌、铁与
盐酸、稀硫酸)概括整合 总结反馈谢谢大家
请多指教
了解合金的特性及应用,认识金属材料在生产、生活和 社会发展中的重要作用.
2.认识常见金属的化学性质,了解常见金属与氧气、酸(盐酸、稀硫酸)的反应和与某些盐(硫酸铜溶液,硝酸银溶液)的反应
3.知道一些常见金属(铁、铝等)矿物,了解从铁矿石中将铁 还原出来的原理
4.能进行钢铁锈蚀条件的探究实验,了解防止金属腐蚀的简单方法
5.认识废弃金属对环境的污染,知道回收金属的重要性
6.能进行金属的物理性质和某些化学性质的探究实验考纲要求 细心解读考点1 金属材料、 金属的物理性质
1、金属的物理性质
(1)在常温下除汞 以外,金属单质都是_____,都具有金属光泽,具有良好的______和______,因此可以制成导线和炊具;同时具有_____可以拉成丝,展成片 。
(2)物质的性质在很大程度上决定物质的用途 ,但这不是唯一的决定因素,还要考虑到______________________________,以废料是否易于回收和对环境的影响等多种因素。
知识梳理 针对练习 固体导电性导热性延展性价格、资源、是否美观、使用是否便利
2、合金
(1)概念:
合金是指___________融合某些金属或非金属而成的具有金属特性的物质
(合金属于混合物;合金中至少含有一种金属;制合金的 过程属于物理变化)
(2)特性:
合金与组成它的金属相比_____低、_____大,具有更优良的机械性能
(3)铁合金:_____和____在金属中加热熔点硬度生铁钢考点2 金属的化学性质1.与氧气反应:
4Al+3O2=2Al2O3 3Fe+2O2 = Fe3O4 2Cu+O2=2CuO
2.与酸反应:
规律:金属+酸 = 盐+氢气
Fe+2HCl = FeCl2+H2↑
Zn+H2SO4= ZnSO4+H2↑
该反应发生的条件:①金属必须是排在金属活动性顺序氢之前
②酸指盐酸和稀硫酸不能是浓硫酸和硝酸
点燃 3.与盐反应
规律: 金属+盐 =新盐+新金属
Cu+ 2AgNO3 = Cu(NO3)2+2Ag
Fe+CuSO4 = FeSO4+Cu
该反应发生的条件:
①金属的活动性排在盐中金属的活动性之前
②盐必为可溶性盐
注意:①并不是所有的排在前面的金属都能把排在后面的 金属从其盐溶液中置换出来,如K 、Ca 、 Na
②该类反应现象的叙述
置换反应:单质+化合物=单质+化合物
考点3 金属矿物及铁的冶炼(1)金属矿物: 铁矿石、铝矿石、铜矿石
(2)铁的冶炼:
原 料:
原 理:
现 象:
步 骤:
尾 气 :
红色粉末变为黑色,澄清石灰水变浑浊。先通CO,后加热;反应完毕后,先停止加热,继续通CO直到试管冷却再停止通CO。焦炭、铁矿石、石灰石 用点燃或用气球收集尾气,防止CO污染空气考点4 铁的防锈、金属资源的保护 (1)生锈的条件:(2)防锈的方法:(3)金属资源的保护措施:与水和氧气同时接触。 例1. (10河南)请回答下列有关金属的问题。
铝是活泼金属,为什么通常铝锅却很耐腐蚀?
答案:铝与氧气反应,其表面生成致密的氧化铝薄膜起保护作用。
例2.下列物质能由金属和酸反应直接制取的是( )
A. AgCl B . FeCl3 C. CuCl2 D . AlCl3
例3.(12滨州)工人师傅切割铁板时,常用硫酸铜溶液在铁板上画线即可留下红色印迹,此过程发生反应的方程式是__________________
DFe+CuSO4=Cu+FeSO4 例4.钢铁是人类生活和生产中非常重要的材料,但全世界每年都有约四分之一的钢铁因生锈损失。某化学课外活动小组,对钢铁制品锈蚀的条件进行如下探究,设计了如图所示的实验,据此回答下列有关问题: (1)一周后,观察到编号为______的试管中的铁钉锈蚀严重。B (2)常温下,铁生锈的条件是铁跟______和______ 等物质相互作用的结果,铁锈的主要成分是__________(用化学式表示)。
(3)欲除去铁锈,同学们提出了三种不同的实验方
法:①用砂布擦;②用稀盐酸洗;③用稀碱液泡。你认为最有效的方法是____________(填序号)。
(4)如何防止家庭中常用的铁制品生锈,简单易行的方法有(列举一种方法)_____________________。
氧气水Fe2O3②刷漆、涂油有关金属活动性顺序的应用: 1.判断金属的活动性强弱;
2.判断金属能否与酸反应;
3.判断金属能否与盐反应。
重点突破 能力提升 题型一 、判断金属的活动性顺序方法:
1.能否与酸溶液反应。若能则排在氢之前,若不能则排在氢之后
2. 能否发生“前置后”的反应。若A能把B从它的盐溶液中置换出来,则A比B活泼。例1(10河南)X、Y、Z是三种金属固体,将X和Y浸入稀硫酸中,Y溶解并产生氢气,X无变化;将X和Z浸入硝酸银溶液中,X表面有银析出而Z无变化
①判断X、Y、Z和银四种金属的活动性由强到弱的顺序。
答案:Y、x、Ag、z
②具体确定一种X后,写出X与硝酸银溶液反应的化学方程式.
Cu+2AgN03=Cu(N03)2+2Ag
题型二、验证金属的活动性顺序例2(06河南)请设计两个实验证明Zn、 Cu 、 Ag三种金属的活动性顺序。(写出所需试剂即可)
方法:
先将金属按其活动性顺序排序: Zn、 Cu 、 Ag 。
试剂一:“ 盐、金、盐”(两边盐中间金属)
如: Zn(NO3)2溶液、Cu、AgNO3溶液。
试剂二: “金、盐、金”(两边金属中间盐)
如:Zn、 CuSO4溶液、Ag。
试剂三:用酸验证氢前和氢后金属,再选另一种金属的盐溶 液。如:Zn、Cu、稀盐酸、 AgNO3 溶液。
例3(11河南)在Cu(NO3) 2﹑Al(NO3)3和AgNO3的混合溶液中加入一定量的铁粉,充分反应后过滤。向滤出的固体上滴加稀硫酸时有气泡产生。则反应后所得溶液中含有的金属离子有_____;反应后溶液的质量比原来混合溶液的质量_____(填“大”或“小”);有关的化学反应方程式为_______________(写出一个即可)。 题型三、滤液、滤渣问题方法:
1.先判断溶液中哪些反应可以发生,写出化学反应方程式
Fe+2AgNO3=Fe(NO3)2+2Ag
Fe+ Cu(NO3)2=Fe(NO3)2+Cu Fe和Al(NO3)3不反应2.根据题中给出的信息判断加入物质是否过量
Ag、Cu不与稀硫酸反应
Fe+H2SO4=FeSO4+H2
3.再结合化学反应方程式,比较反应前后溶液中溶质的相对分子质量大小
340 180188 180规 律 :
(1)若将两种(或多种)金属单质同时放入某金属的盐溶液中,最活泼的金属优先与盐发生置换反应(如:把Fe 、 Cu 放入 AgNO3溶液中)
(2)若将某金属的单质放入多种金属的盐溶液中,该金属优先置换最不活泼的金属。(如Fe 放入 Cu(NO3)2和 AgNO3溶液中)“距离产生美” 1.(10河南)右边是某探究实验装置图。一段时间后,能观察到什么现象?
(装置气密性良好,且开始时U型管两端的红墨水液面相平) 答案:铁钉生锈,U型管液面变为左高右低。冲刺中考 仿真模拟2.小莹同学向过量的稀硫酸中加入一定质量的镁条后,绘制了如下表示其变化过程的坐标曲线图,其中不正确的是( ? )C 3.(12河南)某化学小组用一定量AgNO3和Cu(NO3)2混合溶液进行了下图实验,?并对溶液A和固体B的成分进行了分析和实验探究。
【提出问题】溶液A中的溶质可能有哪些?
【作出猜想】①只有Zn(NO3)2
② Zn (NO3)2、AgNO3 ③ Zn (NO3)2、Cu(NO3)2
④Zn (NO3)2、AgNO3、Cu(NO3)2
【交流讨论】不合理的猜想是____(填标号),其理由是_____________________________________
________________________________________。
② Zn应先与AgNO3反应后与Cu(NO3)2反应,当有AgNO3剩余时,溶质中一定含有Cu(NO3)2【实验探究】若猜想①成立,通过以下实验可确定固体B的成分,请将下表填写完整。
稀盐酸(或稀硫酸等)Zn+2HCl=ZnCl2+H2↑
(Zn+H2SO4=ZnSO4+H2↑) 金
属
材
料合 金金 属物理性质(铁、铝、铜等的相似性和差异性)色、态、延展性、导电性、
传热性、硬度、密度、熔沸点化学 性 质与氧气的反应与酸的反应与盐的反应置换反应金属活动
性顺序(铁、铝、铜、镁)(铁、铝与铜盐、铜与银盐、汞盐)金属资源的利用金属资源的保护铁的冶炼:原料、原理
⒈防止金属锈蚀(铁锈蚀
条件和防止方法),⒉回
收利用废旧金属,⒊合
理、有计划开采矿物,
⒋寻找金属的代用品铁合金(不锈钢、生铁、钢),铜、铝、钛合金两
者
性
质
上
不
同(镁、锌、铁与
盐酸、稀硫酸)概括整合 总结反馈谢谢大家
请多指教
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
