沪教版九年级上册化学 3.1.2 原子 课件(34张PPT)
文档属性
| 名称 | 沪教版九年级上册化学 3.1.2 原子 课件(34张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 111.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-07-16 00:00:00 | ||
图片预览









文档简介
课件34张PPT。构成物质的基本微粒
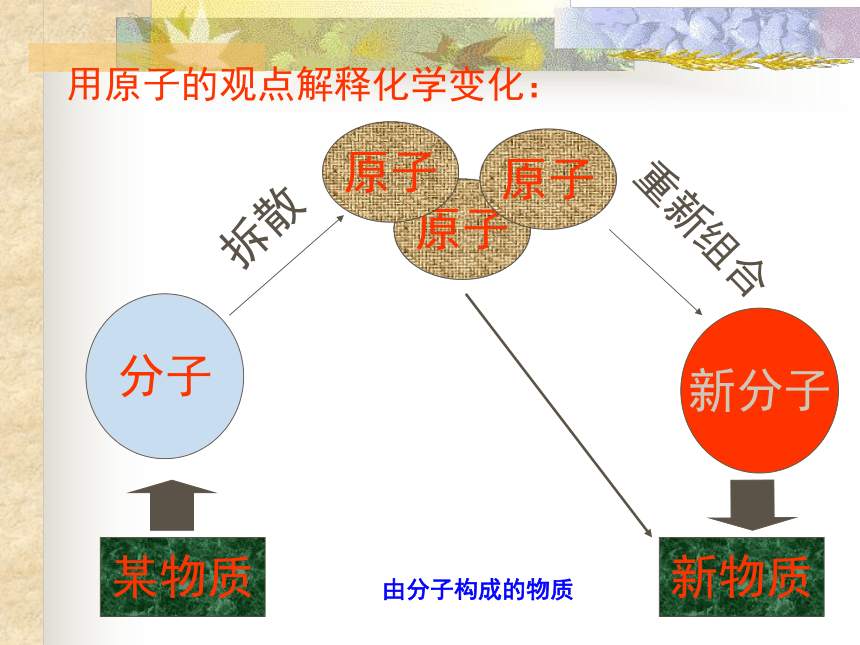
分子新分子用原子的观点解释化学变化: 原子和分子最大的区别就是:分子在化学变化中可以再分,而原子在化学变化中不能再分。原子通过其他方法可以再分吗?思考一?原子(不带电)原子核(带正电荷)质子中子(带正电荷)(不带电)核外电子(带负电荷)注:普通氢原子无中子 每个原子只有1个原子核
不同原子的区别是原子核不同 科学家研究发现:原子是由带正电荷的原子核和带负电荷的核外电子构成的。二者所带电量大小相等,电性相反,因而原子不显电性(呈中性)。 核电核数==质子数=核外电子数
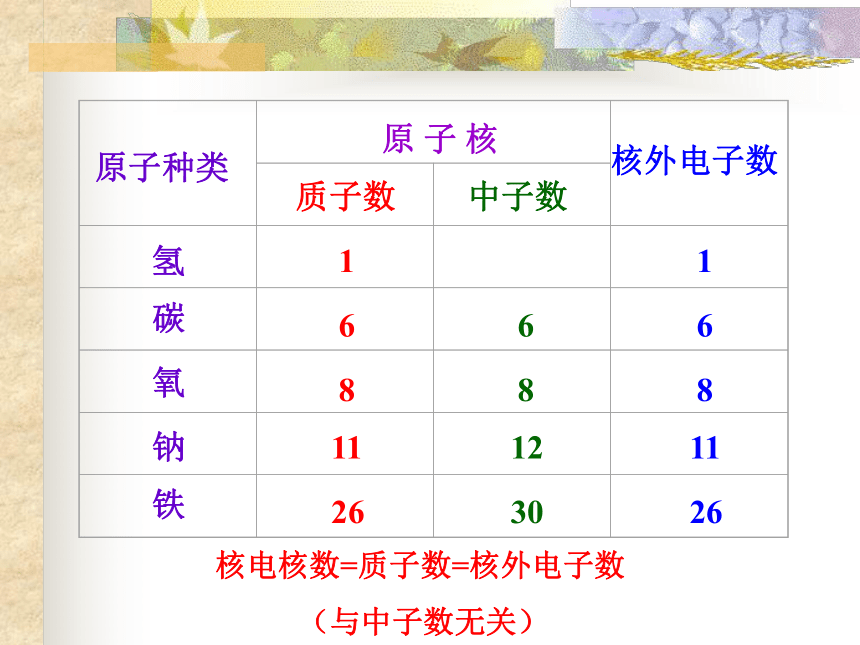
(与中子数无关) 原子核在原子中所占体积极小,但是几乎集中了原子全部的质量。 核外电子在核外作高速运动,电子的质量相对要小得多。原子种类原 子 核质子数中子数核外电子数氢碳氧钠铁16811266812301681126 核电核数=质子数=核外电子数
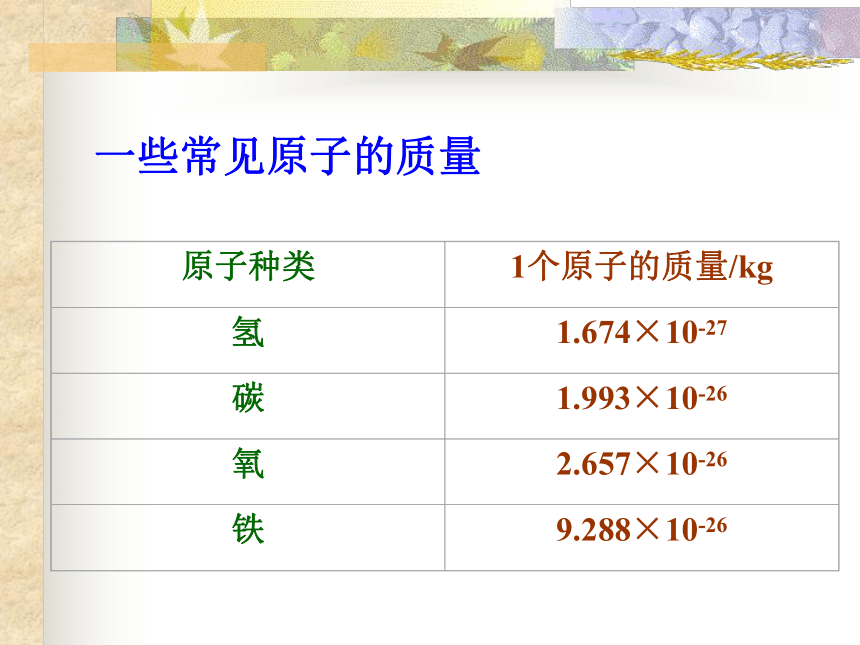
(与中子数无关)原子那么小,有没有质量? 原子虽很小,但也有一定的质量,而且不同原子的质量不同。思考二一些常见原子的质量1、相对原子质量 规定以一种碳原子的质量的1/12作为标准,其它原子的质量跟它比较所得的值,就是该原子的相对原子质量。 相对原子质量只是一个比值,单位为1,一般不写出。 例如:氢的相对原子质量 =1.674×10-27 kg1.66×10-27 kg≈氧的相对原子质量 = 2.657×10-26 kg1.66×10-27 kg≈116一种碳原子的质量的1/12约为1.66×10-27 kg铁的相对原子质量 =9.288×10-26 kg1.66×10-27 kg≈2、某原子的相对原子质量 = 该原子的一个原子的实际质量( kg)一种碳原子实际质量的1/12 ( kg)(只是一个比值) 相对原子质量与原子的质量成正比,原子质量越大,相对原子质量越大。56 一般化学计算中采用相对原子质量的近似值 一个质子和中子的质量大约相等,都约等于碳12原子质量的1/12,即约等于1个氢原子的质量,电子的质量很小,仅相当于质子(或中子)质量的1/1836。因此,电子的质量可以忽略不计,原子的质量主要集中在原子核上。3、相对原子质量 ≈ 质子数 + 中子数[练习](1)、氮原子核内有7个质子,7个中子,7个电子,氮的相对原子质量是多少?14(2)、磷原子核内有15个质子,16个中子,15个电子,磷的相对原子质量是多少?31原子(不带电)原子核(带正电荷)质子中子(带正电荷)(不带电)核外电子(带负电荷)注:普通氢原子无中子 核电核数=质子数=核外电子数
(与中子数无关)相对原子质量 ≈ 质子数 + 中子数原子种类原子核质子数中子数 核外 电子数氢碳氧钠铁16811266812301681126相对原子质量112162356 分子是由原子结合而成的,我们可以用相对原子质量表示分子质量的大小。 相对分子质量等于构成分子的各原子的相对原子质量的总和。例如:计算氯化钠的相对分子质量 氯化钠的化学式是:NaCl,它的相对分子质量等于钠的相对原子质量和氯原子的相对原子质量之和。NaCl的相对分子质量=23+35.5=58.5 根据表3-4相对原子质量的数据,算一算氧气(O2)、水(H2O)、二氧化碳(CO2)分子的相对分子质量是多少。氧分子的相对分子质量 =水分子的相对分子质量 =CO2分子的相对分子质量 =16 + 16 = 321×2 + 16 = 18 12 + 16×2 = 44计算:五水硫酸铜分子的相对分子质量化学式:CuSO4 · 5H2O63.5 + 32 + 16×4 + 5×(1×2 + 16) = 249.5 原子是由原子核与核外电子构成,而原子核的体积只占原子体积的几千亿分之一,相对来说,原子里有很大的空间,电子就在这个空间里做高速运动,那么电子是怎样排步在核外空间的呢? 氢原子的原子核有一个质子,核外有一个电子,它在核外一定距离的空间内作高速运动。 那么在含有多个电子的原子里,所有的电子是否在同一区域内运动? 在含有多个电子的原子里,电子是分层运动的。离核最近的叫第一层离核稍远的叫第二层由里往外依此类推
叫三、四、五、六、七层 核外电子的分层排步1、电子层符号K L M N O P Qn1 2 3 4 5 6 7 能量高低离核远近低高近远2、各电子层最多容纳的电子数2个 8个 18个 32个 …… 2n2个电子排步的一般规律①电子按能量高低先排入能量最低的电子层,然后再排入能量较高的电子层②作为最外层,最多不超过8个电子(K层2个)原子结构示意图用圆圈表示原子核在圆圈内用正数表示质子数用弧线表示电子层在弧线上的数字表示该电子层上的电子数+11氢(H)锂(Li)+321钠(Na)+11281第一层最多容纳2个电子第二层最多容纳8个电子+192881+202882特 别 记 忆钾(K)钙(Ca)注意:①核电核数=质子数=核外电子数②电子层上的电子数必须符合核外电子的排步规律结论(1)质子数决定元素种类(2)质子数和核外电子数的异同决定微粒是离子或原子 在化学变化中,电中性的原子经常会得到电子或失去电子而成为带电荷的微粒,这种带电的微粒称为离子。离子离子也是构成物质的微粒之一。离子是原子失去或得到电子的产物。 原子、离子和分子都是构成物质的基本微粒。原子结合物质,如铜、铁、钙等。金刚石、硅等。分子结合分解聚集物质,如氧气等。失去或得到电子离子得到或失去电子结合物质,如氯化钠等。分子、原子、离子间的转化。
分子新分子用原子的观点解释化学变化: 原子和分子最大的区别就是:分子在化学变化中可以再分,而原子在化学变化中不能再分。原子通过其他方法可以再分吗?思考一?原子(不带电)原子核(带正电荷)质子中子(带正电荷)(不带电)核外电子(带负电荷)注:普通氢原子无中子 每个原子只有1个原子核
不同原子的区别是原子核不同 科学家研究发现:原子是由带正电荷的原子核和带负电荷的核外电子构成的。二者所带电量大小相等,电性相反,因而原子不显电性(呈中性)。 核电核数==质子数=核外电子数
(与中子数无关) 原子核在原子中所占体积极小,但是几乎集中了原子全部的质量。 核外电子在核外作高速运动,电子的质量相对要小得多。原子种类原 子 核质子数中子数核外电子数氢碳氧钠铁16811266812301681126 核电核数=质子数=核外电子数
(与中子数无关)原子那么小,有没有质量? 原子虽很小,但也有一定的质量,而且不同原子的质量不同。思考二一些常见原子的质量1、相对原子质量 规定以一种碳原子的质量的1/12作为标准,其它原子的质量跟它比较所得的值,就是该原子的相对原子质量。 相对原子质量只是一个比值,单位为1,一般不写出。 例如:氢的相对原子质量 =1.674×10-27 kg1.66×10-27 kg≈氧的相对原子质量 = 2.657×10-26 kg1.66×10-27 kg≈116一种碳原子的质量的1/12约为1.66×10-27 kg铁的相对原子质量 =9.288×10-26 kg1.66×10-27 kg≈2、某原子的相对原子质量 = 该原子的一个原子的实际质量( kg)一种碳原子实际质量的1/12 ( kg)(只是一个比值) 相对原子质量与原子的质量成正比,原子质量越大,相对原子质量越大。56 一般化学计算中采用相对原子质量的近似值 一个质子和中子的质量大约相等,都约等于碳12原子质量的1/12,即约等于1个氢原子的质量,电子的质量很小,仅相当于质子(或中子)质量的1/1836。因此,电子的质量可以忽略不计,原子的质量主要集中在原子核上。3、相对原子质量 ≈ 质子数 + 中子数[练习](1)、氮原子核内有7个质子,7个中子,7个电子,氮的相对原子质量是多少?14(2)、磷原子核内有15个质子,16个中子,15个电子,磷的相对原子质量是多少?31原子(不带电)原子核(带正电荷)质子中子(带正电荷)(不带电)核外电子(带负电荷)注:普通氢原子无中子 核电核数=质子数=核外电子数
(与中子数无关)相对原子质量 ≈ 质子数 + 中子数原子种类原子核质子数中子数 核外 电子数氢碳氧钠铁16811266812301681126相对原子质量112162356 分子是由原子结合而成的,我们可以用相对原子质量表示分子质量的大小。 相对分子质量等于构成分子的各原子的相对原子质量的总和。例如:计算氯化钠的相对分子质量 氯化钠的化学式是:NaCl,它的相对分子质量等于钠的相对原子质量和氯原子的相对原子质量之和。NaCl的相对分子质量=23+35.5=58.5 根据表3-4相对原子质量的数据,算一算氧气(O2)、水(H2O)、二氧化碳(CO2)分子的相对分子质量是多少。氧分子的相对分子质量 =水分子的相对分子质量 =CO2分子的相对分子质量 =16 + 16 = 321×2 + 16 = 18 12 + 16×2 = 44计算:五水硫酸铜分子的相对分子质量化学式:CuSO4 · 5H2O63.5 + 32 + 16×4 + 5×(1×2 + 16) = 249.5 原子是由原子核与核外电子构成,而原子核的体积只占原子体积的几千亿分之一,相对来说,原子里有很大的空间,电子就在这个空间里做高速运动,那么电子是怎样排步在核外空间的呢? 氢原子的原子核有一个质子,核外有一个电子,它在核外一定距离的空间内作高速运动。 那么在含有多个电子的原子里,所有的电子是否在同一区域内运动? 在含有多个电子的原子里,电子是分层运动的。离核最近的叫第一层离核稍远的叫第二层由里往外依此类推
叫三、四、五、六、七层 核外电子的分层排步1、电子层符号K L M N O P Qn1 2 3 4 5 6 7 能量高低离核远近低高近远2、各电子层最多容纳的电子数2个 8个 18个 32个 …… 2n2个电子排步的一般规律①电子按能量高低先排入能量最低的电子层,然后再排入能量较高的电子层②作为最外层,最多不超过8个电子(K层2个)原子结构示意图用圆圈表示原子核在圆圈内用正数表示质子数用弧线表示电子层在弧线上的数字表示该电子层上的电子数+11氢(H)锂(Li)+321钠(Na)+11281第一层最多容纳2个电子第二层最多容纳8个电子+192881+202882特 别 记 忆钾(K)钙(Ca)注意:①核电核数=质子数=核外电子数②电子层上的电子数必须符合核外电子的排步规律结论(1)质子数决定元素种类(2)质子数和核外电子数的异同决定微粒是离子或原子 在化学变化中,电中性的原子经常会得到电子或失去电子而成为带电荷的微粒,这种带电的微粒称为离子。离子离子也是构成物质的微粒之一。离子是原子失去或得到电子的产物。 原子、离子和分子都是构成物质的基本微粒。原子结合物质,如铜、铁、钙等。金刚石、硅等。分子结合分解聚集物质,如氧气等。失去或得到电子离子得到或失去电子结合物质,如氯化钠等。分子、原子、离子间的转化。
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
